ТК РФ Статья 73. Перевод работника на другую работу в соответствии с медицинским заключением / КонсультантПлюс
ТК РФ Статья 73. Перевод работника на другую работу в соответствии с медицинским заключением
(в ред. Федерального закона от 30.06.2006 N 90-ФЗ)
Путеводитель по кадровым вопросам. Вопросы применения ст. 73 ТК РФ
Работника, нуждающегося в переводе на другую работу в соответствии с медицинским заключением, выданным в порядке, установленном федеральными законами и иными нормативными правовыми актами Российской Федерации, с его письменного согласия работодатель обязан перевести на другую имеющуюся у работодателя работу, не противопоказанную работнику по состоянию здоровья.
Если работник, нуждающийся в соответствии с медицинским заключением во временном переводе на другую работу на срок до четырех месяцев, отказывается от перевода либо соответствующая работа у работодателя отсутствует, то работодатель обязан на весь указанный в медицинском заключении срок отстранить работника от работы с сохранением места работы (должности).
Если в соответствии с медицинским заключением работник нуждается во временном переводе на другую работу на срок более четырех месяцев или в постоянном переводе, то при его отказе от перевода либо отсутствии у работодателя соответствующей работы трудовой договор прекращается в соответствии с пунктом 8 части первой статьи 77 настоящего Кодекса.
Трудовой договор с руководителями организаций (филиалов, представительств или иных обособленных структурных подразделений), их заместителями и главными бухгалтерами, нуждающимися в соответствии с медицинским заключением во временном или в постоянном переводе на другую работу, при отказе от перевода либо отсутствии у работодателя соответствующей работы прекращается в соответствии с пунктом 8 части первой статьи 77 настоящего Кодекса.
Открыть полный текст документа
Ст. 72.1 ТК РФ. Перевод на другую работу. Перемещение
Перевод на другую работу — постоянное или временное изменение трудовой функции работника и (или) структурного подразделения, в котором работает работник (если структурное подразделение было указано в трудовом договоре), при продолжении работы у того же работодателя, а также перевод на работу в другую местность вместе с работодателем. Перевод на другую работу допускается только с письменного согласия работника, за исключением случаев, предусмотренных частями второй и третьей статьи 72.
По письменной просьбе работника или с его письменного согласия может быть осуществлен перевод работника на постоянную работу к другому работодателю. При этом трудовой договор по прежнему месту работы прекращается (пункт 5 части первой статьи 77 настоящего Кодекса).
Не требует согласия работника перемещение его у того же работодателя на другое рабочее место, в другое структурное подразделение, расположенное в той же местности, поручение ему работы на другом механизме или агрегате, если это не влечет за собой изменения определенных сторонами условий трудового договора.
Запрещается переводить и перемещать работника на работу, противопоказанную ему по состоянию здоровья.
См. все связанные документы >>>
1. В ст. 72.1 даны понятия «перевод на другую работу» и «перемещение». Переводом на другую работу в соответствии с комментируемой статьей является постоянное или временное изменение трудовой функции работника и (или) структурного подразделения, в котором работает работник (если структурное подразделение было указано в трудовом договоре), при продолжении работы у того же работодателя, а также перевод на работу в другую местность вместе с работодателем. Как следует из содержания приведенной нормы, изменение других условий, определенных трудовым договором (например, режима работы, оплаты труда), не является переводом на другую работу.
В ст. 72.1 даны понятия «перевод на другую работу» и «перемещение». Переводом на другую работу в соответствии с комментируемой статьей является постоянное или временное изменение трудовой функции работника и (или) структурного подразделения, в котором работает работник (если структурное подразделение было указано в трудовом договоре), при продолжении работы у того же работодателя, а также перевод на работу в другую местность вместе с работодателем. Как следует из содержания приведенной нормы, изменение других условий, определенных трудовым договором (например, режима работы, оплаты труда), не является переводом на другую работу.
Перевод на другую работу, так же как и изменение других определенных сторонами условий трудового договора, возможен только с письменного согласия работника. Исключение из этого правила допускается лишь в случаях, указанных в ч. ч. 2 и 3 ст. 72.2 (см. коммент. к ней).
Если перевод на другую постоянную или временную работу у того же работодателя осуществлен без письменного согласия работника, но работник не возражал против такого перевода и приступил к выполнению другой работы, такой перевод может считаться законным. Однако выполнение работником другой работы не освобождает работодателя от обязанности получить от работника письменное подтверждение такого согласия на перевод.
Однако выполнение работником другой работы не освобождает работодателя от обязанности получить от работника письменное подтверждение такого согласия на перевод.
В тех случаях, когда переведенный на другую работу у того же работодателя работник приступил к выполнению этой работы, но считает, что перевод осуществлен в нарушение законодательства, он может обжаловать незаконный перевод в органы по рассмотрению трудовых споров.
2. Перевод на другую постоянную работу или временный перевод на другую работу у того же работодателя, а также перевод на постоянную работу в другую местность вместе с работодателем оформляются приказом (распоряжением) работодателя по установленной форме.
При переводе на работу в другую местность работникам выплачиваются соответствующие компенсации: стоимость проезда самого работника и членов его семьи, стоимость провоза багажа, расходы по обустройству на новом месте и др. Конкретные размеры возмещения расходов определяются соглашением сторон трудового договора (см. коммент. к ст. 169).
коммент. к ст. 169).
Под другой местностью следует понимать местность за пределами административно-территориальных границ соответствующего населенного пункта (п. 16 Постановления Пленума ВС РФ от 17.03.2004 N 2).
Перевод на работу из одного населенного пункта в другой даже в пределах одного административного района рассматривается как перевод в другую местность независимо от наличия автобусного или иного регулярного сообщения между этими пунктами.
Отказ работника от перевода в другую местность вместе с работодателем является основанием для прекращения с ним трудового договора по п. 9 ст. 77 ТК. Отказ от перевода в филиал или представительство организации, расположенные в другой местности, не может являться основанием для расторжения трудового договора с работником, если сам работодатель в эту другую местность не перемещается (см. коммент. к ст. 77).
При увольнении работников в связи с отказом от перевода в другую местность вместе с работодателем им выплачивается выходное пособие в размере двухнедельного среднего заработка (ч.
3. Перевод на работу к другому работодателю может быть осуществлен по просьбе работника, изложенной в письменной форме, или с его письменного согласия, если инициатива в переводе исходит от работодателя.
Перевод на постоянную работу к другому работодателю влечет изменение одной стороны трудового договора, поэтому он рассматривается законодателем как самостоятельное основание прекращения трудового договора (п. 5 ст. 77 ТК). Работнику, письменно приглашенному на работу в порядке перевода от другого работодателя, не может быть отказано в заключении трудового договора в течение одного месяца со дня увольнения с прежнего места работы (см. коммент. к ст. 64). В трудовой книжке работника в этом случае производятся записи об увольнении и о приеме на работу с указанием порядка, в котором осуществлено увольнение в связи с переводом — по просьбе работника или с его согласия (п. 6.1 Инструкции по заполнению трудовых книжек).
4. Перевод на другую постоянную работу или временный перевод на другую работу у того же работодателя возможен по различным обстоятельствам. При этом инициатива в переводе может исходить как от работодателя, так и от самого работника (например, в связи с тем, что он повысил квалификацию).
При этом инициатива в переводе может исходить как от работодателя, так и от самого работника (например, в связи с тем, что он повысил квалификацию).
В ряде случаев у работодателя возникает обязанность перевести работника с его согласия на другую работу, например в случае, когда работник нуждается в соответствии с медицинским заключением в предоставлении другой работы (см. коммент. к ст. 73).
В тех случаях, когда работа, на которую переведен работник в соответствии с медицинским заключением, является нижеоплачиваемой, за работником сохраняется его прежний средний заработок в течение месяца со дня перевода, а при переводе в связи с трудовым увечьем, профессиональным заболеванием или иным повреждением здоровья, связанным с работой, — до установления стойкой утраты трудоспособности либо до выздоровления работника (см. коммент. к ст. 182).
В отдельных случаях, предусмотренных законодательством, работодатель обязан предложить работнику перевод на другую работу. Такая обязанность может возникнуть, например, при сокращении численности или штата, если у работодателя для работника, подлежащего сокращению, имеется другая работа (см. коммент. к ч. 3 ст. 81). Работодатель обязан предложить другую имеющуюся у него работу лицу, признанному по результатам аттестации не соответствующим занимаемой должности (см. коммент. к ст. 81).
коммент. к ч. 3 ст. 81). Работодатель обязан предложить другую имеющуюся у него работу лицу, признанному по результатам аттестации не соответствующим занимаемой должности (см. коммент. к ст. 81).
5. От перевода работника на другую работу следует отличать его перемещение у того же работодателя на другое рабочее место, в другое структурное подразделение, расположенное в той же местности, поручение работы на другом механизме или агрегате. Такое перемещение согласно ч. 3 комментируемой статьи не требует согласия работника, если это не влечет изменения определенных сторонами условий трудового договора (см. коммент. к ст. 57).
Иными словами, изменение рабочего места или структурного подразделения можно признать перемещением только в том случае, если при заключении трудового договора это конкретное рабочее место (механизм, агрегат) или структурное подразделение не оговаривалось и в трудовом договоре не предусмотрено. Если же конкретное рабочее место (механизм, агрегат) или структурное подразделение указано в трудовом договоре, то оно является его обязательным условием и, следовательно, может быть изменено только с письменного согласия работника.
Под структурными подразделениями следует понимать как филиалы, представительства, так и отделы, цеха, участки и т.д. (п. 16 Постановления Пленума ВС РФ от 17.03.2004 N 2).
Как оформить перевод сотрудника на новую работу в пределах одной организации
В Трудовом кодексе РФ предусмотрено два вида переводов на другую работу: временный (ст. 72.2 ТК РФ) и постоянный.
Виды постоянного переводаПри постоянном переводе сотрудник может быть переведен:
Причины перевода на новую работу в той же организации могут быть различными. Например, расширение или сокращение деятельности организации; решение проблем карьерного роста персонала; результаты аттестации, в соответствии с которыми сотрудника повышают или понижают в должности; медицинские показания и т. п. (ст. 72.1, 73, ч. 3 ст. 81 ТК РФ).
Отличие перевода от перемещенияСледует различать перевод на другую работу в пределах одной организации от перемещения. В обоих случаях сотрудник остается работать в пределах той же организации. Однако эти понятия не идентичны. При перемещении сотрудника меняется его рабочее место. При этом условия трудового договора и трудовая функция остаются прежними. То есть сотрудник выполняет ту же работу при смене рабочего места. В этом случае получать согласие на перемещение самого сотрудника не нужно.
В обоих случаях сотрудник остается работать в пределах той же организации. Однако эти понятия не идентичны. При перемещении сотрудника меняется его рабочее место. При этом условия трудового договора и трудовая функция остаются прежними. То есть сотрудник выполняет ту же работу при смене рабочего места. В этом случае получать согласие на перемещение самого сотрудника не нужно.
При переводе происходит изменение условий трудового договора и трудовой функции сотрудника. Сотрудник считается переведенным на новую должность в той же организации (без изменения местности) при выполнении хотя бы одного из условий:
- изменение трудовой функции, предусмотренной трудовым договором. При этом место работы может измениться или оставаться прежним;
- изменение структурного подразделения, в котором работает сотрудник. В случае когда структурное подразделение как место работы было указано в трудовом договоре с сотрудником.
Перевод допускается только с письменного согласия сотрудника. Запрещается переводить сотрудника на работу, противопоказанную ему по состоянию здоровья.
Запрещается переводить сотрудника на работу, противопоказанную ему по состоянию здоровья.
Такие правила установлены статьей 72.1 Трудового кодекса РФ и разъяснены в пункте 16 постановления Пленума Верховного суда РФ от 17 марта 2004 г. № 2.
Ситуация: является ли переводом изменение названия должности сотрудника без изменения трудовой функции?
Нет, не является.
Изменение наименования должности без изменения трудовой функции переводом не считается. Такой вывод можно сделать на основании части 1 статьи 72.1 Трудового кодекса РФ.
Пример изменения должности сотрудника без изменения трудовой функции
В связи с оптимизацией структуры организации должность В.Н. Зайцевой – помощник бухгалтера – была переименована в младшего бухгалтера.
В организации были оформлены следующие документы:
Кто может быть инициатором перевода
Перевод на постоянную работу в пределах одной организации возможен по инициативе:
- сотрудника;
- работодателя.

Такой порядок предусмотрен в статьях 72 и 72.1 Трудового кодекса РФ.
Ситуация: можно ли перевести сотрудника на другую должность в период его испытательного срока?
Да, можно, но только с письменного согласия сотрудника.
Испытательный срок устанавливается по взаимному соглашению сторон при заключении трудового договора. При этом в период испытания на сотрудника полностью распространяются нормы трудового права. Такие правила установлены в части 1 и 3 статьи 70 Трудового кодекса РФ.
Таким образом, перевести сотрудника в период его испытательного срока на другую работу в пределах одной организации можно с его письменного согласия (ст. 72, 72.1 ТК РФ).
При этом следует учитывать, что испытательный срок устанавливается для того, чтобы проверить, справляется сотрудник с установленными при приеме на работу должностными обязанностями или нет. Перевод на другую должность в период испытательного срока не позволит проверить это в полной мере. Поэтому перевод во время испытательного срока следует осуществлять в исключительных случаях.
Поэтому перевод во время испытательного срока следует осуществлять в исключительных случаях.
Если сотрудник не дал согласия на перевод, трудовой договор может быть прекращен в случаях:
Документальное оформлениеЕсли инициатором перевода выступает сотрудник, он пишет заявление о переводе. Если администрация организации – нужно получить письменное согласие сотрудника на перевод. На практике чаще всего согласие оформляется следующим образом. Сотрудник пишет на приказе о переводе: «Согласен на перевод». В то же время уведомить сотрудника нужно до издания приказа (ст. 72 и 73 ТК РФ). Унифицированной формы уведомления не предусмотрено, поэтому организация может составить его в произвольной форме. На нем сотрудник должен письменно выразить свое согласие или несогласие на перевод. При отказе сотрудника от перевода его можно уволить:
Если инициатива о переводе исходит от руководителя структурного подразделения, нужно подготовить представление о переводе. В этом документе руководитель подразделения должен дать характеристику профессиональным и деловым качествам сотрудника и обосновать причину перевода. На представлении руководитель организации ставит свою резолюцию.
В этом документе руководитель подразделения должен дать характеристику профессиональным и деловым качествам сотрудника и обосновать причину перевода. На представлении руководитель организации ставит свою резолюцию.
Независимо от того, кто выступает инициатором перевода, основанием для издания приказа являются изменения к трудовому договору. Изменения к трудовому договору оформите в виде дополнительного соглашения (ст. 57, 72 и 72.1 ТК РФ).
При этом для издания приказа о переводе организации по собственному выбору могут:
- использовать унифицированную форму приказа (№ Т-5, № Т-5а), утвержденную постановлением Госкомстата России от 5 января 2004 г. № 1, если это утверждено руководителем организации в приказе по учетной политике;
- применять самостоятельно разработанную форму, утвержденную руководителем (при условии что в ней содержатся все необходимые реквизиты, предусмотренные ч. 2 ст. 9 Закона от 6 декабря 2011 г. № 402-ФЗ).
Такой порядок следует из части 4 статьи 9 Закона от 6 декабря 2011 г. № 402-ФЗ и подтверждается письмом Роструда от 14 февраля 2013 г. № ПГ/1487-6-1.
Обратите внимание, что при переводе сотрудника в пределах одной организации работодатель не может установить ему испытательный срок (ст. 70 ТК РФ).
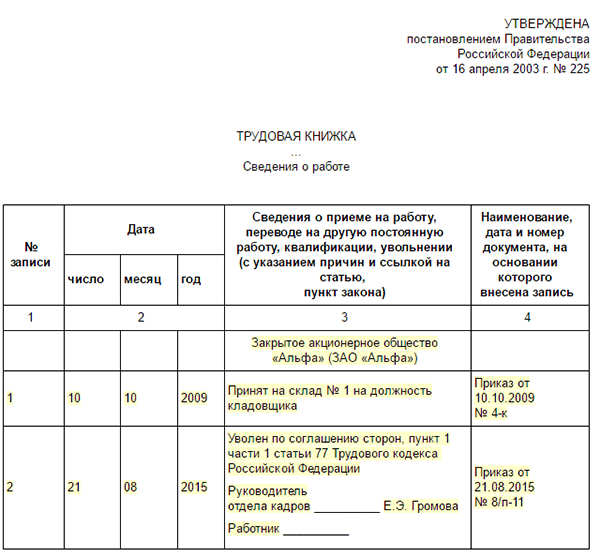
Запись о переводе в трудовую книжку сотрудника внесите не позднее чем через неделю со дня перевода (п. 10 Правил, утвержденных постановлением Правительства РФ от 16 апреля 2003 г. № 225).
В завершение процедуры сделайте запись о переводе в личной карточке сотрудника. С ней ознакомьте сотрудника под подпись.
Пример оформления перевода сотрудника на другую постоянную работу в пределах одной организации
Наладчика оборудования производственного цеха А.В. Лампочкина уведомили о предстоящем его переводе на работу в производственный цех на должность электрика участка. С переводом он согласен. Для внесения изменений в трудовой договор было оформлено дополнительное соглашение к нему. Директор издал приказ о переводе по форме № Т-5.
Директор издал приказ о переводе по форме № Т-5.
Запись о переводе на другую должность была внесена в трудовую книжку сотрудника и в раздел III его личной карточки по форме № Т-2.
Ситуация: реквизиты какого документа (трудового договора или дополнительного соглашения к нему) нужно указать в строке формы № Т-5 «Изменение к трудовому договору от…»?
В строке формы № Т-5 «Изменение к трудовому договору от…» можно указать реквизиты только одного документа. Поэтому можно изменить строку, чтобы фраза звучала так: «Изменение от… к трудовому договору от…». Это позволит организации указать в приказе дату и номер как самого трудового договора, так и дополнительного соглашения к нему. Вносить дополнения в унифицированные формы позволяет абзац 2 Порядка, утвержденного постановлением Госкомстата России от 24 марта 1999 г. № 20.
Перевод по медицинскому заключениюВ некоторых случаях администрация организации обязана перевести сотрудника на другую работу. Например, в случае когда сотрудник не может выполнять прежнюю работу в соответствии с медицинским заключением. С согласия сотрудника администрация должна перевести его на другую работу, не противопоказанную ему по состоянию здоровья. Предложение с перечнем вакантных должностей, имеющихся в организации, можно составить в произвольной форме. Эти должности должны соответствовать ограничениям по работе, отраженным в медицинском заключении сотрудника, и подходить ему по состоянию здоровья. При этом в качестве медицинского заключения может выступать, в частности, справка об установлении инвалидности и индивидуальная программа реабилитации инвалида, которые выданы по результатам медико-социальной экспертизы (определение Верховного суда РФ от 25 ноября 2011 г. № 19-В11-19). На предложение работодателя сотрудник должен письменно дать свое согласие на перевод или отказаться от него. Это следует из части 1 статьи 73 Трудового кодекса РФ.
Если сотрудник согласится на перевод, оформите приказ и внесите соответствующие записи в трудовую книжку и личную карточку сотрудника (п. 10 Правил, утвержденных постановлением Правительства РФ от 16 апреля 2003 г. № 225).
При переводе сотрудника по медицинским показаниям новая работа может быть как более высокооплачиваемой, так и нижеоплачиваемой. Если сотрудник переведен на нижеоплачиваемую работу, то в течение месяца со дня перевода за ним нужно сохранить его средний заработок по прежней работе. Если перевод связан с тем, что сотрудник получил увечье или профессиональное заболевание, то средний заработок сохраняется за ним до тех пор, пока сотрудник не выздоровеет или врачи не установят его инвалидность. Такой порядок установлен в статье 182 Трудового кодекса РФ.
Может возникнуть ситуация, когда сотрудник, нуждающийся по медицинским показаниям во временном переводе, отказывается от него или в организации нет подходящих вакансий. Тогда действия организации зависят от срока, на который в соответствии с медицинским заключением сотрудника нужно перевести на другую работу. Если сотрудник нуждается во временном переводе на период до четырех месяцев, то отстраните его от работы на весь срок, указанный в медицинском заключении. При этом за сотрудником нужно сохранить его место работы (должность). Зарплату или другие социальные выплаты за этот период не начисляйте, если иное не предусмотрено трудовым (коллективным) договором или законодательством (например, п. 2 ст. 33 Закона от 30 марта 1999 г. № 52-ФЗ). Об этом сказано в части 2 статьи 73 Трудового кодекса РФ.
Если сотруднику необходим временный перевод на срок более четырех месяцев или постоянный перевод, то при отказе от вакансии (отсутствии вакансий в организации) его нужно уволить (ч. 3 ст. 73 ТК РФ). Основанием для увольнения является пункт 8 части 1 статьи 77 Трудового кодекса РФ. Увольнение по указанному основанию направлено на охрану здоровья сотрудника и не считается нарушением его прав (определение Конституционного суда РФ от 14 июля 2011 г. № 887-О-О).
Особый порядок увольнения в случае отказа от вакансии (отсутствия в организации вакансий) при переводе по медицинским показаниям предусмотрен для руководителей, их заместителей и главных бухгалтеров в части 4 статьи 73 Трудового кодекса РФ. Даже если срок перевода менее четырех месяцев, организация вправе уволить таких сотрудников по пункту 8 части 1 статьи 77 Трудового кодекса РФ. Однако с письменного согласия сотрудника трудовой договор с ним можно не расторгать, а отстранить его от работы на период, определенный по соглашению сторон. Зарплату или другие социальные выплаты за этот период не начисляйте, если иное не предусмотрено трудовым (коллективным) договором или законодательством (например, п. 2 ст. 33 Закона от 30 марта 1999 г. № 52-ФЗ).
Юридическая клиника ЮИ ИГУ
Под переводом на другую работу понимается:
1) перевод на другую работу у того же работодателя;
2) перевод на работу в другую местность вместе с работодателем;
3) перевод работника на работу к другому работодателю.
Если перевод на другую постоянную работу у того же работодателя осуществляется без письменного согласия работника, но он добровольно приступил к выполнению другой работы, такой перевод может считаться законным. Однако добровольное выполнение работником другой работы не освобождает работодателя от обязанности получить от работника письменное подтверждение такого согласия на перевод. В тех случаях, когда переведенный на другую постоянную работу у того же работодателя работник добровольно приступил к выполнению этой работы, но считает, что перевод осуществлен в нарушение действующего законодательства, он вправе обжаловать незаконный перевод в органы по рассмотрению трудовых споров. Переводы на другую работу оформляются приказами (распоряжениями) работодателя. Соответствующие записи вносятся в трудовую книжку.
Условия трудового договора, включая перевод на другую работу, могут быть изменены только по соглашению сторон трудового договора. Исключение составляют лишь случаи, предусмотренные Трудовым Кодексом (перевод работника без его согласия на временную работу для предотвращения катастрофы природного или техногенного характера, производственной аварии, несчастного случая на производстве, пожара, наводнения, голода, землетрясения, эпидемии или эпизоотии и в любых исключительных случаях, ставящих под угрозу жизнь или нормальные жизненные условия всего населения или его части).
Соглашение об изменении определенных сторонами условий трудового договора заключается в письменной форме.
Что считается переводом на другую постоянную работу у того же работодателя
Переводом на другую постоянную работу у того же работодателя является изменение трудовой функции работника и (или) структурного подразделения, в котором работает работник (если структурное подразделение было указано в трудовом договоре), при продолжении работы у того же работодателя.
Перевод на другую постоянную работу у того же работодателя возможен по различным обстоятельствам. При этом инициатива в переводе может исходить как от работодателя, так и от самого работника (например, в связи с повышением квалификации работника), а также от третьей стороны (по требованию медицинских органов).
Когда работодатель обязан предложить работнику перевод на другую работу:
1) при увольнении по сокращению штата;
2) из-за несоответствия работника занимаемой должности или выполняемой работе вследствие недостаточной квалификации, подтвержденной результатами аттестации.
Предлагаемая работа должна соответствовать квалификации работника, а если такой работы нет, то работнику следует предлагать вакантную нижестоящую должность или нижеоплачиваемую работу, которая им может выполняться с учетом его состояния здоровья. Работа, которая ему должна предлагаться, не ограничивается вакансиями места нахождения работодателя. Часть 3 ст. 81 ТК предусматривает, что работодатель обязан предлагать работнику все вакансии, имеющиеся у него в данной местности. Предлагать вакансии в других местностях работодатель обязан только в том случае, если это предусмотрено коллективным договором, соглашениями, трудовым договором.
Как отличить перевод работника на другую работу от перемещения на другое рабочее место у того же работодателя?
Перемещение, в отличие от перевода на другую работу, допускается без письменного согласия работника. Согласно ст. 72.1 ТК не требует письменного согласия работника на перемещение его у того же работодателя на другое рабочее место, в другое структурное подразделение, расположенное в той же местности, поручение ему работы на другом механизме или агрегате. Однако такое перемещение не является переводом на другую работу и поэтому не требует согласия работника только при условии, что оно не влечет за собой изменения определенных сторонами условий трудового договора.
При решении вопроса о том, чем является переход работника в другое структурное подразделение — переводом или перемещением, — необходимо установить, предусмотрено ли оно (структурное подразделение, в которое принят работник на работу) в трудовом договоре, заключенном между сторонами. Если в трудовом договоре место работы работника определено с указанием конкретного структурного подразделения, то необходимо исходить из того, что изменение структурного подразделения работодателя возможно лишь с письменного согласия работника, поскольку в указанном случае это влечет за собой изменение условия трудового договора. Под структурным подразделением работодателя следует понимать как филиалы, представительства, так и отделы, цеха, участки и т.д. (п. 16 постановления Пленума ВС РФ от 17.03.2004 N 2).
Трудовой кодекс запрещает перемещать работника на работу, противопоказанную ему по состоянию здоровья. Это правило действует и в отношении перевода на другую работу.
Какой срок установлен для временных переводов на другую работу, осуществляемых без согласия работника?
Работодатель имеет право переводить работника без его согласия на работу, не обусловленную трудовым договором, только временно — на срок до одного месяца.
В отличие от прежнего правила, допускающего перевод на другую работу для замещения отсутствующего работника на срок, не превышающий одного месяца в течение календарного года (с 1 января по 31 декабря), в настоящее время все временные переводы без согласия работника осуществляются на общих основаниях: имеет значение только определенный срок каждого перевода — один месяц. Это означает, что все такие переводы, в том числе и перевод для замещения отсутствующего работника, могут носить неоднократный характер с тем, чтобы в каждом отдельном случае продолжительность перевода не превышала одного месяца.
Перевод на временную работу без согласия работника производится с учетом специальности и квалификации работника, если основанием перевода является простой, необходимость предотвращения уничтожения или порчи имущества либо замещения отсутствующего работника. Если при этих переводах возникает необходимость выполнения работы, требующей более низкой квалификации, то такая работа допускается только с письменного согласия работника.
Это правило не распространяется на переводы при чрезвычайных обстоятельствах. При переводах, осуществляемых без согласия работника, оплата его труда производится по выполняемой работе, но не ниже среднего заработка по прежней работе.
Каковы условия перевода работника на постоянную работу в другую местность вместе с работодателем либо к другому работодателю?
Перевод работника на постоянную работу в другую местность вместе с работодателем либо к другому работодателю допускается только с письменного согласия работника.
Под другой местностью следует понимать местность за пределами административно-территориальных границ соответствующего населенного пункта (п. 16 постановления Пленума ВС РФ от 17.03.2004 N 2). Перевод на работу из одного населенного пункта в другой даже в пределах одного административного района рассматривается как перевод в другую местность независимо от наличия автобусного или иного регулярного сообщения между этими пунктами. Отказ работника от перевода в другую местность вместе с работодателем является основанием для прекращения с ним трудового договора по п. 9 ст. 77 ТК. На практике имеют место случаи, когда это основание применяется и при отказе работника от перевода вместе с филиалом в другую местность. Суды, если к ним обращаются такие работники с иском о восстановлении на работе, не признают правомерным их увольнение, поскольку работодатель, структурным подразделением которого является филиал, не переезжает в другую местность.
При переводе на работу в другую местность работникам выплачиваются соответствующие компенсации: стоимость проезда самого работника и членов его семьи, стоимость провоза багажа, расходы по устройству на новом месте и др.
По письменной просьбе работника или с его письменного согласия может быть осуществлен перевод работника на постоянную работу к другому работодателю.
Перевод на постоянную работу к другому работодателю влечет за собой изменение одной стороны трудового договора, поэтому он рассматривается ТК как самостоятельное основание прекращения ранее заключенного трудового договора (п. 5 ст. 77 ТК) и в то же время как основание для заключения нового. Работнику, в письменной форме приглашенному на работу в порядке перевода от другого работодателя, не может быть отказано в заключении трудового договора в течение месяца со дня увольнения с прежнего места работы (ч. 4 ст. 64 ТК).
В трудовой книжке работника в этом случае производятся записи об увольнении и о приеме на работу с указанием порядка, в котором осуществлено увольнение в связи с переводом — по просьбе работника или с его согласия (см. п. 6.1 Инструкции по заполнению трудовых книжек, утвержденной постановлением Минтруда России).
Независимо от порядка перевода запрещается переводить работника на работу, противопоказанную ему по состоянию здоровья.
Имеются какие-либо отличия в переводе на временную работу от перевода на постоянную работу?
Да, имеются.
Первое отличие касается срока перевода. Если работника переводят на временную работу, она должна быть ограничена определенным сроком. Кроме того, ТК выделяет среди временных переводов на другую работу переводы, не требующие согласия работника.
Согласно ст. 72.2 допускается по соглашению сторон, заключаемому в письменной форме, временный перевод на другую работу у того же работодателя на срок до одного года, а в случае, когда такой перевод осуществляется для замещения временно отсутствующего работника, за которым в соответствии с законом сохраняется место работы, — до выхода этого работника на работу. Последствия окончания срока перевода следующие. Если по окончании срока перевода работнику не предоставлена прежняя работа, а он не настаивает на ее предоставлении и продолжает работать, условие соглашения о временном характере перевода утрачивает силу и перевод считается постоянным.
Без согласия работника допускается перевод на срок до одного месяца на не обусловленную трудовым договором работу у того же работодателя для предотвращения или устранения последствий катастрофы природного или техногенного характера, производственной аварии, несчастного случая на производстве, пожара, наводнения, голода, землетрясения, эпидемии или эпизоотии и любых исключительных случаях, ставящих под угрозу жизнь или нормальные жизненные условия всего населения или его части. Основанием перевода работника без его согласия на срок до одного месяца на не обусловленную трудовым договором работу у того же работодателя является также простой (временная приостановка работы по причинам экономического, технологического, технического или организационного характера), необходимость предотвращения уничтожения или порчи имущества либо замещение временно отсутствующего работника, если простой или необходимость предотвращения уничтожения или порчи имущества либо замещения временно отсутствующего работника вызваны чрезвычайными обстоятельствами.
Наличие чрезвычайных обстоятельств необходимо во всех случаях перевода на другую временную работу без согласия работника. На это обстоятельство в свое время обратил внимание Пленум ВС РФ, который указал, что временный перевод работника без его согласия на не обусловленную трудовым договором работу для предотвращения простоя, уничтожения или порчи имущества, а также для замещения отсутствующего работника может быть признан обоснованным при условии, что это было вызвано чрезвычайными обстоятельствами или когда непринятие указанных мер могло привести к катастрофе, производственной аварии, стихийному бедствию, несчастному случаю и т.п. последствиям (п. 18 постановления Пленума ВС РФ от 17.03.2004 N 2).
Данная позиция Пленума ВС РФ, которая в настоящее время подтверждена в ТК, основана на положениях Конвенции МОТ N 29 «О принудительном или обязательном труде» (1930 г.), в соответствии с которой Российская Федерация обязалась упразднить применение принудительного или обязательного труда во всех его формах, т.е. всякую работу или службу, требуемую от какого-либо лица под угрозой какого-либо наказания и для которой это лицо не предложило добровольно своих услуг (п. 1 ст. 2 Конвенции). При этом в силу подп. «д» п. 2 ст. 2 названной Конвенции не является принудительным трудом всякая работа или служба, требуемая в условиях чрезвычайных обстоятельств, т.е. в случаях объявления чрезвычайного или военного положения, бедствия или угрозы бедствия, как то: пожары, наводнения, голод, землетрясения, сильные эпидемии или эпизоотии, нашествия вредных животных, насекомых или паразитов растений, а также в иных случаях, ставящих под угрозу или могущих поставить под угрозу жизнь или нормальные жизненные условия всего или части населения.
Возможен ли отказ работника от временного перевода на другую работу?
Ответ на этот вопрос зависит от характера перевода на другую работу. В тех случаях, когда временный перевод на другую работу не носит обязательного характера, работник вправе отказаться от такого перевода. Иной характер носят временные переводы на другую работу в связи с чрезвычайными обстоятельствами. Эти переводы обязательны для работника, и поэтому отказ от такого перевода признается нарушением трудовой дисциплины, а невыход на работу — прогулом. Вместе с тем в постановлении Пленума ВС РФ от 17.03.2004 N 2 (в ред. от 28.12.2006) отмечено, что суды должны учитывать положения ТК, запрещающие подвергать работника дисциплинарному взысканию за отказ от выполнения работы в случае возникновения опасности для жизни и здоровья вследствие нарушения требований охраны труда, за исключением случаев, предусмотренных федеральными законами, до устранения такой опасности, либо от выполнения тяжелых работ и работ с вредными и (или) опасными условиями труда, не предусмотренных трудовым договором. Поскольку ТК не содержит норм, запрещающих работнику воспользоваться названным правом и тогда, когда выполнение таких работ вызвано переводом вследствие производственной необходимости, отказ работника от такого перевода по указанным выше причинам является обоснованным (п. 19 указанного Постановления).
В каком порядке осуществляется перевод работника на другую работу в соответствии с медицинским заключением?
Трудовой кодекс устанавливает общее правило, применяемое при переводе на другую работу в соответствии с медицинским заключением. Это правило обязывает работодателя переводить работника, нуждающегося в переводе на другую работу в соответствии с медицинским заключением, выданным в порядке, установленном федеральными законами и иными нормативными правовыми актами РФ, с его письменного согласия на другую имеющуюся работу, не противопоказанную работнику по состоянию здоровья.
Если работник, нуждающийся в соответствии с медицинским заключением в переводе на другую работу, отказывается от перевода либо соответствующая работа у работодателя отсутствует, то возникают последствия, зависящие от того, на какой срок работник должен быть переведен на другую работу. В одних случаях работник отстраняется от работы, в других — трудовой договор прекращается.
Работник отстраняется от работы с сохранением места работы (должности), если работник, нуждающийся в соответствии с медицинским заключением во временном переводе на другую работу на срок до четырех месяцев, отказывается от перевода, либо соответствующая работа у работодателя отсутствует. Срок отстранения от работы определяется сроком, указанным в медицинском заключении. В период отстранения от работы заработная плата работнику не начисляется, за исключением случаев, предусмотренных ТК, иными федеральными законами, коллективным договором, соглашениями, трудовым договором.
Трудовой договор прекращается, если в соответствии с медицинским заключением работник нуждается во временном переводе на другую работу на срок более четырех месяцев или в постоянном переводе, но от перевода отказывается либо у работодателя отсутствует соответствующая работа. Основанием прекращения трудового договора является п. 8 ч. 1 ст. 77 ТК (отказ работника от перевода на другую работу, необходимого ему в соответствии с медицинским заключением, выданным в порядке, установленном федеральными законами и иными нормативными правовыми актами РФ, либо отсутствие у работодателя соответствующей работы). Статья 73 ТК среди работников, нуждающихся в переводе на другую работу в соответствии с медицинским заключением, выделяет руководителей организаций (филиалов, представительств и иных обособленных структурных подразделений), их заместителей и главных бухгалтеров. С этими лицами, если они нуждаются в соответствии с медицинским заключением во временном или в постоянном переводе на другую работу, но отказываются от перевода либо у работодателя отсутствует соответствующая работа, трудовой договор прекращается в соответствии с п. 8 ч. 1 ст. 77 ТК. Однако с их письменного согласия работодатель имеет право не прекращать с ними трудовой договор, а отстранить указанных работников от работы. Срок отстранения определяется соглашением сторон и срок устанавливается с учетом наличия в будущем вакантной должности, на которую соответствующий работник соглашается перейти.
ст. 72.1 Трудового Кодекса РФ в текущей редакции и комментарии к ней
Перевод на другую работу — постоянное или временное изменение трудовой функции работника и (или) структурного подразделения, в котором работает работник (если структурное подразделение было указано в трудовом договоре), при продолжении работы у того же работодателя, а также перевод на работу в другую местность вместе с работодателем. Перевод на другую работу допускается только с письменного согласия работника, за исключением случаев, предусмотренных частями второй и третьей статьи 72.2 настоящего Кодекса.
По письменной просьбе работника или с его письменного согласия может быть осуществлен перевод работника на постоянную работу к другому работодателю. При этом трудовой договор по прежнему месту работы прекращается (пункт 5 части первой статьи 77 настоящего Кодекса).
Не требует согласия работника перемещение его у того же работодателя на другое рабочее место, в другое структурное подразделение, расположенное в той же местности, поручение ему работы на другом механизме или агрегате, если это не влечет за собой изменения определенных сторонами условий трудового договора.
Запрещается переводить и перемещать работника на работу, противопоказанную ему по состоянию здоровья.
Комментарий к статье 72.1 ТК РФ
1. В ст. 72.1 даны понятия «перевод на другую работу» и «перемещение». Переводом на другую работу в соответствии с комментируемой статьей является постоянное или временное изменение трудовой функции работника и (или) структурного подразделения, в котором работает работник (если структурное подразделение было указано в трудовом договоре), при продолжении работы у того же работодателя, а также перевод на работу в другую местность вместе с работодателем. Как следует из содержания приведенной нормы, изменение других условий, определенных трудовым договором (например, режима работы, оплаты труда), не является переводом на другую работу.
Перевод на другую работу, так же как и изменение других определенных сторонами условий трудового договора, возможен только с письменного согласия работника. Исключение из этого правила допускается лишь в случаях, указанных в ч. ч. 2 и 3 ст. 72.2 (см. коммент. к ней).
Если перевод на другую постоянную или временную работу у того же работодателя осуществлен без письменного согласия работника, но работник не возражал против такого перевода и приступил к выполнению другой работы, такой перевод может считаться законным. Однако выполнение работником другой работы не освобождает работодателя от обязанности получить от работника письменное подтверждение такого согласия на перевод.
В тех случаях, когда переведенный на другую работу у того же работодателя работник приступил к выполнению этой работы, но считает, что перевод осуществлен в нарушение законодательства, он может обжаловать незаконный перевод в органы по рассмотрению трудовых споров.
2. Перевод на другую постоянную работу или временный перевод на другую работу у того же работодателя, а также перевод на постоянную работу в другую местность вместе с работодателем оформляются приказом (распоряжением) работодателя по установленной форме.
При переводе на работу в другую местность работникам выплачиваются соответствующие компенсации: стоимость проезда самого работника и членов его семьи, стоимость провоза багажа, расходы по обустройству на новом месте и др. Конкретные размеры возмещения расходов определяются соглашением сторон трудового договора (см. коммент. к ст. 169).
Под другой местностью следует понимать местность за пределами административно-территориальных границ соответствующего населенного пункта (п. 16 Постановления Пленума ВС РФ от 17.03.2004 N 2).
Перевод на работу из одного населенного пункта в другой даже в пределах одного административного района рассматривается как перевод в другую местность независимо от наличия автобусного или иного регулярного сообщения между этими пунктами.
Отказ работника от перевода в другую местность вместе с работодателем является основанием для прекращения с ним трудового договора по п. 9 ст. 77 ТК. Отказ от перевода в филиал или представительство организации, расположенные в другой местности, не может являться основанием для расторжения трудового договора с работником, если сам работодатель в эту другую местность не перемещается (см. коммент. к ст. 77).
При увольнении работников в связи с отказом от перевода в другую местность вместе с работодателем им выплачивается выходное пособие в размере двухнедельного среднего заработка (ч. 3 ст. 178 ТК).
3. Перевод на работу к другому работодателю может быть осуществлен по просьбе работника, изложенной в письменной форме, или с его письменного согласия, если инициатива в переводе исходит от работодателя.
Перевод на постоянную работу к другому работодателю влечет изменение одной стороны трудового договора, поэтому он рассматривается законодателем как самостоятельное основание прекращения трудового договора (п. 5 ст. 77 ТК). Работнику, письменно приглашенному на работу в порядке перевода от другого работодателя, не может быть отказано в заключении трудового договора в течение одного месяца со дня увольнения с прежнего места работы (см. коммент. к ст. 64). В трудовой книжке работника в этом случае производятся записи об увольнении и о приеме на работу с указанием порядка, в котором осуществлено увольнение в связи с переводом — по просьбе работника или с его согласия (п. 6.1 Инструкции по заполнению трудовых книжек).
4. Перевод на другую постоянную работу или временный перевод на другую работу у того же работодателя возможен по различным обстоятельствам. При этом инициатива в переводе может исходить как от работодателя, так и от самого работника (например, в связи с тем, что он повысил квалификацию).
В ряде случаев у работодателя возникает обязанность перевести работника с его согласия на другую работу, например в случае, когда работник нуждается в соответствии с медицинским заключением в предоставлении другой работы (см. коммент. к ст. 73).
В тех случаях, когда работа, на которую переведен работник в соответствии с медицинским заключением, является нижеоплачиваемой, за работником сохраняется его прежний средний заработок в течение месяца со дня перевода, а при переводе в связи с трудовым увечьем, профессиональным заболеванием или иным повреждением здоровья, связанным с работой, — до установления стойкой утраты трудоспособности либо до выздоровления работника (см. коммент. к ст. 182).
В отдельных случаях, предусмотренных законодательством, работодатель обязан предложить работнику перевод на другую работу. Такая обязанность может возникнуть, например, при сокращении численности или штата, если у работодателя для работника, подлежащего сокращению, имеется другая работа (см. коммент. к ч. 3 ст. 81). Работодатель обязан предложить другую имеющуюся у него работу лицу, признанному по результатам аттестации не соответствующим занимаемой должности (см. коммент. к ст. 81).
5. От перевода работника на другую работу следует отличать его перемещение у того же работодателя на другое рабочее место, в другое структурное подразделение, расположенное в той же местности, поручение работы на другом механизме или агрегате. Такое перемещение согласно ч. 3 комментируемой статьи не требует согласия работника, если это не влечет изменения определенных сторонами условий трудового договора (см. коммент. к ст. 57).
Иными словами, изменение рабочего места или структурного подразделения можно признать перемещением только в том случае, если при заключении трудового договора это конкретное рабочее место (механизм, агрегат) или структурное подразделение не оговаривалось и в трудовом договоре не предусмотрено. Если же конкретное рабочее место (механизм, агрегат) или структурное подразделение указано в трудовом договоре, то оно является его обязательным условием и, следовательно, может быть изменено только с письменного согласия работника.
Под структурными подразделениями следует понимать как филиалы, представительства, так и отделы, цеха, участки и т.д. (п. 16 Постановления Пленума ВС РФ от 17.03.2004 N 2).
Другой комментарий к статье 72.1 ТК РФ
§ 1. Одной из форм изменения трудового договора является перевод на другую работу.
ТК РФ в отличие от КЗоТа РФ закрепил легально в ст. 72.1 понятие перевода, выработанное наукой, и его отличие от перемещения, не требующего согласия работника.
В прежней редакции Трудового кодекса перевод на другую работу определялся как изменение трудовой функции или изменение существенных условий трудового договора.
Комментируемая статья (ч. 1) под переводом на другую работу понимает постоянное или временное изменение трудовой функции и (или) структурного подразделения, в котором работник работает, если в трудовом договоре было указано структурное подразделение, где он должен работать, при продолжении работы у того же работодателя, а также перевод работника на работу в другую местность вместе с работодателем.
Следует помнить, что без учета перечисленных категорий невозможно отграничить одну работу от другой и, соответственно, решать вопрос о наличии перевода на другую работу или отсутствии его.
§ 2. Трудовая функция включает в себя должность в соответствии со штатным расписанием, профессию, специальность с указанием квалификации, вид поручаемой работнику работы.
Профессия — это постоянный вид трудовой деятельности работника, требующий специальных навыков и соответствующих знаний, приобретаемых в процессе производственно-технического обучения.
Специальность — это разновидность профессии, которая устанавливается в результате разделения труда (например, врач-окулист, инженер-механик и т.д.).
Квалификация — это степень и вид профессиональной обученности, т.е. уровень подготовки, опыта, знаний по данной специальности, определенный для рабочих разрядами работ, которые они выполняют.
Должность предопределяет границы компетенции работника, его права, обязанности и степень ответственности.
Следовательно, перевод на другую работу — это другая работа по сравнению с оговоренной в трудовом договоре, если структурное подразделение не было указано в тексте договора.
§ 3. Законодатель не определяет понятия другой местности. Таковое дается в п. 16 Постановления Пленума Верховного Суда РФ от 17 марта 2004 г. N 2 «О применении судами Российской Федерации Трудового кодекса Российской Федерации» (БВС РФ. 2004. N 6). Под другой местностью следует понимать местность за пределами административно-территориальных границ соответствующего населенного пункта. И далее оно разъясняет, что если в трудовом договоре работника было указано конкретное структурное подразделение как место его работы, то изменение этого структурного подразделения возможно лишь с письменного согласия работника, т.е. это будет перевод, а не перемещение, как если бы трудовой договор не оговаривал конкретное подразделение. Под структурным подразделением организации следует понимать как филиалы, представительства, так и отделы, цеха, участки и т.п.
Повышение и понижение в должности также является переводом, требующим согласия работника.
§ 4. Перевод на другую работу по действующему трудовому законодательству допускается только с письменного согласия работника. Это общее правило, из которого, однако, законодатель устанавливает исключения для случаев, предусмотренных ч. 2 и 3 ст. 72.2 ТК (см. комментарий к ней).
Если письменного согласия работника на перевод получено не было, но он добровольно приступил к выполнению другой работы, такой перевод может считаться законным.
§ 5. На основании ч. 2 ст. 72.1 ТК по письменной просьбе работника или с его письменного согласия может быть осуществлен перевод на другую постоянную работу к другому работодателю.
В этом случае трудовой договор по прежнему месту работы прекращается по п. 5 ст. 77 ТК (см. комментарий к ней).
§ 6. Законодатель дает понятие перемещения, которое следует отличать от перевода на другую работу. Так, ч. 3 ст. 72.1 ТК предусматривает, что не требуется согласия работника на его перемещение у того же работодателя на другое рабочее место, в другое структурное подразделение, но расположенное в той же местности, поручение ему работы на другом механизме или агрегате, если это не влечет за собой изменения определенных сторонами условий трудового договора.
§ 7. Рассматриваемая статья запрещает переводить и перемещать работника на работу, противопоказанную ему по состоянию здоровья. Во избежание таких случаев работник должен иметь соответствующие документы, что является для него одной из юридических гарантий.
Перевод в связи с производственной необходимостью
* Трудовые отношения
* Прием на работу
Перевод
— Перевод часть 2
Перевод часть 3
* Увольнение
* Совместительство и совмещение
Перевод в связи с производственной необходимостью
По общему правилу работодатель не должен требовать от подчиненного выполнения работы, не обусловленной трудовым договором (ст. 60 ТК РФ). Однако для некоторых случаев предусмотрено исключение. Все эти случаи связаны с временным переводом на другую работу в связи с производственной необходимостью.Этому особому виду перевода посвящена статья 72 ТК РФ. Администрация имеет право временно перевести своего сотрудника на другую работу, даже если это не предусмотрено в договоре. Основное условие для такого перевода — производственная необходимость.
Такой перевод допускается для предотвращения катастрофы, производственной аварии или устранения последствий катастрофы, аварии или стихийного бедствия; для предотвращения несчастных случаев, простоя (временной приостановки работы по причинам экономического, технологического, технического или организационного характера, а также в случаях приостановления деятельности в порядке, предусмотренном законом), уничтожения или порчи имущества, а также для замещения отсутствующего работника. При этом работник не может быть переведен на работу, противопоказанную ему по состоянию здоровья.
Перевод в случае простоя (временной приостановки работы по причинам экономического, технологического, технического или организационного характера), уничтожения или порчи имущества, а также для замещения временно отсутствующего работника может быть признан обоснованным лишь при условии, что это было вызвано чрезвычайными обстоятельствами. Либо когда неприятие указанных мер могло привести к катастрофе, производственной аварии, стихийному бедствию, несчастному случаю и тому подобным последствиям.
Трудовой кодекс ограничивает право работодателя временно перевести работника без его согласия рядом условий.
1. Работник не может быть переведен на работу, противопоказанную ему по состоянию здоровья.
Например, программист временно переводится на склад, где нужно таскать коробки с товаром из затопленного водой помещения. До перевода обязательно следует поинтересоваться, нет ли у него медицинской справки, запрещающей привлекать его к работам, связанным с переносом тяжестей.
2. Перевести сотрудника на другую работу в таких случаях можно не более чем на один месяц, поэтому подобные переводы и называются временными.
При этом в течение года руководство может сколько угодно раз временно переводить работника с должности на должность. Исключение составляют лишь переводы для замещения отсутствующего коллеги. Данный вид перевода возможен только один раз в календарном году.
3. Перевод работника на другую работу в связи с производственной необходимостью возможен лишь в пределах той же организации, с которой работник состоит в трудовых отношениях. Стоит учесть, что филиал не является самостоятельным юридическим лицом, его можно отнести к структурному подразделению компании.
Поэтому можно беспрепятственно переводить работников из головного офиса в филиал или перемещать персонал между филиалами. А между организациями холдинга перевод невозможен — ведь они являются самостоятельными юридическими лицами, даже если и находятся под одной крышей.
4. Если работа, на которую работник временно переведен, оплачивается выше, чем его постоянная работа, выплачивать зарплату придется исходя из условий по новому месту работы. Если временная работа оплачивается ниже, то заработная плата не должна быть ниже среднего заработка работника по прежнему месту работы.
5. Поскольку по общему правилу перевод по производственной необходимости не зависит от согласия сотрудника, кадровику достаточно уведомить его о принятом решении и подготовить проект приказа о переводе. Из этого правила есть одно исключение — для перевода сотрудника на работу, требующую более низкой квалификации, нужно заручиться его письменным согласием.
Что делать, если сотрудник отказывается подчиняться распоряжению администрации о переходе на другую работу по производственной необходимости?
Прежде всего сотруднику нужно сообщить, что в силу статьи 72 ТК РФ работодатель в подобном случае имеет безусловное право переводить его без его согласия на работу, не обусловленную трудовым договором. Подчиненный в свою очередь не может отказаться от такого перевода, если он осуществляется на законных основаниях, и у работника нет уважительных причин для отказа. Если же работник не приступил в установленный срок к новой работе, то можно готовить докладную записку на имя руководителя организации и проект приказа о привлечении сотрудника к дисциплинарной ответственности.В силу статьи 219 и части 7 статьи 220 ТК РФ работника нельзя подвергнуть дисциплинарному взысканию за отказ от выполнения работы, если, выполняя эту работу, работник рисковал бы своей жизнью и здоровьем.
Перемещение работника в той же организации на другое рабочее место, в другое структурное подразделение, поручение работы на другом механизме, если при этом не изменяются определенные сторонами условия трудового договора, не считается переводом и не требует внесения изменений в трудовую книжку.
Всякий раз, оценивая решение руководства об изменении места работы сотрудника, кадровой службе нужно внимательно следить, не вступает ли оно в противоречие с нормами действующего трудового законодательства. И только полностью убедившись в правомерности решения руководства, готовить приказ по личному составу.
Наиболее часто возникающие вопросы при переводе
Вариант 1. Работник принят на работу в организацию по совместительству. Проработал некоторое время и заявил руководителю о своем желании перейти в эту организацию по основному месту работы. Как это оформить?Существует точка зрения, что такой «переход» можно оформить переводом: издается приказ о переводе по основному месту работы — и все. Но часто этого недостаточно, потому что у работника может не быть в трудовой книжке записи о работе в данной организации. Запись о работе по совместительству производится по основному месту работы, и порядок ее внесения несколько отличен от порядка внесения записей об основном месте работы. В приведенной ситуации порядок оформления следующий. Работник увольняется по основному месту работы и по совместительству (кадровый работник должен предупредить его, чтобы он внимательно следил за сроками увольнения, — желательно, чтобы они совпадали). А затем заново принимается в организацию, где он ранее работал по совместительству, но уже по основному месту работы. Заключается новый трудовой договор, издается приказ, оформляется личная карточка формы № Т-2 и полный пакет документов по личному составу, вносится запись в трудовую книжку.
В случае если работник достиг договоренности с руководителем организации, что он переходит по основному месту работы, но при этом продолжает работать по совместительству в этой же организации (так называемое внутреннее совместительство), то он увольняется только по основному месту работы. При этом его прием по основному месту работы в организации, где он теперь будет являться внутренним совместителем, следует правильно и полно оформить.
Вариант 2. Как оформить перевод из одной организации в другую в рамках холдинга?
К сожалению, не слишком опытные кадровики умудряются оформлять такое движение персонала из одной организации в другую приказом о переводе: «А что, руководство то же самое. И работники зачастую не только не меняют свою трудовую функцию, но даже остаются в том же помещении, за тем же самым рабочим столом».
Эта ошибка создаст в будущем проблемы работнику при оформлении пенсии. В его трудовой книжке сверху при приеме на работу указано название одной организации, а при увольнении на печати — совершенно другое.
В этом случае работники также сначала увольняются, а затем оформляются на работу в другую организацию. Причем такое увольнение — прием не должно иметь значительных временных разрывов. Известен случай, когда кадровый специалист организации уволил работника в пятницу и принял в понедельник следующей недели. Работник устроил затяжной конфликт на тему: «По вашей вине потерял два дня стажа».
Стоит запомнить простое правило: перевод осуществляется только внутри организации (одного юридического лица). Если работник переходит из одной организации в другую (два разных юридических лица) — это увольнение.
Специалисты по кадрам предприятий часто спрашивают: по какой статье лучше увольнять в таких случаях?
При переходе из одной организации в другую внутри холдинга возможны варианты. Так, запись в трудовой книжке об увольнении в соответствии с пунктом 5 статьи 77 ТК РФ «перевод работника по его просьбе или с его согласия на работу к другому работодателю» очень удобна для работника. При таком переходе кадры обязаны подготовить письмо с просьбой об увольнении переводом и полностью с учетом неиспользованного отпуска рассчитать работника.
Увольнение по собственному желанию (пункт 3 статья 77 ТК РФ) не слишком удобно для работника. Поскольку при приеме на работу может быть установлен испытательный срок, чем и пользуются некоторые работодатели для того, чтобы избавиться от «неудобных» работников. Работники об этом догадываются и не всегда соглашаются писать заявление. Но даже если заявление написано, у работника остается незначительная, но все-таки возможность доказать в суде немотивированность увольнения, то есть факт того, что заявление «по собственному желанию» написано под давлением руководства организации.
Многие юристы считают наиболее удобным вариантом увольнение по соглашению сторон (пункт 1 статья 77 ТК РФ). Такое основание позволяет устанавливать испытательный срок при приеме работника.
Вариант 3. Как назначить исполняющего обязанности?
Возможны два варианта.
1. Если вы хотите назначить исполняющего обязанности взамен какого-либо работника, который не может выполнять свои обязанности, то это временный перевод.
2. Назначение исполняющего обязанности по вакантной должности не допускается — трудовое законодательство Российской Федерации не знает такого вида перевода. Если все-таки работник назначается исполняющим обязанности на вакантную должность, то это будет считаться переводом работника на другую работу, причем постоянным.
Пример 1. Сотрудник трудился в организации по основному месту работы. Затем приказом его перевели на другую должность, но уже по совместительству, а в трудовой книжке сделали запись о переводе. Одновременно этому работнику предложили должность на другом предприятии, пригласив его на основное место работы. Поскольку в первой организации он не уволен, кадровик на новой работе отказывается вносить ему в трудовую книжку запись о приеме. Верно ли сделаны записи в трудовой книжке? Как исправить положение?
Записи в трудовой книжке сделаны неверно. Ошибка в том, что переход с основной работы на работу по совместительству нельзя оформлять переводом. Это два совершенно разных трудовых договора. Сначала нужно расторгнуть договор по основной работе, а затем заключить с работником новый трудовой договор о работе по совместительству. Записи в трудовой книжке лучше сделать в такой последовательности: запись о расторжении трудового договора по основной работе, затем о приеме на работу в другую организацию, а уже после этого, по желанию сотрудника, можно внести запись о приеме на работу по совместительству в первую организацию.
Исправить это можно путем признания записи о переводе недействительной и внесения правильной записи.
Пример 2. При переводе работника на новую должность с повышением, имеют ли право установить ему испытание с указанием об этом в трудовом договоре? Если он не будет должным образом справляться с новыми обязанностями и не пройдет этот испытательный срок, что может предпринять работодатель?
Испытание работника в целях проверки его соответствия поручаемой работе согласно части 1 статьи 70 ТК РФ устанавливается соглашением сторон исключительно при заключении трудового договора. В описанной ситуации имеет место перевод, который определен в статье 72 ТК РФ как изменение трудовой функции или изменение существенных условий трудового договора, что, по сути, является изменением существующего трудового договора с работником.
Трудовой кодекс Российской Федерации не предусматривает возможности установления работодателем испытательного срока при переводе на другую работу в той же организации. Если для переведенного работника работодатель все же установил испытание, то это классифицируется как снижение уровня прав и гарантий, установленного трудовым законодательством. В конечном итоге это повлечет за собой неприменение такого условия трудового договора, как установление испытательного срока (часть 2 статья 9 ТК РФ).
Предположим, что, находясь на испытательном сроке после перевода, работник не будет должным образом справляться с выполнением своих обязанностей. Ситуация будет выглядеть следующим образом. Работодатель, руководствуясь правилами статьи 71 ТК РФ о последствиях неудовлетворительного результата испытания, расторгнет с работником трудовой договор с указанием причин, послуживших основанием для признания его не выдержавшим испытание.
Последующее обжалование работником такого увольнения с большой степенью вероятности приведет к признанию произведенного увольнения незаконным и восстановлению его в той «более высокой должности», на которую он был переведен (ст. 394 ТК РФ, п. 60 постановления Пленума Верховного Суда РФ от 17 марта 2004 г. № 2).
Все вышесказанное не относится к государственным служащим. Действие трудового законодательства на госслужащих распространяется с особенностями, предусмотренными Федеральным законом от 27 июля 2004 г. № 79-ФЗ «О государственной гражданской службе Российской Федерации».
Таким образом, установление переведенному работнику, не являющемуся госслужащим, испытательного срока противоречит нормам трудового законодательства и может привести к восстановлению работника и /или повлечь для работодателя неблагоприятные последствия со стороны контрольно-надзорных органов.
Случаи, в которых работодатель обязан предложить работникуперевод на другую постоянную работу
| Ситуация | Основание (статья ТК РФ) | Последствия невозможности осуществить перевод на другую постоянную работу |
| У работника есть медицинское заключение о необходимости постоянного перевода на другую работу | Части 1 и 4 ст. 73 | В случае отказа работника от перевода на другую постоянную работу или при отсутствии у работодателя соответствующей работы, трудовой договор прекращается по основанию, предусмотренному п. 8 ч. 1 ст. 77 ТК РФ |
| Работник отказывается от продолжения работы в новых условиях при изменении работодателем определенных сторонами условий трудового договора по причинам, связанным с изменением организационных или технологических условий труда | Часть 3 ст. 74 ТК РФ | В случае отказа работника от предложенной работы или в случае отсутствия работы, на которую можно предложить перевод, трудовой договор прекращается по основанию, предусмотренному п. 7 ч. 1 ст. 77 ТК РФ |
| Работник отказывается от продолжения работы на условиях неполного рабочего времени, введенного работодателем в целях сохранения рабочих мест в случае, когда причины, связанные с изменением организационных или технологических условий труда, могут повлечь за собой массовое увольнение работников | Часть 6 ст. 74 ТК РФ | В случае, если перевод осуществить невозможно, трудовой договор прекращается по основанию, предусмотренному п. 2 ч. 1 ст. 81 ТК РФ |
| Сокращение численности или штата работников организации (индивидуального предпринимателя) | Часть 3 ст. 81 ТК РФ | В случае, если перевод осуществить невозможно, трудовой договор прекращается по основанию, предусмотренному п. 2 ч. 1 ст. 81 ТК РФ |
| Несоответствие работника занимаемой должности или выполняемой работе вследствие недостаточной квалификации подтверждено результатами аттестации | Часть 4 ст. 81 ТК РФ | В случае, если перевод осуществить невозможно, трудовой договор прекращается по основанию, предусмотренному п. 3 ч. 1 ст. 81 ТК РФ |
| Восстановление на работе работника, ранее выполнявшего эту работу, по решению суда или ГИТ | Часть 2 ст. 83 ТК РФ | В случае, если перевод осуществить невозможно, трудовой договор прекращается по основанию, предусмотренному п. 2 ч. 1 ст. 83 ТК РФ |
| К работнику применено административное наказание, исключающее возможность выполнения работником обязанностей по трудовому договору | Часть 2 ст. 83 ТК РФ | В случае, если перевод осуществить невозможно, трудовой договор прекращается по основанию, предусмотренному п. 8 ч. 1 ст. 83 ТК РФ |
| Истечение срока действия или лишение работника специального права (лицензии, права на управление транспортным средством, права на ношение оружия, другого специального права) в соответствии с федеральными законами и иными нормативными правовыми актами РФ, если это влечет за собой невозможность исполнения работником обязанностей по трудовому договору | Часть 2 ст. 83 ТК РФ | В случае, если перевод осуществить невозможно, трудовой договор прекращается по основанию, предусмотренному п. 9 ч. 1 ст. 83 ТК РФ |
| Прекращение допуска работника к государственной тайне, если выполняемая работа требует такого допуска | Часть 2 ст. 83 ТК РФ | В случае, если перевод осуществить невозможно, трудовой договор прекращается по основанию, предусмотренному п. 10 ч. 1 ст. 83 ТК РФ |
Статья 72.2 ТК РФ 2016-2019. Временный перевод на другую работу. ЮрИнспекция
Ст. 72.1 ТК РФ: Не требует согласия работника перемещение его у того же работодателя на другое рабочее место, в другое структурное подразделение, расположенное в той же местности, поручение ему работы на другом механизме или агрегате, если это не влечет за собой изменения определенных сторонами условий трудового договора. Статья 72.2. Временный перевод на другую работу В случае катастрофы природного или техногенного характера, производственной аварии, несчастного случая на производстве, пожара, наводнения, голода, землетрясения, эпидемии или эпизоотии и в любых исключительных случаях, ставящих под угрозу жизнь или нормальные жизненные условия всего населения или его части, работник может быть переведен без его согласия на срок до одного месяца на не обусловленную трудовым договором работу у того же работодателя для предотвращения указанных случаев или устранения их последствий. Перевод работника без его согласия на срок до одного месяца на не обусловленную трудовым договором работу у того же работодателя допускается также в случаях простоя (временной приостановки работы по причинам экономического, технологического, технического или организационного характера) , необходимости предотвращения уничтожения или порчи имущества либо замещения временно отсутствующего работника, если простой или необходимость предотвращения уничтожения или порчи имущества либо замещения временно отсутствующего работника вызваны чрезвычайными обстоятельствами, указанными в части второй настоящей статьи. При этом перевод на работу, требующую более низкой квалификации, допускается только с письменного согласия работника. При переводах, осуществляемых в случаях, предусмотренных частями второй и третьей настоящей статьи, оплата труда работника производится по выполняемой работе, но не ниже среднего заработка по прежней работе. Статья 74. Изменение определенных сторонами условий трудового договора по причинам, связанным с изменением организационных или технологических условий труда В случае, когда по причинам, связанным с изменением организационных или технологических условий труда (изменения в технике и технологии производства, структурная реорганизация производства, другие причины) , определенные сторонами условия трудового договора не могут быть сохранены, допускается их изменение по инициативе работодателя, за исключением изменения трудовой функции работника. О предстоящих изменениях определенных сторонами условий трудового договора, а также о причинах, вызвавших необходимость таких изменений, работодатель обязан уведомить работника в письменной форме не позднее чем за два месяца, если иное не предусмотрено настоящим Кодексом. Если работник не согласен работать в новых условиях, то работодатель обязан в письменной форме предложить ему другую имеющуюся у работодателя работу (как вакантную должность или работу, соответствующую квалификации работника, так и вакантную нижестоящую должность или нижеоплачиваемую работу) , которую работник может выполнять с учетом его состояния здоровья. При этом работодатель обязан предлагать работнику все отвечающие указанным требованиям вакансии, имеющиеся у него в данной местности. Предлагать вакансии в других местностях работодатель обязан, если это предусмотрено коллективным договором, соглашениями, трудовым договором. При отсутствии указанной работы или отказе работника от предложенной работы трудовой договор прекращается в соответствии с пунктом 7 части первой статьи 77 настоящего Кодекса. Изменения определенных сторонами условий трудового договора, вводимые в соответствии с настоящей статьей, не должны ухудшать положение работника по сравнению с установленным коллективным договором, соглашениями.Промежуточный продукт рибосомы после терминации действует как шлюз для рециклинга рибосом
Cell Rep. Автор рукописи; доступно в PMC 2017 14 августа.
Опубликован в окончательной редакции как:
PMCID: PMC5555083
NIHMSID: NIHMS888806
Arjun Prabhakar
1 Департамент структурной биологии Медицинской школы Стэнфордского университета, Стэнфорд, Калифорния 94305, США.
2 Программа по биофизике, Стэнфордский университет, Стэнфорд, Калифорния 94305, США.
Марк К. Кейпче
1 Департамент структурной биологии Медицинской школы Стэнфордского университета, Стэнфорд, Калифорния 94305, США.
3 Химический факультет Стэнфордского университета, Стэнфорд, Калифорния 94305, США.
Алексей Петров
1 Департамент структурной биологии Медицинской школы Стэнфордского университета, Стэнфорд, Калифорния 94305, США.
Джунхонг Чой
1 Департамент структурной биологии Медицинской школы Стэнфордского университета, Стэнфорд, Калифорния 94305, США.
4 Департамент прикладной физики Стэнфордского университета, Стэнфорд, Калифорния 94305, США.
Джозеф Д. Пуглиси
1 Департамент структурной биологии Медицинской школы Стэнфордского университета, Стэнфорд, Калифорния 94305, США.
1 Департамент структурной биологии Медицинской школы Стэнфордского университета, Стэнфорд, Калифорния 94305, США.
2 Программа по биофизике, Стэнфордский университет, Стэнфорд, Калифорния 94305, США.
3 Химический факультет Стэнфордского университета, Стэнфорд, Калифорния 94305, США.
4 Департамент прикладной физики Стэнфордского университета, Стэнфорд, Калифорния 94305, США.
5 Контактное лицо
Окончательная отредактированная версия этой статьи издателя доступна бесплатно в Cell Rep. См. Другие статьи в PMC, в которых цитируется опубликованная статья.Краткое содержание
Во время завершения трансляции растущий пептид сначала высвобождается из рибосомы, которая впоследствии должна быть разобрана на субъединицы посредством процесса, известного как рециклинг рибосомы.У бактерий терминация и рециклинг опосредуются факторами трансляции RF, RRF, EF-G и IF3, но их точные роли остаются неясными. Здесь мы используем флуоресценцию одной молекулы, чтобы отслеживать конформацию и состав рибосомы в режиме реального времени во время терминации и рециклинга. Наши результаты показывают, что высвобождение пептида с помощью RF индуцирует повернутую конформацию рибосомы. RRF связывается с этим повернутым промежуточным продуктом с образованием субстрата для EF-G, который, в свою очередь, катализирует GTP-зависимую разборку субъединицы.После того, как субъединица 50S отходит, IF3 высвобождает деацилированную тРНК из субъединицы 30S, тем самым предотвращая повторную сборку 70S рибосомы. Наши результаты показывают, что ротационное состояние после прерывания является решающим промежуточным звеном при переходе от прерывания к повторному использованию.
Ключевые слова: Рибосома, трансляция, терминация, стоп-кодон, фактор высвобождения, рециклинг, RRF, EF-G, IF3, флуоресценция одиночных молекул прекращение.Прабхакар и др. использовать методы одной молекулы для временного разрешения межсубъединичного вращения после терминации, которое способствует разборке рибосомы, опосредованной факторами. Наблюдаемая конформационная динамика рибосом прояснила роль белковых факторов и время рециклирования.
Введение
Полностью синтезированные белки высвобождаются из рибосомы на стадии терминации трансляции. Затем рибосома разбирается для использования в следующей итерации трансляции посредством процесса, называемого рециклингом.О прекращении сигнализирует присутствие стоп-кодона (UAG, UGA, UAA) в аминоацильном сайте (сайт A) рибосомы, который запускает набор факторов высвобождения (RF) (Youngman et al., 2008). Есть два класса RF. У бактерий RF класса I, RF1 и RF2, распознают кодоны UAG и UGA, соответственно, и оба распознают кодон UAA. После распознавания стоп-кодона RF класса I взаимодействует с пептидилтрансферазным центром (PTC) рибосомы для высвобождения растущего пептида посредством гидролиза сложноэфирной связи, связывающей пептид с тРНК в пептидильном сайте (P-сайт) рибосомы.Гидролиз осуществляется посредством специфических взаимодействий между PTC и универсально консервативным мотивом GGQ RF класса I, который, как было показано, структурно и биохимически важен для гидролиза пептидов (Frolova et al., 1999; Laurberg et al., 2008; Zavialov et al. др., 2002).
RF класса II в бактериях, RF3, представляет собой GTPase, которая ускоряет диссоциацию RF класса I после высвобождения пептида (Freistroffer et al., 1997), но его механизм остается неясным. Тем не менее, RF3 не важен для жизнеспособности клеток (Grentzmann et al., 1994; O’Connor, 2015), и только часть видов бактерий имеет RF3 в своих геномах (Margus et al., 2007). Это отсутствие указывает на то, что RF3 не является частью консервативного механизма терминации и что он может просто повышать эффективность терминации и рециклинга (Koutmou et al., 2014; McDonald and Green, 2012).
После терминации и высвобождения пептида комплекс 70S, несущий деацилированные тРНК и мРНК P-сайта, разбирается на отдельные компоненты с помощью механизма рециклинга, включающего фактор рециклинга рибосом (RRF), фактор элонгации EF-G и фактор инициации IF3.RRF и EF-G, как предполагается, работают совместно, когда они связаны с рибосомой, требуя гидролиза GTP с помощью EF-G, чтобы катализировать диссоциацию 50S субъединицы (Zavialov et al., 2005). Роль IF3, а также время диссоциации субъединицы и тРНК могут соответствовать одной из двух конкурирующих моделей. Первый (Hirokawa et al., 2005) предполагает, что EF-G функционирует посредством механизма, подобного транслокации, перемещая RRF в Р-сайт рибосомы, вызывая сначала диссоциацию тРНК Р-сайта, а затем спонтанную диссоциацию субъединиц и мРНК.IF3 затем связывается с субъединицей 30S, чтобы предотвратить повторную ассоциацию субъединицы 50S. В качестве альтернативы (Borg et al., 2016; Karimi et al., 1999; Peske et al., 2005; Zavialov et al., 2005) субъединица 50S может быть сначала удалена с помощью RRF и EF-G. Остальная часть комплекса затем будет разобрана с помощью IF3-индуцированного выхода тРНК P-сайта с последующей диссоциацией мРНК от 30S субъединицы. Прямое измерение времени этих событий необходимо для выяснения механизма рециклинга рибосом.
Терминирующая рибосома принимает конформационные состояния, которые напоминают те, которые возникают во время элонгации.Во время элонгации образование пептидной связи приводит к вращению 30S-субъединицы на 3–10 ° против часовой стрелки относительно 50S-субъединицы (Agirrezabala et al., 2008; Frank and Agrawal, 2000; Valle et al., 2003), что приводит к тому, что определяется как повернутая конформация. Было высказано предположение, что гидролиз пептида из тРНК P-сайта запускает сходные конформационные изменения в рибосоме, которые активируют RF3, чтобы запустить диссоциацию RF1 и RF2 (Zavialov et al., 2002). Криоэлектронная микроскопия (Cryo-EM) структур показала различия во вращении межсубъединичных рибосом (Gao et al., 2007) при привязке к разным классам факторов выпуска. В комплексе с RF1 или RF2 рибосома проявляла не повернутую конформацию, напоминающую рибосому после транслокации, тогда как связанная с RF3 рибосома находилась в конформации повернутого состояния, о чем сообщалось как о вращении на 10 ° против часовой стрелки. Эти конформационные различия рибосом были дополнительно продемонстрированы в кристаллических структурах класса I, связанных с RF (Korostelev et al., 2008; Laurberg et al., 2008; Weixlbaumer et al., 2008), и с RF3-связанными (Jin et al., 2011; Zhou et al., 2012) рибосомы. Структурные данные показали, что связанный с RRF комплекс 70S также находится в повернутом состоянии (Dunkle et al., 2011; Gao et al., 2005). Эти наблюдения указывают на то, что конформация рибосом модулируется факторами и может играть ключевую роль в механизмах терминации и рециклинга. Динамическое взаимодействие между связыванием фактора и конформацией рибосом во время терминации и рециклинга остается неясным.
Чтобы выяснить механизмы терминации и рециклинга, мы использовали подходы флуоресценции одиночных молекул для отслеживания нескольких этапов терминации и рециклинга в режиме реального времени.Мы исследовали взаимодействия класса I RF, EF-G, RRF и IF3 с одиночными транслирующимися рибосомами, чтобы коррелировать лигандный состав с конформационным состоянием рибосомы, что отслеживается с помощью Förster Resonance Energy Transfer (FRET). Связывая эти состояния с событиями связывания лиганда, мы выявили конформационную динамику рибосом, происходящую после терминации, которая является центральной в механизме рециклинга рибосом.
Результаты
Отслеживание терминации в реальном времени с использованием флуоресцентно меченных факторов высвобождения класса I
Мы контролировали весь процесс трансляции от инициации до повторного использования, используя нашу ранее описанную систему с одной молекулой, в которой используется модифицированный волновод нулевого режима (ZMW). ) на основе секвенсора реального времени (RS) (Chen et al., 2014) (). В этой установленной системе 30S и 50S рибосомных субъединиц E. coli сайт-специфично помечены флуорофором Cy3B и тушителем BHQ-2, соответственно, для обнаружения межсубъединичных конформационных изменений во время трансляции (Chen et al., 2012). Для отслеживания событий терминации мы подготовили и охарактеризовали флуоресцентно меченные RF1 (Sternberg et al., 2009) и RF2 (). Более подробно, мы доставили Cy5-меченные RF1 или RF2 с BHQ-2-меченными 50S-субъединицами, тройные комплексы аминоацил-тРНК (Phe-тРНК , Phe — EF-Tu — GTP) (Phe-TC) и EF-G для иммобилизованные 30S преинициативные комплексы (PIC), состоящие из Cy3B-меченой 30S субъединицы, инициатора fMet-тРНК fMet , связанного с GTP фактора инициации IF2 и 5′-биотинилированной мРНК с AUG-UUC-stop (MF-stop) последовательность кодонов в открытой рамке считывания.Стоп-кодоном был UAG или UAA для экспериментов с RF1 и UGA или UAA для экспериментов с RF2. В представленных здесь экспериментах мы не включали RF3, так как он не важен для завершения. Мы рассмотрим роль RF3 в контексте наших данных о прекращении и переработке данных в Обсуждении.
Экспериментальная установка(A) Во всех экспериментах преинициативные комплексы 30S (PIC), содержащие Cy3B-30S, fMet-тРНК , fMet и IF2-GTP, иммобилизуются на поверхности лунок ZMW через биотинилированные мРНК.Реакция запускается доставкой BHQ-2–50S, Phe-TC, EF-G и Cy5-RF1 или Cy5-RF2.
(B) Структура связанной с RF2 70S рибосомы (Коростелев и др., 2008), показывающая положение флуоресцентного мечения на С-конце (C367).
(C) Внизу: репрезентативный след Cy3B- и BHQ-2-меченой рибосомы, транслирующейся в присутствии Phe-TC, EF-G и Cy5-RF. Вверху: схема трансляции с состояниями рибосом, связанными с сигналами флуоресценции в следе. Доставка реагентов приводит к инициации через присоединение 50S-субъединицы (показано гашением зеленого сигнала Cy3B), за которым следует один раунд элонгации (сообщается циклом низкой и высокой интенсивностей Cy3B), затем связывание Cy5-RF во время терминации (показано как красный сигнал Cy5, см. также рисунок S1).Выход Cy5-RF после высвобождения пептида коррелирует с вращением рибосом, представляя промежуточное звено повернутого состояния после терминации (выделено серым). Cy5-RF может повторно связываться с этим промежуточным продуктом, чтобы вызвать вращение рибосомы обратно в неповоротное состояние. RRF и EF-G связываются с этой повернутой после терминации рибосомой, чтобы катализировать диссоциацию 50S-субъединицы. В рамке: последовательности мРНК, использованные в этих экспериментах.
Используя сигналы от меченных красителем RFs, мы наблюдали инициацию, удлинение и завершение трансляции ().Трансляция начинается с присоединения субъединицы 50S к 30S PIC, давая не повернутую рибосому 70S, что показано гашением зеленого сигнала Cy3B. За инициацией следует один раунд элонгации, в результате чего связывание тройного комплекса и образование пептидной связи переводят субъединицы в повернутое состояние, а транслокация с помощью EF-G переводит вращение обратно в невращенное состояние, как показано увеличением и уменьшением Cy3B. интенсивность соответственно. Описанное выше поведение рибосом согласуется с ранее описанными конформационными перестройками рибосом во время трансляции в нашей системе (Aitken and Puglisi, 2010; Chen et al., 2013; Маршалл и др., 2008; Петров и др., 2012). Сигнал связывания Cy5-RF1 или Cy5-RF2 не наблюдался во время стадий инициации и элонгации, когда смысловой кодон представлен в сайте A рибосомы. Как только транслокация помещает стоп-кодон мРНК MF-stop в сайт A, он готов к распознаванию родственным ему RF класса I. Сигнал связывания Cy5-RF1 на этой стадии наблюдался только в экспериментах с мРНК MF-UAG и MF-UAA, а сигнал связывания Cy5-RF2 наблюдался только у пациентов с MF-UGA и MF-UAA, демонстрируя специфичность RF1 и RF2. для их родственных стоп-кодонов.
Скорости ассоциации Cy5-RF1 и Cy5-RF2 с пре-терминирующими комплексами 70S (k preRF, на ) были определены из линейной аппроксимации наблюдаемой скорости (k obs ), рассчитанной из единственного экспоненциального соответствия Распределение времени прибытия (рисунок S1). Скорости для Cy5-RF1 и Cy5-RF2 находились в диапазоне 15-17 мкМ -1 с -1 и 10-16 мкМ -1 с -1 , соответственно, что аналогичны ранее определенной кинетике связывания RF1 (Hetrick et al., 2009). Выход Cy5-RF1 и Cy5-RF2 коррелировал с вращением рибосом, выявляя промежуточное звено повернутого состояния после терминации, которое характеризуется отсутствием факторов (). Оба Cy5-RF сохраняли сродство к этому промежуточному продукту, поскольку мы наблюдали частое повторное связывание факторов с рибосомой после терминации, что позволяет предположить, что стоп-кодон все еще находится в сайте A после терминации. События повторного связывания Cy5-RF коррелировали с обратимыми поворотами рибосом, поскольку рибосома переходит в невращенное состояние при связывании с любым из Cy5-RF.Промежуточное соединение в вращенном состоянии без RF также предшествует событию диссоциации 50S субъединицы, что проявляется в понижении уровня сигнала Cy3B обратно до начальной интенсивности, что является первым признаком разборки рибосомы.
Ротация рибосом после терминации произошла после ухода RF в 89 ± 2% и 93 ± 2% рибосом, связанных с RF1 и RF2, соответственно; В остальных молекулах, подвергнутых цензуре к концу фильма о приобретении, отклонение RF не наблюдалось. Этот переход от неподвижного состояния к повернутому состоянию конформации 70S рибосомы напоминает перенос пептидила во время элонгации.Чтобы сравнить новое повернутое состояние после завершения с повернутым состоянием во время удлинения (Aitken and Puglisi, 2010), мы количественно оценили их эффективность FRET с помощью флуоресцентной микроскопии полного внутреннего отражения (TIRFM). Измеренная эффективность FRET для состояний вращения после прекращения и удлинения составляла 0,29 ± 0,08 (рис. S2), что сравнимо с ранее сообщенной эффективностью FRET (Marshall et al., 2008). Основываясь на ограниченной конформационной информации FRET, мы постулируем, что повернутое состояние после терминации подобно повернутому состоянию до транслокации, принимаемому рибосомой во время элонгации.
Переход от невращенной к повернутой конформации 70S рибосомы также ранее наблюдался при обработке комплексов элонгации 70S, содержащих пептидил-тРНК, лекарственным средством пуромицином (Ermolenko et al., 2007; Marshall et al., 2008; Valle et al. др., 2003). Пуромицин связывается с PTC и активирует перенос пептидила с тРНК P-участка на пуромицин, что приводит к высвобождению пептида при диссоциации пуромицин-пептид. Точно так же обработка пуромицином комплексов 70S с пре-терминированием также приводит к этому переходу из неподвижного состояния рибосомы в повернутое (рис. S3A, S3B).Чтобы проверить, требует ли переход в повернутое состояние после выхода RF класса I также гидролиз пептидил-тРНК, мы повторили анализ терминации, используя Cy5-меченный мутант RF2 с единственной аланиновой мутацией в мотиве GGQ до GAQ (RF2 G251A ), что снижает активность RF2 по гидролизу пептидов в 20 000 раз (Завьялов и др., 2002). С Cy5- (GAQ) RF2 переход в повернутое состояние наблюдается только в 3 ± 1% рибосом, которые связаны с RF2 (Рисунок S4), что в 33 раза ниже, чем у функционального Cy5-RF2.Остальные рибосомы демонстрируют множественные события связывания Cy5- (GAQ) RF2, которые не создают повернутого состояния после терминации. Эти эксперименты показывают, что образование повернутого состояния после терминации требует высвобождения растущего пептида.
Как упоминалось ранее, RF класса I могут повторно связываться с рибосомой после терминации. События повторного связывания RF наблюдались в 77 ± 6% и 66 ± 7% терминированных рибосом с RF1 и RF2, соответственно; оставшаяся фракция рибосом подверглась диссоциации 50S субъединицы из повернутого состояния до того, как может произойти повторное связывание RF2, что объясняется в следующем разделе.События повторного связывания RF происходили одновременно с переходами рибосом между повернутым и не повернутым состояниями, генерируя антикоррелированные интенсивности флуоресценции Cy3B и Cy5 (). Хотя эту антикорреляцию можно ошибочно интерпретировать как сигнатуру FRET между 30S субъединицей и RF, структурное моделирование предсказывает расстояния между положением маркировки спирали 44 30S-субъединицы и положениями маркировки RF равными 130 Å и 110 Å для Cy5-. RF1 и Cy5-RF2 соответственно (Dorywalska et al., 2005; Коростелев и др., 2008), которые находятся далеко за пределами обнаруживаемого диапазона FRET. Чтобы подтвердить, что изменения в интенсивности Cy3B происходят из-за вращения рибосомы, а не из-за FRET между рибосомой и RF, мы заменили Cy5-RF на немеченые RF1 или RF2 дикого типа и по-прежнему наблюдали изменения интенсивности Cy3B (Рисунок S5), подтверждая связь посттерминационных поворотов рибосом с занятостью RF. Время пребывания этих дополнительных повернутых и не повернутых состояний после терминации измеряли при различных концентрациях RF1 и RF2, чтобы исследовать влияние связывания факторов на конформацию рибосом.Среднее время пребывания в повернутых состояниях зависит от концентрации RF, тогда как среднее время пребывания в невращенном состоянии не зависит от концентрации RF. Эти времена пребывания указывают на то, что ассоциация RF с рибосомой после терминации опосредует межсубъединичную конформацию рибосомы. Высвобождение пептида обработкой пуромицином рибосом пре-терминации в присутствии дисфункционального Cy5- (GAQ) RF2 привело к аналогичному сочетанию занятости Cy5- (GAQ) RF2 и конформации рибосомы (фиг. S6).Это наблюдение далее идентифицировало высвобождение пептида как предпосылку для вращения рибосом после терминации и что каталитическая активность RF2 не обязательна для этих изменений.
Спонтанная диссоциация субъединицы 50S из повернутого состояния после терминации
Комплексы 70S после терминации могут диссоциировать на субъединицы 50S и 30S даже в отсутствие дополнительных компонентов рециклинга (RRF и IF3). 100% событий диссоциации субъединицы 50S происходили из повернутого состояния рибосомы после терминации ().Когда пре-терминирующие комплексы 70S обрабатывали пуромицином в ранее описанном эксперименте, диссоциация субъединицы 50S наблюдалась даже в отсутствие РФ (фиг. S3A, S3B). Таким образом, спонтанная диссоциация субъединицы 50S происходит из не связанного RF повернутого состояния после терминации. События повторного связывания RF переводят рибосомы в неподвижное состояние, ингибируя диссоциацию 50S-субъединицы. Исходя из наших результатов, мы предлагаем два конкурирующих пути из состояния ротации после прерывания, как схематически показано в. Наблюдаемая скорость исчезновения этого повернутого состояния после завершения (k obs ) может быть записана как сумма скоростей RF-ассоциации с состоянием вращения после завершения (k postRF, на ) и спонтанной субъединицей 50S. скорость диссоциации из повернутого состояния (k 50S, off ) ().Наблюдаемая константа скорости k obs была определена путем измерения времени пребывания в повернутых состояниях после прекращения (, рисунок S3B) и подгонки ансамблевого распределения этих времен пребывания к одной экспоненте для получения константы скорости первого порядка (, Рисунок S3C). Линейная аппроксимация этих значений k obs дала наклон как скорость ассоциации RF2 (k postRF, на = 2,8 ± 0,2 мкМ −1 с −1 ) и пересечение оси y как скорость диссоциации 50S. (к 50S, выкл = 0.022 ± 0,001 с −1 ) (). Чтобы подтвердить скорость диссоциации субъединицы 50S в отсутствие RF2, мы определили скорость диссоциации субъединицы 50S из повернутого состояния после терминации, индуцированного пуромицином (k 50S, выкл., Пуромицин ), аппроксимируя распределение времени пребывания этого повернутого состояние к одноэкспоненциальной функции. Рассчитанная скорость составила 0,020 ± 0,003 с -1 , что сопоставимо с ранее определенной скоростью спонтанной диссоциации субъединицы 50S из экспериментов по прерыванию RF2.Используя аналогичный подход к временам пребывания связанного с RF2 не повернутого состояния, мы определили скорость диссоциации RF2 из рибосомы посттерминации (k RF, off ), равную 0,157 ± 0,038 с -1 . Эти кинетические параметры описывают относительно нестабильную частицу 70S после обрыва с периодом жизни 50 секунд в отсутствие факторов рециклинга. Эта скорость разборки, однако, намного ниже, чем 2,8 ± 0,2 мкМ −1 с −1 RF2, скорость ассоциации после терминации при клеточных концентрациях RF2 более 1 мкМ (Adamski et al., 1994). Присутствие RF2 значительно снижает вероятность диссоциации субъединицы 50S, таким образом, необходимы дополнительные белковые факторы, чтобы управлять рециклингом рибосом in vivo .
RF повторное связывание ингибирует разборку 70S рибосомы после терминации.(A) Схема, описывающая два конкурирующих пути от промежуточного звена во вращающемся состоянии после терминации в отсутствие каких-либо факторов рециклинга. Наблюдаемая скорость исчезновения (k obs ) этого промежуточного продукта равна сумме скоростей двух конкурирующих путей: повторного связывания RF (k postRF, на [RF]) и спонтанной диссоциации субъединицы 50S (k 50S. , оф ).
(B) Репрезентативная кривая, выделяющая чередующиеся состояния после завершения.
(C) Постсинхронизация времени пребывания в повернутом состоянии после завершения показывает экспоненциальный спад популяции повернутого состояния после завершения. Это распределение соответствовало одноэкспоненциальному уравнению, чтобы получить k obs .
(D) График зависимости k obs от [RF2]. Наклон и пересечение по оси Y линейной аппроксимации методом наименьших квадратов на графике представляют скорость повторного связывания RF (k postRF, на ) и скорость диссоциации субъединицы 50S (k 50S, off ), соответственно.Планки погрешностей представляют собой стандартное отклонение.
Диссоциация субъединицы 50S в отсутствие RRF и IF3 является обратимой, и скорость реассоциации 50S (k 50S, на ) была измерена при 0,75 ± 0,07 мкМ -1 с -1 . Важно, что повторная ассоциация помещает две субъединицы в повернутую конформацию (Рис. S7A), аналогичную состояниям, наблюдаемым во время инициации (Marshall et al., 2009). RF могут связываться с повторно собранной рибосомой, снова приводя к невращенному состоянию 70S, что убедительно свидетельствует о том, что стоп-кодон все еще находится в A-сайте.Таким образом, рамка считывания должна поддерживаться деацилированной тРНК, остающейся в Р-сайте, и для завершения разборки трансляционного комплекса во время рециклинга требуются дополнительные факторы.
RRF и EF-G способствуют диссоциации субъединицы 50S
Затем мы исследовали эффекты RRF и EF-G на события после терминации в присутствии 10 нМ Cy5-RF2. Та же экспериментальная установка (), что описана ранее, использовалась с добавлением RRF к смеси для доставки BHQ-2–50S, EF-G, Phe-TC и Cy5-RF2.В отсутствие RRF при 50 нМ EF-G большинство (66%) рибосом подверглись событиям повторного связывания RF2. При увеличении добавления RRF эта доля связанных с RF2 невращающихся рибосом после терминации снижалась до 9 ± 2% при физиологической концентрации RRF (20 мкМ) (). Поскольку как RF класса I, так и RRF связываются с рибосомным сайтом A, RF класса I и RRF, вероятно, конкурируют за связывание с рибосомой в повернутом состоянии после терминации, так что ассоциация RRF стабилизирует повернутое состояние, в то время как RF класса I индуцируют переход к неповоротное состояние.Эта гипотеза согласуется с сообщениями о кристаллических структурах посттерминационных рибосом в повернутой конформации при связывании с RRF (Dunkle et al., 2011; Gao et al., 2005) и не повернутой конформации при связывании с RF2 (Коростелев и др., 2008 г.). Доля рибосом с повторным связыванием RF2 также уменьшается с увеличением концентрации EF-G () из-за того, что EF-G ускоряет этап диссоциации субъединицы 50S, что объясняется в следующем абзаце. Таким образом, RRF и EF-G совместно преодолевают ингибирующие эффекты повторного связывания RF2, чтобы способствовать рециклингу рибосом путем связывания в повернутом состоянии.
RRF и EF-G блокируют повторное связывание RF и катализируют разборку субъединиц(A) Процент рибосом, показывающих повторное связывание RF при 0,05 и 1 мкМ EF-G, как функция [RRF].
(B) Процент рибосом, показывающих повторное связывание RF при нулевом, 1 и 20 мкМ RRF, как функция [EF-G].
(C) Время разборки субъединицы при 0,05 и 1 мкМ EF-G как функция [RRF]. Время разборки субъединицы определяется как среднее время пребывания в повернутом состоянии после завершения до диссоциации 50S субъединицы.Планки погрешностей представляют S.E.M.
(D) Время разборки субъединицы при 1 и 20 мкМ RRF, построенное как функция [EF-G]. Планки погрешностей представляют S.E.M.
Чтобы охарактеризовать скорость разборки субъединицы в присутствии RRF и EF-G, мы измерили время пребывания последнего повернутого состояния перед диссоциацией 50S субъединицы. Это время разборки субъединицы в отсутствие RRF составляло 14,6 ± 2,1 с при 10 нМ Cy5-RF2 и 50 нМ EF-G (). Хотя добавление RRF блокировало события повторного связывания RF2, только увеличение RRF практически не влияло на время разборки субъединицы при 50 нМ EF-G.Даже при насыщающих рибосомы концентрациях RRF (20 мкМ) время разборки было незначительно сокращено до 13,3 ± 0,9 с. Однако с увеличением концентраций EF-G мы наблюдали более быструю разборку субъединиц при более высоких концентрациях RRF. Время разборки субъединицы было сокращено до 1,5 ± 0,2 с при концентрациях, близких к физиологическим (20 мкМ RRF, 5 мкМ EF-G). Отсутствие зависимости от концентрации RRF при низких концентрациях EF-G указывает на то, что разборка субъединицы была ограничена связыванием EF-G. В результате увеличение концентраций как RRF, так и EF-G также ингибирует повторное связывание RF класса I, ускоряя процесс разборки субъединицы.При постоянной концентрации RRF время разборки субъединицы сначала уменьшалось, а затем увеличивалось с увеличением концентрации EF-G (). Ингибирующий эффект при высоких концентрациях EF-G и низких концентрациях RRF может указывать на то, что связывание EF-G до связывания RRF не приводит к успешной диссоциации субъединицы. Это ингибирование уменьшается при более высокой концентрации RRF, где связывание RRF предположительно предшествует связыванию EF-G. Таким образом, только последовательное связывание RRF и EF-G в таком порядке приводит к успешному катализу диссоциации субъединицы 50S.
EF-G катализирует разборку субъединицы посредством гидролиза GTP.
Чтобы отслеживать роль EF-G в рециклинге напрямую, мы использовали Cy5-меченный EF-G, RF2 дикого типа и RRF в той же установке флуоресценции одной молекулы. Как наблюдалось ранее, временное связывание EF-G происходит во время элонгации и коррелирует с переходом от повернутого к невращенному состоянию при транслокации посредством гидролиза GTP () (Chen et al., 2013). После завершения с помощью RF2 мы наблюдали быстрые события связывания EF-G, представленные короткими импульсами Cy5, в повернутые состояния после завершения ().Некоторые из этих импульсов Cy5 были длиной в один кадр (33 мс) с различной интенсивностью флуоресценции, что указывает на то, что некоторые события связывания Cy5-EF-G имели длительность менее 33 мс. Оценивая эти события как ровно один кадр, мы вычислили верхний предел для среднего времени пребывания Cy5-EF-G, равный 50–60 мс (). Временные интервалы между событиями связывания EF-G или временем прибытия EF-G были подогнаны к одной экспоненте для получения скорости ассоциации. В присутствии насыщающих рибосомы концентраций RRF (20 мкМ) EF-G связывается со скоростью ассоциации (k G2 ), равной 2.10 ± 0,09 мкМ −1 с −1 (). При 20 мкМ RRF и 50 нМ Cy5-EF-G 59 ± 5% рибосом, подвергающихся разборке субъединицы, имели коррелированный импульс Cy5-EF-G, представляющий связь связывания EF-G и катализа с разборкой субъединицы во время рециклинга () . Оставшаяся некоррелированная фракция, скорее всего, представляет собой спонтанную диссоциацию субъединицы 50S, учитывая медленную каталитическую скорость диссоциации при 20 мкМ RRF и 50 нМ EF-G (). Доля событий разборки субъединиц, коррелированных с импульсами Cy5-EF-G, увеличивалась до 78 ± 5% при 200 нМ Cy5-EF-G, дополнительно подтверждая это обоснование.В отсутствие RRF мы наблюдали быстрые события отбора образцов Cy5-EF-G в повернутом состоянии после терминации, что согласуется с более ранними экспериментами, согласно которым EF-G может связываться с терминальным комплексом 70S без RRF. Скорость ассоциации EF-G без RRF была примерно в 9 раз выше, чем с 20 мкМ RRF (k G1 = 18,6 ± 0,8 мкМ -1 с -1 ,). В отсутствие RRF и при 50 нМ Cy5-EF-G было гораздо меньше рибосом, проходящих разборку субъединицы, и из них только 8,5 ± 3.7% коррелировали с импульсами Cy5-EF-G. В целом это говорит о том, что EF-G не может эффективно катализировать разборку субъединицы без RRF.
EF-G связывается с рибосомой, связанной с RRF, чтобы катализировать разборку субъединицы гидролизом GTP(A) Типичный след 50 нМ Cy5-EF-G-GTP в эксперименте в присутствии 20 мкМ RRF (и 10 нМ RF2 дикого типа, 50 нМ Phe TC и 100 нМ BHQ-2), демонстрирующие импульсы Cy5-EF-G во время удлинения и рециркуляции. Во время рециклирования Cy5-EF-G связывается с состоянием вращения после терминации и коррелирует с диссоциацией 50S субъединицы (выделено рамкой).
(B) Пост-синхронизация сигнала разборки субблока и занятости Cy5-EF-G (GTP) в присутствии RRF, как показано на панели (A).
(C) Репрезентативная кривая, показывающая множественные быстрые импульсы непродуктивного связывания Cy5-EF-G (GTP) с состоянием вращения после завершения в отсутствие RRF.
(D) Репрезентативная кривая, показывающая длительную занятость Cy5-EF-G (GDPNP) до повернутого состояния как в присутствии, так и в отсутствие RRF. FRET наблюдается между Cy5-EF-G и Cy3B-30S.
(E) Среднее время пребывания импульсов Cy5-EF-G в присутствии или отсутствии 20 мкМ RRF и различных гуаниновых нуклеотидов (G-ntd): GTP или GDPNP.Планки погрешностей представляют S.E.M.
Чтобы проверить, приводят ли эти события связывания EF-G к гидролизу GTP, мы отслеживали поведение Cy5-EF-G в присутствии GDPNP, негидролизуемого аналога GTP (). В этих экспериментах Cy5-EF-G-GDPNP и RF2 доставлялись в пре-терминирующий комплекс 70S. Ингибирование гидролиза GTP вызывало по крайней мере 500-кратное увеличение времени пребывания EF-G, измеряемого по времени жизни Cy5, как в присутствии, так и в отсутствие 20 мкМ RRF (). Этот результат указывает на то, что связанный с GTP EF-G имеет высокое сродство к рибосомам в повернутом состоянии и не зависит от RRF.Гидролиз GTP генерирует связанный с GDP EF-G, который имеет низкое сродство к рибосомам в повернутом состоянии и быстро диссоциирует с образованием ранее описанных быстрых импульсов Cy5. Таким образом, EF-G гидролизует GTP при связывании как с RRF-связанной рибосомой, так и с пустой пост-терминационной рибосомой с вращенным состоянием, но только гидролиз GTP с EF-G и RRF, связанными с рибосомой, приводит к отходу продуктивной 50S-субъединицы.
IF3 диссоциирует тРНК P-сайта из комплекса 30S после расщепления субъединицы
Эксперименты с RF2, RRF и EF-G показали, что посттерминационные комплексы 30S, вероятно, сохраняют тРНК P-сайта, которая поддерживает стоп-кодон A-сайта в правильный кадр.Даже в присутствии RRF и EF-G мы наблюдали, что после диссоциации первой 50S-субъединицы другая может повторно связываться с 30S-комплексом из пула 50S-субъединиц в растворе (рис. S7A). Более того, Cy5-RF2 может связываться с этим новым комплексом 70S и вызывать конформационные изменения рибосомы в невращенное состояние. Тот факт, что RF2 все еще связывается с этим преобразованным комплексом 70S с длительным временем пребывания, указывает на то, что стоп-кодон все еще находится в сайте A, а тРНК P-сайта поддерживает рамку считывания.Чтобы отслеживать занятость тРНК P-сайта напрямую, мы доставили Cy5.5-меченную Phe-тРНК Phe вместе с 10 нМ Cy5-RF2, 50 нМ EF-G и 1 мкМ RRF в рибосому, транслирующую MF- Последовательность UGA. По сохранению сигнала Cy5.5 на протяжении всего эксперимента мы наблюдали, что тРНК P-участка остается связанной с субъединицей 30S после диссоциации субъединицы 50S ().
IF3 связывается с комплексом 30S-тРНК-мРНК, чтобы вызвать отход тРНК, за которым следует диссоциация 30S-субъединицы.(A) Репрезентативная кривая, показывающая, что Cy5.5-тРНК Phe не отклоняется в присутствии 1 мкМ RRF и 500 нМ EF-G без IF3. Cy5.5-тРНК Присутствие Phe необходимо для наблюдаемой обратимости диссоциации субъединицы 50S и повторного связывания Cy5-RF2. См. Также рисунок S7A.
(B) Среднее время жизни флуоресценции Cy5.5 уменьшается в присутствии 1 мкМ IF3. Планки погрешностей представляют S.E.M.
(C) Репрезентативная кривая, показывающая, что за диссоциацией субъединицы BHQ-2–50S следует последовательное отклонение субъединицы Cy5.5-тРНК Phe и Cy3B-30S в присутствии 1 мкМ RRF, 500 нМ EF-G, и 1 мкМ IF3.Вставка: выделены задержка между диссоциацией 50S-субъединицы и отъездом тРНК (синяя линия) и задержка между отъездом тРНК и диссоциацией 30S-субъединицы (оранжевая линия). См. Также рисунок S7B.
(D) Среднее время ухода тРНК, определяемое как время задержки между диссоциацией 50S субъединицы и уходом тРНК (синий), зависит от концентрации IF3. Среднее время ухода 30S-субъединицы, определяемое как время задержки между уходом тРНК и диссоциацией 30S-субъединицы (оранжевый), не зависит от концентрации IF3.Планки погрешностей представляют S.E.M.
Предыдущие исследования показали, что IF3 предотвращает повторное образование 70S рибосомы после рециклинга (Hirokawa et al., 2005; Peske et al., 2005). Чтобы воспроизвести это открытие, мы добавили 1 мкМ IF3 в наш эксперимент с одной молекулой. В присутствии 1 мкМ IF3 и 1 мкМ RRF реассоциация субъединицы 50S блокировалась. Вместо этого сигнал Cy3B быстро терялся (18,8 ± 1,8 с) после отрыва субъединицы 50S (рисунок S7B), сообщая, что субъединица 30S отделилась от иммобилизованной мРНК.Затем мы отслеживали занятость тРНК P-сайта с использованием Cy5.5-меченной Phe-тРНК Phe в эксперименте по доставке IF3 и наблюдали двукратное сокращение времени жизни флуоресценции Cy5.5 (), а сигнал Cy5.5 равен потеряна между моментами времени событий диссоциации 50S и 30S субъединиц (). Из измеренных временных интервалов между тремя событиями диссоциации (50S, тРНК, 30S) только время выдержки между диссоциацией субъединицы 50S и диссоциацией тРНК зависело от концентрации IF3, показывая двукратное уменьшение, когда концентрация IF3 была удвоена () .Эта корреляция между скоростью отхода тРНК и концентрацией IF3 указывает на то, что IF3 индуцирует диссоциацию деацилированной тРНК из комплекса 30S после того, как субъединица 50S рециклируется независимо. После диссоциации тРНК субъединица 30S немедленно диссоциирует от мРНК (k 30S = 0,514 ± 0,017 с -1 ). Это примерно 2-секундное среднее время пребывания для субъединицы 30S после отъезда тРНК намного короче, чем время его пребывания в отсутствие IF3 (больше, чем 5-минутное окно наблюдения.В целом, эти результаты показывают, что IF3 индуцирует отход тРНК от 30S субъединицы, тем самым завершая процесс рециклинга рибосом.
Обсуждение
Здесь мы применили одномолекулярные методы в реальном времени для отслеживания конформационной и композиционной динамики терминации бактериальной трансляции и рециклинга. Мы наблюдаем специфическое распознавание стоп-кодонов в A-сайте RF класса I и, косвенно, высвобождение растущего пептида посредством гидролиза пептидил-тРНК. После того, как RF класса I высвобождает пептид на тРНК P-участка, он диссоциирует, что приводит к сопряженному вращению 30S-субъединицы против часовой стрелки с образованием повернутого состояния.Это повернутое состояние после терминации является ключевым промежуточным звеном рибосомы на стыке терминации и рециклинга. В отсутствие факторов рециклинга этот промежуточный продукт в повернутом состоянии претерпевает два конкурирующих процесса: (1) RF1 и RF2 могут повторно связываться с рибосомой, стабилизируя неповоротную конформацию и блокируя разборку субъединицы, или (2) субъединица 50S может медленно диссоциировать от в повернутом состоянии, но позже может вернуться в повернутое состояние. Ни один из этих процессов не является необратимым, поэтому для полной и быстрой переработки требуются RRF, EF-G и IF3.При наличии RRF повторная выборка RF1 и RF2 после завершения блокируется, и предпочтение отдается измененному состоянию. В то время как RRF и EF-G совместно занимают рибосому в повернутом состоянии, гидролиз GTP с помощью EF-G приводит к быстрому расщеплению частицы 70S на отдельные субъединицы. IF3 затем быстро удаляет тРНК P-сайта с последующей потерей рамки считывания. Таким образом, последний процесс становится необратимым, и субъединицы переводятся на другой раунд трансляции.
Наши результаты подчеркивают важность межсубъединичной конформации рибосом во время терминации и рециклинга.Эксперименты по терминации с Cy5-RF показали, что высвобождение пептида приводит к образованию повернутого состояния в отсутствие связанных белковых факторов. Подобное конформационное изменение происходит во время элонгации, когда растущий пептид переносится с тРНК P-сайта на тРНК A-сайта, о чем свидетельствуют сходные распределения значений FRET для состояний поворота элонгации и терминации (рис. S2). Как при элонгации, так и при терминации деацилирование тРНК P-участка приводит к конформационным колебаниям тРНК между классическим состоянием P / P и гибридным состоянием P / E (Blanchard et al., 2004; Штернберг и др., 2009). Хотя все еще обсуждается, колеблется ли межсубъединичная конформация рибосом аналогичным образом после переноса пептида (Aitken and Puglisi, 2010; Chen et al., 2011; Chen et al., 2013; Cornish et al., 2008; Fei et al., 2008; Julian et al., 2008; Marshall et al., 2008; Munro et al., 2010), EF-G связывается для стабилизации повернутого состояния перед транслокацией. Во время терминации мы наблюдаем постпептидную рибосому в повернутом состоянии после RF-диссоциации I класса, но в отличие от элонгации, RF-повторное связывание возвращает рибосому обратно в неповоротное состояние, что согласуется с прошлыми структурными данными (Korostelev et al., 2008). Мы предполагаем, что высвобождение пептида изменило энергетику конформационного обмена в отличие от энергетического ландшафта удлиняющейся рибосомы во время переноса пептидила с участием двух тРНК, так что связывание RF приводит к переходу в невращенное состояние. Эти переходы отсутствуют, когда пептид не может высвобождаться дисфункциональными мутантными RF класса I, но высвобождение пептида пуромицином восстанавливает способность мутантных RF вызывать конформационные изменения. Кроме того, это повернутое состояние после терминации восприимчиво к некаталитической диссоциации субъединицы 50S (k 50S, off = 0.022 ± 0,001 с −1 ). Это снижение межсубъединичного сродства при посттерминационном вращении рибосом возможно из-за разрушения ключевых межсубъединичных мостов из-за вращения субъединиц (Liu and Fredrick, 2016; Yusupov et al., 2001). Лабильное повернутое состояние после терминации, которое присутствует только после успешного высвобождения пептида, является субстратом для рециклинга RRF и EF-G. Таким образом, этот промежуточный продукт служит воротами к рециклингу рибосом.
В наших экспериментах мы не наблюдали связанное с RF ротационное состояние пост-терминации класса I, что предполагает, что фактор имеет низкое сродство к ротационному состоянию пост-терминации.Поскольку RF3 был идентифицирован в прошлом для связывания с повернутым состоянием (Gao et al., 2007; Jin et al., 2011; Zhou et al., 2012), было высказано предположение, что RF3 может активно индуцировать вращение рибосом для ускорения класса I. RF-диссоциация (Gao et al., 2007; Koutmou et al., 2014; Peske et al., 2014; Shi and Joseph, 2016). Связь, которую мы наблюдаем между конформацией рибосом и занятостью РФ класса I, поддерживает эту предложенную модель.
Невращенное состояние, связанное с RF, класса I значительно ингибирует диссоциацию 50S субъединицы от рибосомы после терминации.Определенные здесь кинетические параметры () количественно иллюстрируют эту проблему, поскольку высокая скорость ассоциации RF класса I с рибосомой после терминации предполагает, что RF класса I почти всегда связан с предотвращением разборки субъединицы, когда присутствует в клеточных концентрациях (> 1 мкМ) ( Адамски и др., 1994).
RRF изменяет конформационное равновесие посттерминационной 70S рибосомы в пользу рециклинга. RRF связывается в повернутом состоянии, чтобы предотвратить RF-индуцированное ингибирование разборки субъединицы.Перекрывающиеся сайты связывания RF класса I и RRF в сайте A позволяют RRF напрямую конкурировать с RF-индуцированным образованием невращенного состояния, тем самым способствуя диссоциации 50S-субъединицы из повернутого состояния. Конкуренция между этими факторами была отмечена в прошлых биохимических экспериментах (Павлов и др., 1997), но наши результаты проясняют ее механистическое значение.
Последняя ключевая роль RRF заключается в формировании правильного субстрата на рибосоме для EF-G, который катализирует диссоциацию субъединицы посредством гидролиза GTP.Наши результаты экспериментов с EF-G дикого типа и Cy5-EF-G согласуются с моделью, согласно которой EF-G может связываться как с RRF-связанными, так и с RRF-свободными рибосомами 70S (Seo et al., 2004), но только связывание EF-G с комплексом RRF-70S приводит к успешной разборке субъединицы. Этот механизм последовательного связывания был предложен недавно (Borg et al., 2016). Это состояние 70S после прекращения, связанное как с RRF, так и с EF-G, было недавно структурно разрешено с помощью Cryo-EM с временным разрешением (Fu et al., 2016). По сравнению с транслокацией эффективность рециклинга EF-G низкая при низких концентрациях RRF, что приводит к бесполезным событиям связывания EF-G без расщепления субъединицы.При высоких концентрациях EF-G эти бесполезные события связывания EF-G превосходят связывание RRF, что приводит к значительному замедлению процесса рециркуляции. В результате важно, чтобы RRF присутствовал в клетке в высоких концентрациях, чтобы связываться с рибосомой до EF-G, чтобы достичь эффективного расщепления посттерминационного комплекса.
IF3 необходим для обеспечения необратимости рециклинга за счет ускорения диссоциации тРНК P-участка от 30S-субъединицы. В отсутствие IF3 наблюдались субъединица 50S и повторное связывание RF.Таким образом, мы подтвердили, что разборка субъединицы обратима и тРНК P-сайта все еще связана с 30S субъединицей после отрыва 50S субъединицы. Диссоциация тРНК P-сайта от 30S-субъединицы вместо этого ускоряется IF3 после диссоциации 50S-субъединицы. Отход тРНК оставляет нестабильный комплекс 30S-мРНК, который спонтанно распадается. Отслеживание событий во время утилизации в реальном времени дало однозначное описание шагов на пути утилизации (,).
Полная модель рециклинга рибосомПромежуточное звено 70S в повернутом состоянии после терминации является субстратом для RRF и EF-G, чтобы связывать и катализировать разборку субъединиц.Хотя EF-G может связываться как с RRF-свободным, так и с RRF-связанным комплексом 70S, RRF и EF-G должны связываться последовательно, чтобы катализировать разборку субъединицы. После диссоциации 50S-субъединицы IF3 связывается с оставшимся 30S-комплексом, чтобы вызвать диссоциацию тРНК P-участка с последующей спонтанной диссоциацией 30S-субъединицы от мРНК. Числовые значения кинетических параметров здесь представлены в
Таблица 1
Кинетические параметры завершения и рециклинга, измеренные в этом исследовании
| Скорость константа | Определение | Значение |
|---|---|---|
| k , на | Скорость ассоциации RF2 с пре-терминирующим комплексом 70S | 15.6 ± 1,0 мкМ −1 с −1 |
| k postRF, на | Скорость ассоциации RF2 с комплексом 70S после терминации | 2,8 ± 0,2 мкМ −1 с −1 |
| k RF, выкл. | Скорость диссоциации RF2 из комплекса 70S после терминации | 0,157 ± 0,038 с −1 |
| k 50S, выкл. | 0.022 ± 0,001 с −1 | |
| k 50S, на | Скорость повторного связывания субъединицы 50S с комплексом 30S | 0,75 ± 0,07 мкМ −1 с −1 |
| 3 G | Скорость ассоциации EF-G с комплексом 70S после терминации без RRF | 18,6 ± 0,8 мкМ -1 с -1 |
| k G2 | Скорость ассоциации EF-G с RRF-связью пост-терминальный комплекс 70S | 2.10 ± 0,09 мкМ −1 с −1 |
| k 30S | Скорость диссоциации 30S субъединицы от мРНК | 0,514 ± 0,017 с −1 |
путем отслеживания состояния рибо и рециклинг в реальном времени, мы раскрыли механизм рециклинга рибосом. Наши данные не согласуются с первой моделью рециклинга, которая утверждает, что RRF и EF-G расщепляют субъединицы посредством механизма, подобного транслокации, который сначала диссоциирует тРНК P-сайта (Hirokawa et al., 2005). Вместо этого у нас есть прямые доказательства, которые показывают, что тРНК отходит только под действием IF3 после диссоциации субъединицы 50S с помощью RRF и EF-G. Эти находки подтверждают вторую модель рециклинга, согласно которой IF3 необходим для разборки комплекса 30S путем индукции диссоциации тРНК (Karimi et al., 1999).
Таким образом, мы описали анализ in vitro , который может отслеживать все четыре стадии трансляции в режиме реального времени. Предыдущие подходы к объемной кинетике ограничивались отдельными этапами обрыва или рециркуляции изолированно, однако эти процессы перемешаны и, следовательно, должны изучаться вместе.Наш анализ трансляции одной молекулы очертил конформационную динамику рибосом, вводимую во время терминации, и показал, как эта динамика настраивается посредством взаимодействий как с факторами терминации, так и с факторами рециклирования, чтобы контролировать прогрессирование от терминации к рециклингу через промежуточное соединение в повернутом состоянии. Эти эксперименты с временным разрешением также определили время ключевых молекулярных событий рециклинга рибосом и связали их с ролью белковых факторов. Выяснив взаимодействие между конформацией рибосом и связыванием факторов во время терминации и рециклинга, мы получили механистическое понимание фундаментальных аспектов контроля трансляции.
Экспериментальные процедуры
Реагенты и буферы для экспериментов с одной молекулой
Приготовление рибосом Escherichia coli , факторов трансляции (IF2, EF-Tu, EF-G, EF-Ts), тРНК и биотинилированных мРНК описаны в Приложении. Экспериментальные процедуры.
RF1, RF2, RRF и IF3 дикого типа были очищены путем сверхэкспрессии в клетках E. coli BL21 (DE3), трансформированных векторами pET-24b (EMD Millipore), содержащими соответствующий ген из E.coli MG1655 K12 с последующей аффинной меткой на С-конце из шести гистидинов (6 × His). Клетки лизировали с помощью обработки ультразвуком, и осветленный центрифугированием лизат загружали в колонку HiTrap Ni 2+ объемом 5 мл (GE Healthcare). Фракции, содержащие белок, объединяли и очищали на колонке для исключения размера (Superdex 200 26/60, GE Healthcare). Очистка Cy5-меченных RF1 и RF2 описана в дополнительных экспериментальных процедурах.
Все эксперименты с одной молекулой проводились в полимикс-буфере на основе Триса, состоящем из 50 мМ трис-ацетата (pH 7.5), 100 мМ хлорид калия, 5 мМ ацетат аммония, 0,5 мМ ацетат кальция, 5 мМ ацетат магния, 0,5 мМ ЭДТА, 5 мМ путресцин-HCl и 1 мМ спермидин. Приготовление реакционных смесей для различных экспериментов с одной молекулой подробно описано в дополнительных экспериментальных процедурах.
Приборы RS и анализ данных
Эксперименты с FRET между отдельными молекулами и факторами занятости были проведены с использованием коммерческого секвенатора PacBio RS, который был модифицирован таким образом, чтобы позволять собирать интенсивности флуоресценции одиночных молекул из отдельных лунок ZMW диаметром около 130 нм в 4 раза. разные каналы красителя, соответствующие Cy3, Cy3.5, Cy5 и Cy5.5 флуоресценции. Секвенсор RS имеет два лазера для возбуждения красителя на длине волны 532 нм и 632 нм. Во всех экспериментах Cy5-RF1, Cy5-RF2 и Cy5-EF-G-GDPNP данные собирались со скоростью 10 кадров в секунду (время экспозиции 100 мс) в течение 5 минут с использованием настроек потока энергии зеленого лазера на 0,60 мВт / мм 2 и красный лазер при 0,10 мВт / мм 2 . Для всех экспериментов Cy5-EF-G-GTP, чтобы лучше визуализировать наблюдаемые короткие импульсы Cy5 в экспериментах Cy5-EF-G-GTP, частота кадров этих экспериментов была увеличена до 30 кадров в секунду.Таким образом, во всех экспериментах Cy5-EF-G-GTP данные собирались со скоростью 30 кадров в секунду (время экспозиции 33 мс) в течение 5 минут с использованием настроек потока энергии зеленого лазера на 0,72 мВт / мм 2 и красного лазера. при 0,24 мВт / мм 2 . Для инструментов TIRFM и анализа данных см. Дополнительные экспериментальные процедуры.
Анализ данных для всех экспериментов проводился с использованием скриптов MATLAB (MathWorks), написанных собственными силами (Chen et al., 2014). Вкратце, следы либо из лунок ZMW, либо из иммобилизованных комплексов на предметном стекле TIRFM были автоматически выбраны на основе интенсивности флуоресценции, времени жизни флуоресценции и изменений интенсивности.Отфильтрованные следы, показывающие межсубъединичный FRET или сигналы связывания одной молекулы, затем вручную обрабатывали для дальнейшего анализа данных. Состояния занятости FRET и лиганда были назначены, как описано ранее (Chen et al., 2013), на основе подхода, основанного на скрытой марковской модели, и скорректированы визуально. Кинетика переходов состояний была количественно оценена путем измерения времени пребывания состояний. Ансамблевое распределение этих времен выдержки в виде графиков кумулятивного распределения было подогнано к единичным показателям для получения констант скорости первого порядка (с использованием инструмента аппроксимации кривой на MATLAB).Бимолекулярные константы скорости событий связывания лиганда определяли путем измерения наклона линейной аппроксимации для построения констант скорости первого порядка как функции концентрации лиганда.
Основные моменты
Высвобождение пептида из рибосомы дает промежуточное звено повернутого состояния после терминации
RRF связывается с этим промежуточным продуктом, чтобы блокировать события повторного связывания RF вне пути
EF-G связывается с RRF-связанным повернутая рибосома катализирует диссоциацию 50S-субъединицы
IF3 связывается с оставшимся комплексом 30S, чтобы удалить тРНК P-сайта для полной разборки
Благодарности
Эта работа была поддержана U.S. NIH предоставляет GM51266 и GM099687 J.D.P., а также учебный грант NIH по молекулярной биофизике (T32-GM008294) и Стэнфордскую междисциплинарную стипендию для аспирантов А. Прабхакару.
Сноски
Заявление издателя: Это PDF-файл неотредактированной рукописи, принятой к публикации. В качестве услуги для наших клиентов мы предоставляем эту раннюю версию рукописи. Рукопись будет подвергнута копирайтингу, верстке и проверке полученного доказательства, прежде чем она будет опубликована в окончательной форме для цитирования.Обратите внимание, что во время производственного процесса могут быть обнаружены ошибки, которые могут повлиять на содержание, и все юридические оговорки, относящиеся к журналу, имеют отношение.
Дополнительная информация
Дополнительная информация включает дополнительные экспериментальные процедуры, семь цифр и одну таблицу.
Вклад авторов
А. Прабхакар и J.D.P. задумал и спланировал эксперименты. А. Прабхакар провел все эксперименты и анализ данных.А. Прабхакар интерпретировал данные. А. Петров и Дж. К. помогали в приготовлении реагентов. А. Прабхакар и M.C.C. написал рукопись при участии А. Петрова, J.C. и J.D.P.Ссылки
- Adamski FM, McCaughan KK, Jorgensen F, Kurland CG, Tate WP. Концентрация факторов высвобождения полипептидной цепи 1 и 2 при различных скоростях роста Escherichia coli. J Mol Biol. 1994; 238: 302–308. [PubMed] [Google Scholar]
- Agirrezabala X, Lei J, Brunelle JL, Ortiz-Meoz RF, Green R, Frank J.Визуализация гибридного состояния связывания тРНК, вызванного спонтанным храповым механизмом рибосомы. Молекулярная клетка. 2008. 32: 190–197. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Aitken CE, Puglisi JD. После межсубъединичной конформации рибосомы во время трансляции в реальном времени. Структурная и молекулярная биология природы. 2010; 17: 793–800. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Blanchard SC, Kim HD, Gonzalez RL, Jr, Puglisi JD, Chu S. Динамика тРНК на рибосоме во время трансляции.Труды Национальной академии наук Соединенных Штатов Америки. 2004; 101: 12893–12898. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Борг А., Павлов М., Эренберг М. Полный кинетический механизм рециклинга бактериальной рибосомы. РНК. 2016; 22: 10–21. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Chen C, Stevens B., Kaur J, Cabral D, Liu H, Wang Y, Zhang H, Rosenblum G, Smilansky Z, Goldman YE, et al. Одномолекулярные флуоресцентные измерения динамики рибосомной транслокации.Молекулярная клетка. 2011; 42: 367–377. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Чен Дж., Далал Р.В., Петров А.Н., Цай А., О’Лири С.Е., Чапин К., Ченг Дж., Эван М., Сюн П.Л., Лундквист П. и др. Платформа с высокой пропускной способностью для мониторинга биологических процессов в реальном времени с помощью многоцветной флуоресценции одиночных молекул. Труды Национальной академии наук Соединенных Штатов Америки. 2014; 111: 664–669. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Chen J, Petrov A, Tsai A, O’Leary SE, Puglisi JD.Скоординированная конформационная и композиционная динамика управляет транслокацией рибосом. Структурная и молекулярная биология природы. 2013; 20: 718–727. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Chen J, Tsai A, Petrov A, Puglisi JD. Нефлуоресцентные тушители для корреляции конформационной и композиционной динамики одиночных молекул. J Am Chem Soc. 2012; 134: 5734–5737. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Корниш П.В., Ермоленко Д.Н., Ноллер Х.Ф., Ха Т. Спонтанное межсубъединичное вращение в одиночных рибосомах.Молекулярная клетка. 2008. 30: 578–588. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Dorywalska M, Blanchard SC, Gonzalez RL, Kim HD, Chu S, Puglisi JD. Сайт-специфическая маркировка рибосомы для спектроскопии одиночных молекул. Nucleic Acids Res. 2005. 33: 182–189. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Дункл Дж. А., Ван Л., Фельдман МБ, Пулк А., Чен В. Б., Капрал Дж. Дж., Ноэске Дж., Ричардсон Дж. С., Бланшар СК, Кейт Дж. Х. Структуры бактериальной рибосомы в классическом и гибридном состояниях связывания тРНК.Наука. 2011; 332: 981–984. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ермоленко Д.Н., Маджумдар З.К., Хикерсон Р.П., Spiegel PC, Клегг Р.М., Ноллер Х.Ф. Наблюдение межсубъединичного движения рибосомы в растворе с помощью FRET. J Mol Biol. 2007; 370: 530–540. [PubMed] [Google Scholar]
- Fei J, Kosuri P, MacDougall DD, Gonzalez RL., Jr. Сцепление стебля рибосомы L1 и динамики тРНК во время удлинения трансляции. Молекулярная клетка. 2008. 30: 348–359. [PubMed] [Google Scholar]
- Фрэнк Дж., Агравал РК.Храповидная межсубъединичная реорганизация рибосомы во время транслокации. Природа. 2000. 406: 318–322. [PubMed] [Google Scholar]
- Freistroffer DV, Pavlov MY, MacDougall J, Buckingham RH, Ehrenberg M. Фактор высвобождения RF3 в E.coli ускоряет диссоциацию факторов высвобождения RF1 и RF2 из рибосомы GTP-зависимым образом. Журнал EMBO. 1997. 16: 4126–4133. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Фролова Л.Ю., Цивковский Р.Ю., Сиволобова Г.Ф., Опарина Н.Ю., Серпинский О.И., Блинов В.М., Татков С.И., Киселев Л.Л.Мутации в высококонсервативном мотиве GGQ факторов высвобождения полипептида класса 1 отменяют способность человеческого eRF1 запускать гидролиз пептидил-тРНК. РНК. 1999; 5: 1014–1020. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Fu Z, Kaledhonkar S, Borg A, Sun M, Chen B, Grassucci RA, Ehrenberg M, Frank J. Ключевые промежуточные соединения в рециркуляции рибосом, визуализированные с помощью криоэлектронной микроскопии с временным разрешением . Структура 2016 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Гао Х, Чжоу З, Рават Ю., Хуанг С., Буаказ Л., Ван С., Ченг З., Лю Й., Завьялов А., Гурски Р. и др.RF3 индуцирует конформационные изменения рибосом, ответственные за диссоциацию факторов высвобождения класса I. Клетка. 2007; 129: 929–941. [PubMed] [Google Scholar]
- Гао Н., Завьялов А.В., Ли В., Сенгупта Дж., Валле М., Гурски Р.П., Эренберг М., Фрэнк Дж. Механизм разборки посттерминационного комплекса, выведенный из крио-ЭМ исследований. Молекулярная клетка. 2005. 18: 663–674. [PubMed] [Google Scholar]
- Grentzmann G, Brechemier-Baey D, Heurgue V, Mora L, Buckingham RH. Локализация и характеристика гена, кодирующего фактор высвобождения RF3, в Escherichia coli.Труды Национальной академии наук Соединенных Штатов Америки. 1994; 91: 5848–5852. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Хетрик Б., Ли К., Джозеф С. Кинетика распознавания стоп-кодонов по фактору высвобождения 1. Биохимия. 2009. 48: 11178–11184. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Hirokawa G, Nijman RM, Raj VS, Kaji H, Igarashi K, Kaji A. Роль фактора рециклинга рибосом в диссоциации 70S рибосом на субъединицы. РНК. 2005; 11: 1317–1328.[Бесплатная статья PMC] [PubMed] [Google Scholar]
- Джин Х., Келли А.С., Рамакришнан В. Кристаллическая структура гибридного состояния рибосомы в комплексе с фактором высвобождения гуанозинтрифосфатазы 3. Труды Национальной академии наук Соединенные Штаты Америки. 2011; 108: 15798–15803. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Джулиан П., Коневега А.Л., Шерес С.Х., Лазаро М., Гил Д., Винтермейер В., Роднина М.В., Валле М. Структура рибосом с трещоткой и тРНК в гибридных состояниях.Труды Национальной академии наук Соединенных Штатов Америки. 2008; 105: 16924–16927. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Карими Р., Павлов М.Ю., Бэкингем Р.Х., Эренберг М. Новые роли классических факторов на стыке между завершением перевода и инициацией. Молекулярная клетка. 1999; 3: 601–609. [PubMed] [Google Scholar]
- Коростелев А., Асахара Х., Ланкастер Л., Лаурберг М., Хирши А., Чжу Дж., Траханов С., Скотт В. Г., Ноллер Х. Ф. Кристаллическая структура комплекса терминации трансляции, сформированная с фактором релиза RF2.Труды Национальной академии наук Соединенных Штатов Америки. 2008; 105: 19684–19689. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Koutmou KS, McDonald ME, Brunelle JL, Green R. RF3: GTP способствует быстрой диссоциации фактора терминации класса 1. РНК. 2014. 20: 609–620. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Лаурберг М., Асахара Х., Коростелев А., Чжу Дж., Траханов С., Ноллер Х. Ф. Структурная основа терминации трансляции на 70S рибосоме. Природа.2008. 454: 852–857. [PubMed] [Google Scholar]
- Лю К., Фредрик К. Межсубъединичные мосты бактериальной рибосомы. J Mol Biol. 2016; 428: 2146–2164. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Маргус Т., Ремм М., Тенсон Т. Филогенетическое распределение трансляционных ГТФаз в бактериях. BMC Genomics. 2007; 8:15. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Marshall RA, Aitken CE, Puglisi JD. Гидролиз GTP с помощью IF2 направляет прогрессирование рибосомы в элонгацию. Молекулярная клетка.2009; 35: 37–47. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Marshall RA, Dorywalska M, Puglisi JD. Необратимые химические шаги контролируют межсубъединичную динамику во время трансляции. Труды Национальной академии наук Соединенных Штатов Америки. 2008; 105: 15364–15369. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Макдональд М.Э., Грин Р. Еще одна струя дыма: структуры с атомным разрешением RF3, связанные с рибосомой. РНК. 2012; 18: 605–609. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Мунро Дж. Б., Альтман Р. Б., Тунг С. С., Кейт Дж. Х., Санбонмацу Канзас, Бланшар, Южная Каролина.Спонтанное образование разблокированного состояния рибосомы — это многоступенчатый процесс. Труды Национальной академии наук Соединенных Штатов Америки. 2010; 107: 709–714. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- О’Коннор М. Взаимодействие фактора выпуска RF3 с механизмом перевода. Mol Genet Genomics. 2015; 290: 1335–1344. [PubMed] [Google Scholar]
- Павлов М.Ю., Фрайстрофер Д.В., Хеург-Хамард В., Бакингем Р.Х., Эренберг М. Фактор высвобождения RF3 устраняет конкуренцию между фактором высвобождения RF1 и фактором рециклинга рибосом (RRF) за сайт связывания рибосомы.J Mol Biol. 1997; 273: 389–401. [PubMed] [Google Scholar]
- Песке Ф., Кухленкеттер С., Роднина М. В., Винтермейер В. Сроки связывания и гидролиза GTP с помощью фактора терминации трансляции RF3. Nucleic Acids Res. 2014; 42: 1812–1820. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Песке Ф., Роднина М.В., Винтермейер В. Последовательность шагов в рециклинге рибосом, определенная с помощью кинетического анализа. Молекулярная клетка. 2005. 18: 403–412. [PubMed] [Google Scholar]
- Петров А., Чен Дж., О’Лири С., Цай А., Пуглиси Дж. Д.Одномолекулярный анализ поступательной динамики. Перспективы Колд-Спринг-Харбор в биологии. 2012; 4: a011551. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Seo HS, Kiel M, Pan D, Raj VS, Kaji A, Cooperman BS. Кинетика и термодинамика взаимодействия RRF, EF-G и тиострептона на рибосоме Escherichia coli. Биохимия. 2004. 43: 12728–12740. [PubMed] [Google Scholar]
- Ши X, Джозеф С. Механизм прекращения трансляции: диссоциация RF1 следует за диссоциацией RF3 из рибосомы.Биохимия, 2016 [PubMed] [Google Scholar]
- Sternberg SH, Fei J, Prywes N, McGrath KA, Gonzalez RL., Jr. Факторы трансляции управляют внутренней динамикой рибосом во время завершения трансляции и рециклинга рибосом. Структурная и молекулярная биология природы. 2009. 16: 861–868. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Валле М., Завьялов А., Сенгупта Дж., Рават У., Эренберг М., Фрэнк Дж. Блокировка и разблокировка движений рибосом. Клетка. 2003. 114: 123–134. [PubMed] [Google Scholar]
- Weixlbaumer A, Jin H, Neubauer C, Voorhees RM, Petry S, Kelley AC, Ramakrishnan V.Понимание терминации трансляции из структуры RF2, связанной с рибосомой. Наука. 2008. 322: 953–956. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Янгман Е.М., Макдональд М.Э., Грин Р. Высвобождение пептидов на рибосомах: механизм и значение для контроля трансляции. Annu Rev Microbiol. 2008. 62: 353–373. [PubMed] [Google Scholar]
- Юсупов М.М., Юсупова Г.З., Бауком А., Либерман К., Эрнест Т.Н., Кейт Дж.Х., Ноллер Х.Ф. Кристаллическая структура рибосомы при разрешении 5,5 А.Наука. 2001; 292: 883–896. [PubMed] [Google Scholar]
- Завьялов А.В., Хаурылюк В.В., Эренберг М. Расщепление посттерминационной рибосомы на субъединицы согласованным действием RRF и EF-G. Молекулярная клетка. 2005. 18: 675–686. [PubMed] [Google Scholar]
- Завьялов А.В., Мора Л., Бакингем Р.Х., Эренберг М. Высвобождение пептида, стимулированное мотивом GGQ факторов высвобождения класса 1, регулирует активность GTPase RF3. Молекулярная клетка. 2002; 10: 789–798. [PubMed] [Google Scholar]
- Чжоу Дж., Ланкастер Л., Траханов С., Ноллер Х.Ф.Кристаллическая структура фактора высвобождения RF3, захваченная в состоянии GTP на повернутой конформации рибосомы. РНК. 2012; 18: 230–240. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Фактор восстановления остановившихся рибосом Pth4 необходим для митохондриальной трансляции антибиотиков у Saccharomyces cerevisiae
Потеря
PTh5 и PTh4 приводит к синтетическому дефекту дыхания. умеренный тепловой стрессДля оценки функций S.cerevisiae ICT1 и гомологи C12orf65, белки Pth5 и Pth4, соответственно, мы сконструировали мутанты с делецией одного гена S. cerevisiae , pth5 Δ и pth4 Δ, а также мутант с делецией двух генов, pth5Δ. pth4∆ . Каждый ген был удален путем замены его ORF модулем HIS3MX , ауксотрофным маркером, который дополняет his- , вместо любых маркеров антибиотиков, таких как KanMX6 , поскольку антибиотики использовались в качестве ингибиторов трансляции в экспериментах, как описано ниже. .Мы исследовали рост этих мутантов, используя анализ пятна разбавления на чашках с агаром YPG, содержащим глицерин в качестве неферментируемого источника углерода. Рост S. cerevisiae в среде YPG требует дыхания и, таким образом, экспрессии митохондриальных генов. При 30 ° C одинарные мутанты pth5 Δ и pth4 Δ росли аналогично дикому типу, в то время как двойной мутант pth5 ∆ pth4∆ рос немного медленнее, чем дикий тип (рис. 1а). Эти результаты показали, что ни Pth5, ни Pth4 не являются необходимыми для респираторного роста на среде YPG в стандартных лабораторных условиях.При 37 ° C, как наблюдали при 30 ° C, одиночные мутанты pth5 Δ и pth4 Δ росли так же, как и дикий тип в среде YPG, тогда как двойной мутант pth5∆pth4∆ оказался летальным в среде YPG. YPG, но жизнеспособен в глюкозосодержащих средах (YPD) (рис. 1а). Эти результаты показали синтетическое летальное взаимодействие или отрицательное генетическое взаимодействие между PTh5 и PTh4 , что указывает на то, что Pth5 и Pth4 имеют перекрывающиеся функции в митохондриях.
Фиг.1: Чувствительность PTh5- и / или PTh4 -дефицитных мутантов S. cerevisiae к температуре и антибиотикам.a Дикий тип (WT), pth5 Δ, pth4 Δ и pth5Δpth4Δ были серийно разведены и затем нанесены на планшеты YPD и YPG, содержащие глюкозу и глицерин в качестве источника углерода, соответственно. . Планшеты инкубировали при 30 ° C или 37 ° C в течение указанных часов. Результаты всех анализов пятен в настоящем исследовании показаны для одного эксперимента, представляющего не менее трех независимых экспериментов. b Четыре штамма были серийно разведены, а затем нанесены на планшеты YPG, содержащие следующие антибиотики, с концентрацией, указанной в скобках (мкг / мл): тетрациклин (100), окситетрациклин (200), доксициклин (100), азитромицин (75). ), эритромицин (20), хлорамфеникол (1000), паромомицин (100), тобрамицин (100) и стрептомицин (1000). Планшеты инкубировали при 30 ° C в течение 48 ч (тетрациклин, окситетрациклин и доксициклин) или 72 ч (остальные). Соответствующие изображения клеток, выращенных на пластинах YPD в течение 24 ч, показаны на дополнительном рис.2.
Pth4 особенно необходим для респираторного роста в присутствии бактериостатических антибиотиков, связывающихся с рибосомами.
Чтобы выяснить, участвуют ли Pth5 и Pth4 в спасении застопорившихся миторибосом, связанных с антибиотиками, мы исследовали влияние на рост pth5. Мутанты Δ, pth4, Δ и pth5Δpth4Δ на чашках YPG, содержащих различные типы антибиотиков. Среди антибиотиков, которые связываются с бактериальными рибосомами, мы выбрали девять, которые, как сообщалось, ингибируют синтез митохондриального белка у дрожжей и / или людей (дополнительная таблица 1).Первоначально мы подтвердили, что ни один из антибиотиков в указанных концентрациях не оказывал каких-либо явных эффектов на рост дикого типа или мутантов на пластинах YPD, рост которых не требует экспрессии митохондриальных генов для дыхания (дополнительный рис. 2). Кроме того, мы установили адекватные концентрации каждого антибиотика, необходимые для уточнения различий в росте (дополнительный рис. 3).
Точечные анализы на чашках YPG показали, что все антибиотики нарушали рост мутантов в большей степени, чем дикого типа (рис.1б). Сравнение роста мутантов среди протестированных антибиотиков выявило две модели ингибирующего воздействия на рост, которые зависели от свойств антибиотиков, а именно, бактериостатические или бактерицидные, а не механизмы, с помощью которых каждый антибиотик задерживает рибосомы. В присутствии бактериостатических антибиотиков (тетрациклина (Tc), окситетрациклина, доксициклина, азитромицина и эритромицина) наблюдались различия во влиянии на рост между тремя мутантами. Порядок уменьшения скорости роста выглядит так: pth5∆pth4∆ > pth4∆ > pth5∆ .Что касается хлорамфеникола, то наблюдалась небольшая разница во влиянии на рост между pth5 Δ и диким типом. Эти результаты показали, что Pth4 и, в меньшей степени, Pth5 необходимы для респираторного роста на пластинах YPG в присутствии бактериостатических антибиотиков.
Напротив, в присутствии бактерицидных антибиотиков (паромомицин, тобрамицин и стрептомицин) делеция PTh5 , PTh4 или обоих в равной степени в значительной степени нарушала рост клеток (рис.1б). Эти результаты показали, что Pth5 и Pth4 оба участвуют в эффективном респираторном росте в присутствии бактерицидных антибиотиков.
Однако недавние эксперименты с использованием бактерий показали, что бактерицидные антибиотики, независимо от их механизмов действия, вызывают гибель клеток по общему механизму, включающему образование очень вредных гидроксильных радикалов 31,32 . В клетках млекопитающих подобные бактерицидные антибиотики также вызывают перепроизводство активных форм кислорода (АФК) и митохондриальную дисфункцию, что приводит к окислительному повреждению ДНК, белков и липидов мембран 33 .Таким образом, при использовании клеток, выращенных в присутствии бактерицидных антибиотиков, возникнут трудности с оценкой надлежащих функций двух белков как фактора спасения застопорившихся рибосом в митохондриях. В последующих экспериментах мы использовали бактериостатические антибиотики, которые ингибируют митохондриальную трансляцию, что замедляет рост клеток.
Фенотип чувствительности к антибиотикам мутанта
pth5∆pth4∆ может быть полностью подавлен плазмидным PTh4 , но не PTh5Чтобы подтвердить особую роль Pth4 в респираторном росте в присутствии антибиотиков, мы исследовали, дополняется ли фенотип тяжелого медленного роста мутанта с делецией двойного гена плазмидной экспрессией PTh5 или PTh4 .Мы трансформировали мутант pth5∆pth4∆ производным плазмиды pRS316, содержащей ORF PTh5 или PTh4 , фланкированных нативным промотором и терминатором, названными pPTh5 и pPTh4, соответственно. Поскольку pRS316 является вектором YCp (дрожжевой центромерной плазмидой) и, таким образом, число копий по существу равно одной на клетку, предполагалось, что уровень экспрессии белка целевого гена в трансформированной клетке практически идентичен таковому в нетрансформированной клетке дикого типа. клетка.Эта плазмида также несет URA3 в качестве гена ауксотрофного маркера. В отсутствие антибиотиков точечный анализ на пластинах с синтетической средой, не содержащих урацила и содержащих 3% глицерина (SG-ura), показал, что фенотип медленного роста мутанта с делецией двойного гена хорошо дополняется либо плазмидным PTh5 . или ген PTh4 (рис. 2 и дополнительный рис. 4а). Этот результат показал, что в стандартных лабораторных условиях один из Pth5 и Pth4 может независимо спасти проблемные миторибосомы.
Рис. 2: Подавление фенотипа чувствительности к антибиотикам мутанта с двойной делецией гена с помощью плазмидного PTh4 или PTh5 .Мутант pth5∆pth4∆ (обозначенный ∆∆) был трансформирован плазмидой pRS316, несущей геномную область, включающую PTh5 и PTh4, названную pPTh5 и pPTh4, и полученные штаммы были обозначены как ∆∆ + pPTh5 и ∆∆ + pPTh4 соответственно. Каждый штамм разводили и наносили на планшеты SG-ura, не содержащие антибиотика, 100 мкг / мл тетрациклина, 1000 мкг / мл хлорамфеникола или 75 мкг / мл азитромицина.В качестве контроля pth5∆pth4∆ , а также клетки дикого типа трансформировали пустой плазмидой pRS316. Кроме того, pth5∆pth4∆ трансформировали плазмидой, в которой остатки мотива GGQ были изменены на VAQ в pPTh5 и pPTh4, названных pPTh5 (VAQ) и pPTh4 (VAQ), соответственно. Соответствующие изображения клеток, выращенных на чашках SC-ura в течение 12 ч, показаны на дополнительном рис. 4а.
Мы исследовали, подавляется ли сильно повышенная чувствительность к Tc, хлорамфениколу или азитромицину, вызванная мутантом pth5∆pth4∆ , экспрессией PTh5 или PTh4 .Точечный анализ на планшетах SG-ura в присутствии каждого антибиотика продемонстрировал, что фенотип чувствительности к антибиотикам мутанта pth5∆pth4∆ полностью подавлялся переносимым плазмидой PTh4 , тогда как он подавлялся только частично переносимым плазмидой. ПТх5 (рис.2). Кроме того, чтобы проверить, улучшилась ли частичная супрессия за счет более повышенной экспрессии гена PTh5 , мы заменили нативный промотор сильным конститутивным промотором TEF1 в pPTh5 (дополнительный рис.4б). Однако это привело к снижению, а не увеличению эффективности подавления с использованием промотора TEF1, а не нативного промотора. Также было обнаружено, что сверхэкспрессия Pth4 значительно нарушает рост даже в отсутствие Tc (дополнительный рис. 4b). Возможно, что чрезмерное количество любого из srRF вызывает его неожиданное связывание с нормальными транслируемыми миторибосомами, предотвращая нормальное удлинение или завершение. Эти результаты показали, что Pth4 играет особую роль в устойчивости к антибиотикам, предполагая наличие специфического торможения миторибосом, вызванного антибиотиками, которое спасает только Pth4.
Наконец, чтобы подтвердить, что PTH-активности Pth5 и Pth4 непосредственно способствовали подавлению фенотипов чувствительности к антибиотикам мутанта pth5∆pth4∆ , мы ввели мутации в плазмиды, так что остатки мотивов GGQ были заменены на VAQ. Эти мутации снижали активность ПТГ YaeJ и ICT1 в трансляции in vitro, как описано ранее 9,34 . Точечный анализ показал, что ни один из фенотипов чувствительности к антибиотикам не подавлялся плазмидным мутантом PTh4 или PTh5 , имеющим остатки VAQ (рис.2). Эти результаты показали, что остатки мотива GGQ необходимы для функций Pth5 и Pth4, указывая на то, что Pth4 и Pth5 гидролизуют пептидил-тРНК на рибосомах in vivo с остатками мотива GGQ в качестве каталитического сайта.
Ненапряженным митохондриям требуется функционирование Pth5 и Pth4
Чтобы выяснить, оказывает ли делеция PTh5 или PTh4 какое-либо влияние на свойства митохондрий в отсутствие или в присутствии Tc, мы исследовали митохондриальную массу и мембранный потенциал мутанты с использованием проточной цитометрии (FCM).
Сначала каждый рост мутантов исследовали в жидкой среде YPG путем оценки оптической плотности при 600 нм в трех временных точках. В отсутствие Tc скорости роста были по существу одинаковыми между двумя мутантами с делецией одного гена и диким типом, в то время как небольшое снижение роста мутанта pth5∆pth4∆ по сравнению с мутантом дикого типа наблюдалось только. в фазе экспоненциального роста (рис. 3а и дополнительный рис. 5а). Эти результаты в основном соответствовали результатам точечного анализа на пластинах с твердым агаром.В присутствии Tc концентрацию в жидкой среде увеличивали до 500 мкг / мл, чтобы можно было прояснить различия в росте между мутантами и диким типом (дополнительный рис. 5b). Как наблюдалось в анализе пятна, рост мутанта pth4 Δ был медленнее, чем у мутанта дикого типа, тогда как рост мутанта pth5Δpth4Δ был серьезно нарушен (рис. 3a и дополнительный рис. 5a). Однако рост мутанта pth5 Δ был практически идентичен росту дикого типа.Этот результат отличался от результата, полученного с использованием планшетов YPG, содержащих Tc, на которых pth5 Δ росли медленнее, чем дикий тип. Таким образом, чувствительность Tc pth5 Δ оказывается менее заметной в жидкой среде.
Рис. 3. Влияние делеции PTh5 или PTh4 на свойства митохондрий.a Три мутанта и мутант дикого типа инокулировали в жидкую среду YPG в отсутствие или в присутствии 500 мкг / мл тетрациклина (Tc) с исходной OD 600 , равной 0.01. Рост контролировали путем измерения значений OD 600 в указанные моменты времени при 30 ° C. Данные представлены как среднее значение ± стандартное отклонение шести независимых экспериментов. Звездочки указывают на значительное отличие от дикого типа (t-критерий Стьюдента, * P <0,001 и ** P <0,01). b Масса митохондрий (слева) и мембранный потенциал (справа) у дикого типа (WT), pth5 Δ, pth4 Δ и pth5Δpth4Δ , выращенных в жидкой среде YPG в течение 48 часов, измеряли при при комнатной температуре (около 25 ° C) с помощью FCM с использованием MitoTracker Green FM и MitoTracker Red CMXRos, соответственно, в отсутствие или в присутствии 500 мкг / мл тетрациклина (Tc).
В анализе FCM измеряли митохондриальную массу и мембранный потенциал в клетках, выращенных в жидкой среде YPG в течение 48 часов, с использованием поглощения MitoTracker Green FM и Red CMXRos, соответственно. Поглощение первого красителя зависит от массы, но не от митохондриального потенциала, тогда как последний имеет противоположные характеристики. Относительно положения основного пика, наблюдаемого у дикого типа, сдвиги вправо при флуоресцентном обнаружении митохондриальной массы наблюдались у pth5 Δ и pth4 Δ, в то время как никаких заметных изменений в мембранном потенциале у трех мутантов не наблюдалось. (Инжир.3б). Эти результаты указывают на увеличение количества мутантных клеток, которые имеют большую митохондриальную массу с нормальным мембранным потенциалом по сравнению с клетками дикого типа. Это увеличение митохондриальной массы наблюдается при митохондриальных миопатиях и, как полагают, частично компенсирует сниженную функцию дыхательной цепи за счет поддержания общего производства АТФ 35,36 . Таким образом, предполагаемое снижение функции митохондрий у мутантов, по-видимому, дополнялось увеличением митохондриальной массы.Эти результаты предполагают, что отсутствие PTh5 или PTh4 создает стресс для митохондриальных функций даже в стандартных лабораторных условиях; иными словами, митохондрии, не подвергшиеся стрессу, требуют функционирования как Pth5, так и Pth4.
Кроме того, в присутствии Tc, FCM-анализ дрожжевых клеток, выращенных в течение 48 часов, показал незначительные различия в митохондриальной массе и мембранном потенциале между диким типом и мутантами (рис. 3b). Кроме того, анализ FCM с использованием чувствительного к окислению зонда 2 ’, 7’-дихлорфлуоресцеина диацетата (DCFH-DA) не показал существенных различий в накоплении ROS между мутантами и диким типом; однако наблюдалось небольшое увеличение по сравнению с отсутствием Tc (дополнительный рис.6а). Мы также исследовали, связано ли нарушение роста мутантов в присутствии Tc с остановкой роста или потерей жизнеспособности клеток. Мутанты выращивали в жидкой среде YPG, содержащей Tc, паромомицин или азитромицин, в течение 1 часа и промывали буфером PBS для удаления каждого антибиотика. Образцы наносили на чашки с YPG в отсутствие антибиотиков, показывая, что мутанты росли так же, как и мутанты дикого типа (дополнительный рис. 6b). В сочетании с результатами анализа FCM эти результаты предполагают, что антибиотики при каждой сублетальной концентрации останавливают рост клеток мутантов, а не снижают жизнеспособность клеток.
Взятые вместе, эти находки показывают, что Tc ингибирует мутант-специфическое увеличение митохондриальной массы, которое наблюдалось в нестрессовых условиях, и он не повреждает митохондриальные функции у мутантов в достаточной степени, чтобы активировать стрессовые реакции клеток. В последующих экспериментах использовали дрожжевые клетки, обладающие этими свойствами.
Экспрессия всех генов, кодирующих белок мтДНК, по-видимому, снижается только в
pth4 Δ в присутствии TcЧтобы изучить влияние делеции PTh5 или PTh4 на синтез белка мтДНК: Кодирующие гены в митохондриях, мы пометили продукты трансляции митохондрий в органеллах [ 35 S] метионином.В соответствии с результатами, полученными Meisinger et al. 37 , мы получили богатую митохондриями фракцию дикого типа и мутантов, выращенных в среде YPG в отсутствие или в присутствии Tc в течение 24 часов. Свежие митохондрии инкубировали 25 мин в присутствии [ 35 S] метионина. Митохондрии собирали центрифугированием, промывали и затем непосредственно анализировали с помощью SDS-PAGE. Гели были визуализированы с помощью рентгенографии на пластине (рис. 4а и дополнительный рис. 7а). Все восемь белков кодируются S.cerevisiae мтДНК были идентифицированы, как описано ранее 38,39,40 . В отсутствие Tc семь белковых продуктов были практически идентичными среди трех штаммов, хотя уровни Var1 были немного выше у pth4 Δ, чем у дикого типа или pth5 Δ (рис. 4a и дополнительный рис. 7b). Var1, который является единственным гидрофильным белком, служит компонентом небольшой рибосомной субъединицы миторибосом, а у многих других видов его гомологичные белки кодируются ядерной ДНК.Небольшое увеличение уровней Var1 может указывать на увеличение количества миторибосом.
Рис. 4. Влияние делеции PTh5 или PTh4 на трансляцию и транскрипцию митохондрий в отсутствие или в присутствии тетрациклина.a Продукты трансляции митохондрий, синтезированные в органеллах дикого типа (WT), pth5 Δ и pth4 Δ, выращенных в среде YPG в течение 24 часов в отсутствие или в присутствии 500 мкг / мл тетрациклина (Tc) .Свежие митохондрии, выделенные из каждого штамма, инкубировали с метионином [ 35 S] в буфере для трансляции. Лизаты митохондрий анализировали с помощью 16% SDS-PAGE и авторадиографии. Соответствующие гели, окрашенные кумасси синим, показаны на дополнительном рис. 7а. Количественное сравнение продуктов трансляции митохондрий показано на дополнительном рис. 7b. b данные кПЦР всех генов, кодирующих белок мтДНК, за исключением VAR1 , из общих РНК, экстрагированных из трех штаммов в отсутствие или в присутствии 500 мкг / мл Tc.Данные представлены как среднее значение ± стандартное отклонение пяти независимых экспериментов. Значения P показаны в таблицах. Не было статистически значимых различий между диким типом и каждым мутантом в отсутствие или в присутствии Tc (тест Стьюдента t , p > 0,1). Экспрессия мРНК VAR1 описана в тексте.
Напротив, в присутствии Tc все восемь белковых продуктов, по-видимому, были уменьшены только в pth4 Δ (рис.4a и дополнительный рис. 7b). Эти результаты в отсутствие или в присутствии Tc соответствовали результатам сравнения скоростей роста в жидкой среде YPG среди трех штаммов (рис. 3a). Поскольку Tc связывается с миторибосомами для ингибирования трансляции, эти результаты показали, что отсутствие Pth4, но не Pth5, предотвращает синтез митохондриального белка, предполагая, что Pth4 исключительно спасает миторибосомы, остановленные Tc. Однако нельзя исключить возможность того, что скорость восстановления белковых продуктов отличается от таковой in vivo.
Мы провели количественную ПЦР с обратной транскрипцией (qPCR), чтобы подтвердить, изменила ли делеция PTh5 или PTh4 уровни транскрипции генов, кодирующих белок мтДНК, в отсутствие и в присутствии Tc. Поскольку подходящие специфические праймеры не могли быть сконструированы для VAR1 , который имеет большое количество AT, были исследованы уровни мРНК семи генов. Поскольку VAR1 и ATP9, котранскрибируются в митохондриях из S.cerevisiae , изменения в экспрессии мРНК VAR1 , если когда-либо, могут зависеть от таковых в ATP9 . Что касается pth5 Δ и pth4 Δ, соотношение уровней мРНК мутантного и дикого типа всех генов находилось в диапазоне от 0,75 до 1,34 фактора в отсутствие Tc и в диапазоне 0,82–1,28 фактора в присутствии от Tc (рис. 4б). Эти результаты показали, что делеция любого гена мало влияет на экспрессию мРНК генов, кодирующих белок мтДНК. Кроме того, мы подтвердили, влияет ли Tc на экспрессию гена PTh5 или PTh4 у дикого типа.Не было обнаружено существенных изменений в экспрессии обоих генов (дополнительный рис. 7c).
Таким образом, эти результаты подтвердили, что значительное снижение белковых продуктов pth4 Δ в присутствии Tc в основном происходит на посттранскрипционном или трансляционном уровне.
Pth4 и Pth5 проявляют активность ПТГ в системе трансляции in vitro из
E. coliБыло показано, что человеческий гомолог Pth5, ICT1, проявляет активность ПТГ в отношении нон-стоп мРНК, аналогичную активности E.coli , гомолог YaeJ, с использованием системы бесклеточного синтеза белка, восстановленной из очищенных компонентов E. coli (PUREsystem) 11,14 . Мы исследовали, проявляют ли Pth4 и Pth5 активность ПТГ по отношению к этим остановившимся рибосомам, используя одну и ту же систему трансляции in vitro. Используя безостановочную матрицу, содержащую ген crp , лишенный стоп-кодона (дополнительный рис. 8a), в течение 15 минут проводили реакцию трансляции in vitro для получения застопорившихся рибосом с пептидил-тРНК (CRP-тРНК).К этим рибосомам добавляли различные концентрации рекомбинантного белка Pth5 или Pth4. Согласно предыдущим открытиям ICT1 и YaeJ 11 , His-метка была добавлена к C-концу Pth5, тогда как эта метка была добавлена к N-концу Pth4, потому что N-концевая метка не оказывала значительного влияния на активность PTH ( Дополнительный рис. 8b). Продукты трансляции in vitro анализировали с использованием системы электрофореза NuPAGE Bis-Tris. Продукты, флуоресцентно меченные тРНК Lys , заряженные флуоресцентно меченным лизином, были обнаружены и количественно определены с помощью ImageQuant LAS 4010 (рис.5а). Отношение интенсивностей полос высвобожденных пептидов к интенсивности полос пептидил-тРНК плюс интенсивности высвобожденных пептидов определяли как относительную активность ПТГ для остановившихся рибосом. Таким образом, 100% относительная активность указывает на то, что пептидил-тРНК на остановившихся рибосомах полностью гидролизованы.
Рис. 5: ПТГ-активности Pth5 и Pth4 по отношению к непрерывным или запретным рибосомам с использованием восстановленной системы трансляции на основе E. coli .a Трансляция in vitro нон-стоп матрицы с рекомбинантными His-меченными белками Pth5 и Pth4.Каждый рекомбинантный белок добавляли к раствору, в котором была проведена 15-минутная реакция трансляции in vitro с использованием непрерывных матриц. Полученную смесь, инкубированную в течение 5 минут, анализировали с помощью NuPAGE, как показано на левой панели. Каждый гель визуализировали с помощью лазерного флуоресцентного гелевого сканера. Высвобожденные пептиды и пептидил-тРНК указывают на белки Crp и Crp-тРНК соответственно. Конечная концентрация каждого рекомбинантного белка показана на каждой полосе. Звездочкой обозначена фоновая полоса (≈30 кДа), которая появляется без добавления матричной ДНК или мРНК, как ранее было показано в техническом примечании производителя.На правой панели показана степень гидролиза пептидил-тРНК (относительная активность ПТГ), выраженная как отношение интенсивности полосы высвобожденных пептидов к таковой для пептидил-тРНК плюс интенсивность высвобожденных пептидов при указанных концентрациях белка. Данные представлены как среднее значение ± стандартное отклонение трех независимых экспериментов. b Сравнение концентраций белков Pth5 и Pth4, необходимых для аналогичной активности ПТГ в отношении непрерывных или непроходимых рибосом. Каждая верхняя панель показывает схематический рисунок рибосомы, остановленной на непрерывной или непроходящей мРНК.На нижних панелях показано, что ≈60% активности ПТГ для непрерывных и запрещенных рибосом требуют указанных концентраций Pth5 или Pth4. Данные представлены как среднее значение ± стандартное отклонение пяти независимых экспериментов. Пример изображений геля показан на дополнительном рис. 8e.
На рис. 5a показана концентрационная зависимость активности PTH для Pth5, Pth4 для нон-стоп рибосом. Pth5 проявлял активность PTH на уровне, аналогичном ICT1 и YaeJ, как описано ранее 11 .Pth5, по-видимому, служит фактором спасения непрерывных рибосом в митохондриях S. cerevisiae . Кроме того, полученные результаты продемонстрировали, что Pth4 проявлял активность PTH в отношении нон-стоп мРНК, которая была более слабой, чем активность Pth5. Чтобы подтвердить, что остатки мотива GGQ Pth4 и Pth5 вносят вклад в активность PTH в этой гетерогенной системе трансляции, мы изменили остатки GGQ на VAQ с помощью сайт-направленного мутагенеза. Мутация в обоих мутантных белках привела к значительному снижению активности ПТГ, что продемонстрировало необходимость остатков GGQ для активности ПТГ (дополнительный рис.8c).
Pth4 демонстрирует аналогичный уровень активности ПТГ между non-stop и no-go рибосомами из
E. coliМы попытались проверить, спасает ли Pth4 или Pth5 непроходимые рибосомы, вызванные антибиотиком, с помощью системы трансляции in vitro. Однако антибиотик работает на разных участках интактной мРНК, так что он будет производить гетерогенные непроходимые рибосомы, что приводит к отсутствию дискретной полосы на геле. Вместо этого мы сконструировали матрицу ДНК, в которой за стоп-кодоном гена crp следовали 33 нуклеотида; мы назвали мРНК, полученную из шаблона no-go мРНК (дополнительный рис.8а). Поскольку RF не были включены в смесь для трансляции набора PURExpress ΔRF123, рибосомы застопорились на стоп-кодоне запретной мРНК. Согласно Feaga et al. 14 , канал входа мРНК рибосомы должен быть достаточно занят 33 нуклеотидами. Мы подтвердили, что полоса, указывающая на пептидил-тРНК на непроходимых рибосомах, не обнаруживалась при добавлении РФ к раствору (дополнительный рис. 8d).
Затем мы обнаружили, что ≈60% активности PTH для Pth5 для непрерывных и непереработанных рибосом требуется 0.2 мкМ и 1,5 мкМ соответственно (рис. 5б). Результат показал, что, как и ожидалось в экспериментах на ICT1 и YaeJ 14,27 , активность PTH 5 Pth5 была более слабой по отношению к запретным мРНК, чем к безостановочным мРНК. Напротив, ≈60% ПТГ-активности Pth4 для непрерывных и запрещенных рибосом требовали аналогичных концентраций (3,0 мкМ и 4,5 мкМ, соответственно). Эти результаты предполагают, что активность PTH4 не зависит от того, был ли канал входа мРНК занят мРНК, по крайней мере, при трансляции in vitro.
Человеческий SARS-CoV-2 эволюционировал, чтобы уменьшить динуклеотид CG в его открытых рамках считывания
Низкое содержание CG в SARS-CoV-2 человека
Последовательности ДНК или РНК состоят из четырех нуклеотидов, то есть аденилата (A), тимидилата (T), гуанилат (G) и цитидилат (C). Их также можно считать полимерами 16 динуклеотидов. Отношение шансов — это величина, определяющая относительное количество нуклеотида, которое представляет собой отношение наблюдаемой к ожидаемой частоте динуклеотида 10 .В геноме SARS-CoV-2 (29903 нуклеотида 2 , порядковый номер NC_045512) содержится 29,94% A, 32,08% T (T используется здесь вместо U для простоты), 19,61% G и 18,37% C. Таким образом, ожидаемая частота динуклеотида CG в вирусном геноме составляет 3,60% (т.е. 19,61% × 18,37%). Однако наблюдаются только 439 CG, что означает, что наблюдаемая частота динуклеотида CG составляет 1,47% (т.е. 439/29 902). Следовательно, отношение шансов ХГ в SARS-CoV-2 составляет 0,41 (т.е. 1,47% / 3,60%). Кроме того, отношение шансов CG в открытых рамках считывания (ORF) вируса равно 0.39, что является самым низким показателем среди 24 обследованных коронавирусов (рис. 1а и таблица S1). Поскольку кодон состоит из трех нуклеотидов, динуклеотид (например, CG) имеет три возможных местоположения. При этом они обозначены как (CG) 12 , (CG) 23 и (CG) 31 соответственно. Мы обнаружили, что отношение шансов (CG) 23 в ORF для SARS-CoV-2 составляет всего 0,25, в то время как для (CA) 23 и (CT) 23 оно составляет 1,54 и 1,92. соответственно (рис.1в). Более того, отношение шансов (CG) 31 в ORF для SARS-CoV-2 составляет 0,50, а для (AG) 31 и (TG) 31 составляет 1,52 и 2,64 соответственно (рис. 1d). Эти данные убедительно свидетельствуют о том, что (CG) 23 был мутирован в (CA) 23 и (CT) 23 , а (CG) 31 был мутирован в (AG) 31 и (TG) 31 .
Рисунок 1Отношения шансов динуклеотидов в открытых рамках считывания SARS-CoV-2.( a ) отношения шансов динуклеотидов во всех положениях кодона. ( b — d ) отношения шансов динуклеотидов в положениях кодона 1 и 2, 2 и 3, 3 и 1 соответственно. Значение, показанное на рисунке, представляет собой средневзвешенное отношение шансов каждого динуклеотида. Соотношение шансов для каждого динуклеотида в десяти ORF (т.е. ORF1ab и ORF 2–10) SARS-CoV-2 рассчитывается, соответственно, в первую очередь. Затем получается средневзвешенное отношение шансов на основе длины каждой ORF.
Вышеуказанные мутации возможны, потому что очень немногие из этих мутаций приводят к изменениям аминокислот.Чтобы быть конкретным, существует четыре кодона, содержащие (CG) 23 . Это TCG, CCG, ACG и GCG, которые кодируют серин, пролин, треонин и аланин соответственно. Мутация G в положении кодона 3 в T, C или A во всех из них не изменяет аминокислоту, которую они кодируют. Что касается (CG) 31 , имеется 16 кодонов, имеющих C в положении 3. Если этот C мутирован в T, все 16 кодонов имеют одинаковые значения. И если он мутирован в A, 9 из 16 кодонов все равно будут иметь то же значение. Таким образом, можно сделать вывод, что SARS-CoV-2 эволюционировал для снижения CG в ORF в основном за счет мутации его G из (CG) 23 и C из (CG) 31 в A и T.Среди них C-to-T (то есть C-to-U в РНК) встречается с очень высокой частотой, вероятно, потому, что это самый простой способ изменить нуклеотид (C становится U после дезаминирования). Кроме того, отношение шансов (CC) 23 намного ниже, чем у (CA) 23 и (CT) 23 (рис. 1c). Это не означает, что (CG) 23 не мутировал в (CC) 23 . Фактически, низкое отношение шансов (CC) 23 связано с высокой частотой мутации C-to-T в положении 3, т.е.из (CG) 31 в (TG) 31 (рис. 1d). Вышеупомянутые взгляды также подтверждаются предвзятостью использования кодонов в SARS-CoV-2 (рис. 2), которая показывает, что кодоны с A / T-концом используются гораздо чаще, чем их синонимичные кодоны с G / C-концом. Кроме того, все четыре кодона, содержащие (CG) 23 , имеют самый низкий процент использования среди соответствующих им синонимичных кодонов.
Рисунок 2Процент использования кодонов в открытых рамках считывания SARS-CoV-2. Использование синонимичных кодонов для восемнадцати аминокислот (кроме метионина и триптофана) и трех стоп-кодонов показано на рисунке.Процентные доли кодонов с A, T, G и C в позиции кодона 3 находятся на желтом, коричневом, зеленом и синем фоне соответственно. Общее количество кодонов для каждой аминокислоты указано вверху процентной полосы. Стрелки указывают четыре кодона, которые содержат CG в положениях 2 и 3.
Низкое содержание CG в других коронавирусах
Отношения шансов CG в ORF других коронавирусов также очень низкие (среднее значение = 0,50, рис. 3 и таблица S1). Это может иметь сильное влияние на репликацию вируса, потому что ORF коронавирусов немедленно транслируются рибосомами хозяина после того, как высвобождаются в цитоплазму хозяйских клеток 9 .На трансляцию вирусной РНК влияют два фактора. Во-первых, рибосомы-хозяева должны быть задействованы в 5′-UTR (нетранслируемой области) вирусной РНК для инициации трансляции. Другой заключается в том, что стержневые петли, образованные ORF вирусной РНК, должны быть разорваны, чтобы раскрыть кодирующую информацию во время трансляции. В отличие от ORF, 5′-UTR коронавирусов имеют довольно высокие отношения шансов CG (среднее значение = 0,84, таблица S2). Это способствовало бы формированию стабильной вторичной структуры, которая могла бы служить внутренним сайтом входа в рибосому (IRES) 11,12,13 для рибосомы хозяина (рис.4). Между тем, вирусная РНК, начинающаяся в сайте начала трансляции (TSS), образует относительно нестабильную вторичную структуру, потому что ее петли-стержни поддерживаются меньшим количеством водородных связей (пары оснований A-T и C-G имеют две и три водородные связи соответственно).
Рисунок 3Отношения шансов динуклеотидов в открытых рамках считывания коронавирусов и клеточных организмов. ( a ) отношения шансов динуклеотидов во всех положениях кодона. ( b — d ) отношения шансов динуклеотидов в положениях кодона 1 и 2, 2 и 3, 3 и 1 соответственно.Данные о коронавирусах взяты из Таблицы S1, которые показаны на синем фоне. Таковые из клеточных организмов взяты из нашей предыдущей работы 15 . Закрашенный треугольник или закрашенный инверторный треугольник указывает на то, что отношение шансов динуклеотида в коронавирусе значительно выше или ниже, чем у клеточных организмов на уровне p = 0,05. Открытый треугольник или открытый инверторный треугольник указывает на то, что отношение шансов динуклеотида в коронавирусе незначительно выше или ниже, чем у клеточных организмов.
Рисунок 4Вторичная структура, образованная 5′-UTR полиовируса ( a ) и SARS-CoV-2 ( b ). Вторичная структура основана на 200 нуклеотидах, расположенных непосредственно перед сайтом начала трансляции. Порядковый номер полиовируса MG212486. SARS-CoV-2 — NC_045512. Обе структуры и их свободная энергия (указанная в центре структуры) нарисованы / рассчитаны с использованием структуры РНК (версия 5.7) 27 .
Вариации стабильности вирусных геномов в 5′-UTR и TSS-to-end областях, вероятно, могут определять вирулентность различных вирусов, поскольку высокая стабильность структуры IRES означает высокую эффективность инициации трансляции и высокую стабильность TSS-to-end области означает высокий расход энергии при переводе.После того, как высокая, средняя и низкая стабильность областей 5′-UTR и TSS-to-end присвоены 3, 2 и 1 баллу соответственно, вирулентность коронавирусов может быть классифицирована по пяти степеням: очень высокая, высокая, средняя, низкая и очень низкий (таблица 1). Например, коронавирус человека MERS (ближневосточный респираторный синдром) имеет очень высокую вирулентность, поскольку его 5′-UTR и TSS-to-end области очень стабильны. Высокая стабильность 5′-UTR означает, что рибосомы хозяина могут быть задействованы для трансляции вирусной РНК с высокой скоростью.А высокая стабильность ORF означает, что больше энергии тратится на разрушение петель в вирусной РНК во время трансляции. Таким образом, нормальная трансляция мРНК клетки-хозяина сильно нарушается, что свидетельствует о высокой вирулентности коронавируса MERS. Коронавирус SARS (тяжелый острый респираторный синдром) обладает высокой вирулентностью, поскольку его 5′-UTR менее стабильны, чем коронавирус MERS. SARS-CoV-2 имеет среднюю вирулентность, поскольку имеет среднюю стабильность как в 5′-UTR, так и в TSS-to-end областях. Эта классификация согласуется с оценками коэффициента летальности от MERS, SARS и COVID-19, который составляет 35%, 9% и 2.4% соответственно 14 и с нашими наблюдениями относительно отношения шансов CG в их ORFS, которое составляет 0,56, 0,44 и 0,39 соответственно (Таблица S1). Более того, по сравнению с коронавирусом SARS, SARS-CoV-2 может инфицировать и более эффективно реплицироваться в тканях легких человека, но индуцирует экспрессию менее воспалительных цитокинов / хемокинов и медиаторов 15 . По нашему мнению, именно более низкое содержание C / G в геномной РНК позволяет SARS-CoV-2 воспроизводить большее количество вирусных частиц до запуска иммунореакции клеток-хозяев, поскольку на репликацию каждой вирусной частицы расходуется меньше энергии.
Таблица 1 Стабильность вторичной структуры, образованной геномом коронавируса.Два других коронавируса человека также обладают средней вирулентностью. Среди них NL63 имеет среднюю стабильность как в 5′-UTR, так и в TSS-to-end областях, тогда как 229E имеет низкую стабильность в 5′-UTR, но высокую стабильность в TSS-to-end области. Другой человеческий коронавирус (например, HKU1) имеет очень низкую вирулентность, потому что он имеет низкую стабильность как в 5′-UTR, так и в TSS-to-end областях (таблица 1). Распространение SARS-CoV-2 по всему миру, вероятно, означает, что коронавирус со средней вирулентностью с большей вероятностью будет распространяться быстро.Для сравнения, коронавирус с высокой или очень высокой вирулентностью может убить своего хозяина до того, как вызовет серьезную эпидемию, тогда как коронавирус с низкой или очень низкой вирулентностью не может эффективно реплицироваться для дальнейшей передачи.
Стохастическая модель для моделирования кинетики рибосом in vivo
Abstract
Вычислительное моделирование синтеза белка in vivo очень сложно, так как оно требует моделирования движения рибосом по всему транскриптому, а также учета концентрационных эффектов от 40+ различных типов тРНК и множества других белковых факторов. .Здесь я сообщаю о разработке стохастической модели трансляции белков, которая способна моделировать динамический процесс синтеза белка in vivo в прокариотической клетке, содержащей несколько тысяч уникальных последовательностей мРНК, с явной информацией о нуклеотидах для каждой, и сообщаю о количество биологических прогнозов, выходящих за рамки существующих моделей. В частности, я показываю, что когда сложная сеть зависимых от концентрации взаимодействий между факторами элонгации, тРНК, рибосомами и другими факторами, необходимыми для синтеза белка, включена во все подробности, некоторые биологические явления, такие как увеличение скорости удлинения пептидов с ростом бактерий скорость, предсказываются как эмерджентные свойства модели.Представленная здесь стохастическая модель демонстрирует важность рассмотрения процесса перевода на этом уровне детализации и предоставляет платформу для исследования различных аспектов перевода, которые трудно изучить в более грубых моделях.
Сведения об авторе
Биологические процессы, происходящие в клетке, такие как синтез белка рибосомой, являются идеальными примерами сложных систем, в которых наблюдаемые свойства процесса зависят от взаимодействий между различными компонентами, составляющими систему.В случае трансляции белка взаимодействие между рибосомами, тРНК, факторами элонгации, инициации и рециклинга с транскриптомом приводит к нескольким сложным поведениям, таким как увеличение скорости удлинения белковой цепи с увеличением скорости роста клеток. Ключевой вопрос заключается в том, как это сложное явление возникает в результате взаимодействия отдельных компонентов. Здесь я разрабатываю общий вычислительный метод, который учитывает сложность процесса перевода и демонстрирует, как несколько биологических явлений перевода возникают естественным образом в результате моделирования перевода с более детального представления.
Образец цитирования: Dykeman EC (2020) Стохастическая модель для моделирования кинетики рибосом in vivo . PLoS Comput Biol 16 (2): e1007618. https://doi.org/10.1371/journal.pcbi.1007618
Редактор: Аттила Чикас-Надь, Королевский колледж в Лондоне, ВЕЛИКОБРИТАНИЯ
Поступила: 01.10.2019; Принята к печати: 19 декабря 2019 г .; Опубликовано: 12 февраля 2020 г.
Авторские права: © 2020 Eric Charles Dykeman.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в рукописи и ее файлах с вспомогательной информацией.
Финансирование: Автор не получал специального финансирования для этой работы.
Конкурирующие интересы: Автор заявил об отсутствии конкурирующих интересов.
Введение
В клетках рибосомы отвечают за трансляцию белка информационной РНК (мРНК), которая была транскрибирована из геномной ДНК. В любой момент времени несколько мРНК транскрибируются полимеразным аппаратом в ответ на клеточные стрессы и механизмы обратной связи. Полный набор транскрибируемых мРНК в клетке представляет собой ее транскриптом, а трансляция рибосомным аппаратом дает ее протеом. Динамика транскриптома, его реакция на клеточные стрессы и его влияние на синтез белка, а также на протеом в целом важны для понимания того, как болезненные процессы возникают на клеточном уровне.Хотя существует множество процессов, которые могут влиять на динамику протеома, такие как контроль экспрессии мРНК на уровне транскрипции, было признано, что общая кинетика трансляции с помощью рибосомного аппарата может оказывать дополнительный контроль на уровнях белка в клетке. Поскольку трансляция рибосомами включает множество отдельных кинетических этапов и зависит от концентрации факторов трансляции, таких как факторы элонгации и инициации, которые должны быть созданы во время рибосомной трансляции кодирующих их мРНК, динамика процесса трансляции имеет сложные взаимозависимости и петли обратной связи. затрудняет точное моделирование процесса.
По сути, перевод регулируется физикой молекулярных взаимодействий и процессов диффузии, что делает его доступным для изучения с использованием стандартной химической кинетики и математики главного химического уравнения. В идеале при построении модели трансляции с основным химическим уравнением нужно учитывать как можно больше индивидуальных биохимических реакций в процессе трансляции, которые влияют на общую эффективность производства белка. Zur et al. [1] недавно выделили список из семи функций, которые, по их мнению, необходимо включить в модель трансляции, как минимум, чтобы обеспечить полную картину трансляции in vivo .На сегодняшний день развитие кинетических моделей динамики рибосом в основном сосредоточено либо на (1) методах, основанных на стохастике [2–4], либо на (2) статистических подходах, которые, грубо говоря, рассматривают мРНК как решетки с рибосомами, движущимися вдоль Узлы решетки мРНК соответствуют определенным вероятностям перескока [5–7]. Рибосомы можно моделировать как занимающие отдельные узлы решетки или как протяженные объекты, занимающие несколько узлов решетки [8].
Стохастические методы рассматривают движение рибосом по мРНК стохастическим образом с учетом различных уровней детализации.Например, Чу и фон дер Хаар [3] создали инструмент на Java, который учитывает перемещение 200 тыс. Рибосом на 60 тыс. МРНК с информацией о последовательности для каждой, с позиционной информацией о мРНК, кодируемой для каждой рибосомы. Их модель трансляции у дрожжей [2] рассматривает сложное расположение всех рибосом на мРНК наряду с относительным содержанием тРНК и эффекты смещения кодонов и конкуренции между тРНК за A-звено рибосомы. Однако они не учитывают эффекты концентрации от факторов удлинения, таких как eEF1 eEF2 (Ef-Tu и Ef-Tu / Ef-Ts в бактериальных системах), обмен GDP на GTP на эти факторы удлинения, а также эффекты концентрации и конкуренции между заряженные тРНК для Ef-Tu и образование TC, ни преждевременная терминация на смысловых кодонах.
В случае методов, основанных на статистике, эти модели называются «полностью асимметричными простыми процессами исключения» или моделями TASEP. Эти типы моделей хорошо известны в литературе и использовались для моделирования аспектов процесса перевода с 60-х и 70-х годов. Всесторонний обзор моделей TASEP (или ее кузена, модели потока рибосом — RFM [9], которая является приближением среднего поля TASEP) и их текущих возможностей здесь неосуществим, но может быть найден вместе с отчетом о различных других вычислительные модели перевода в [1, 10] с обсуждением преимуществ и ограничений каждой из них.Однако, хотя модели RFM и TASEP были полезны при рассмотрении некоторых зависимостей концентрации от процесса трансляции, например, от включения тРНК или Ef-G [11, 12]; или включили некоторые этапы процесса инициации [13], или рассмотрели модели TASEP со смесью нескольких мРНК [14], недавно было заявлено, что «в настоящее время нет моделей, которые учитывают все фундаментальные аспекты трансляции мРНК на одном уровне. клеточный уровень »[1, 9].
В этой работе я следовал тому, что можно было бы назвать «восходящим» подходом к построению модели трансляционной кинетики, которая будет использоваться для моделирования трансляции в клетке, с целью реализации семи особенностей, отмеченных Zur et al. al.[1]. Этот подход основан на двух основных принципах: (1) закодировать в модели текущие биохимические знания обо всех рибосомных реакциях, которые происходят на каждой стадии (т.е. инициирование, удлинение и завершение), и (2) минимально скорректировать экспериментально. измеренные кинетические параметры, когда это необходимо, так что результаты модели резюмируют особенности трансляционного процесса, которые либо наблюдались непосредственно, либо были выведены из экспериментальных измерений in vivo .Подобный подход был недавно предпринят Мацуура и др. [15], где они создали модель обыкновенного дифференциального уравнения (ODE), решенную в MATLAB, которая моделирует синтез трипептида из одного вида мРНК, содержащего три кодона. Их модель ODE содержит сообщенные 968 реакций и 242 компонента, большое количество, учитывая, что рассматривался только синтез трипептида из одного типа мРНК. Это подчеркивает сложность количества состояний и реакций, которые необходимо моделировать при масштабировании до целой клетки с тысячами различных мРНК и десятками тысяч рибосом, и почему модели, включающие все биохимические реакции, которые могут происходить, было трудно подобрать. развивать.
Хотя Мацуура и др. пытались применить подход «снизу вверх», между их моделью и моделью, о которой я здесь сообщаю, есть ряд существенных различий. Во-первых, модель Мацууры фокусируется на моделировании синтеза белка в системе синтеза восстановленного белка in vitro , тогда как я сосредотачиваюсь на моделировании процесса трансляции in vivo . Во-вторых, их подход моделирует синтез только одного типа мРНК с единственной рибосомой, занимающей мРНК в любой момент времени.Напротив, я рассматриваю синтез белка на тысячах мРНК, каждая из которых имеет явную и потенциально уникальную нуклеотидную последовательность, которая может находиться в полисомном состоянии. Наконец, хотя Мацуура и др. . использовать экспериментально измеренные кинетические скорости, они, насколько мне известно, не проверяли надежность скоростей по сравнению с экспериментальными наблюдениями in vitro восстановленных систем трансляции белка . Последнее особенно важно отметить, поскольку многие экспериментальные группы на протяжении многих лет имели противоречивые отчеты как о диапазоне кинетических скоростей для определенных реакций (в первую очередь, для связывания GTP / GDP с Ef-G [16, 17]), так и о том, что предложили различные модели кинетических событий и порядок их возникновения на рибосоме.Кроме того, Indrisiunaite et al. [18] отметили, что многие из этих скоростей могут быть чувствительны к буферным условиям, что делает проверку модели путем сравнения с экспериментальными наблюдениями критической. Путем тестирования кинетических скоростей и моделей реакций, которые были предложены экспериментальными группами для различных стадий трансляции, я смог подтвердить, какие из них приводят к квазистационарному состоянию трансляции in vivo (см. Вспомогательную информацию для полное обсуждение). Хотя модель, о которой я здесь сообщаю, не является окончательной и, вероятно, требует дополнительных корректировок кинетических скоростей, чтобы лучше соответствовать экспериментальным наблюдениям, особенно скоростям считывания преждевременной терминации и стоп-кодона (см. Вспомогательную информацию), она демонстрирует, что модель трансляции в цельной клетке , принимая во внимание все известные белковые факторы и биохимические этапы, можно вычислить за разумное время.Наконец, принимая во внимание (1) явное содержание нуклеотидов в полном транскриптоме и (2) все факторы трансляции (например, Efs, RF и тРНК) и то, как их концентрации влияют на процесс трансляции, модель показывает, как несколько трансляционных факторов Свойства возникают естественным образом из модели из-за сложной сети взаимодействующих компонентов, которые не видны в более грубых моделях или моделях, которые не учитывают, например, обмен GDP на GTP по факторам удлинения [4].
Результаты
Вычислительная модель кинетики рибосом in vivo
Рис. 1 иллюстрирует различные кинетические этапы кинетики рибосомы in vivo , которая была реализована в стохастической модели, описанной здесь. Подчеркивая основные особенности стохастической модели, она содержит ≈ 50 кинетических параметров для стадий инициации, элонгации и терминации рибосомы, а также ≈ 20 кинетических параметров, которые регулируют, например, связывание GTP / GDP с GTPases, такими как Ef- Г и Эф-Ту.Он способен моделировать трансляцию тысяч уникальных последовательностей мРНК в полисомной структуре, последовательности которых явно учитываются, и настроен для прогнозирования скорости инициации на основе вторичной структуры и последовательности мРНК как в родственных, так и в неродственных стартовых кодонах. (см. вспомогательную информацию). Это также зависит от концентраций: ≈ 10 факторов инициирования, удлинения и рециркуляции; нуклеотидные три и дифосфаты; 20 аминокислот; и более 40 тРНК. В модели учитывается преждевременное прерывание, а также неправильное включение неродственных пептидов и возникновение событий считывания стоп-кодона.Несмотря на то, что структура была создана для этих расширенных функций в коде, а кинетическая модель для инициирования и преждевременного прекращения основана на текущем лучшем понимании задействованных биохимических этапов, для их реализации потребуется дополнительная экспериментальная / теоретическая работа по кинетическим скоростям. функции в полном объеме. Более того, поскольку конкретная кинетическая информация для аминоацилирования тРНК была исследована только для двух из 20 аминоацил-тРНК синтаз, сложные индивидуальные кинетические этапы реализованы в модели как одна реакция (пунктирная рамка на рис. 1А).Также следует отметить, что модель в настоящее время предполагает, что концентрации аминокислот и нуклеотид-фосфатов постоянны, что мРНК не разлагаются и не продуцируются из-за транскрипции и что общее количество рибосом , , факторы инициации, факторы элонгации и т. Д. постоянны. Таким образом, модель предполагает квазистационарное состояние для концентраций рибосомы, мРНК и фактора элонгации. Это разумное предположение для клеток, претерпевающих экспоненциальный рост, поскольку при таком сценарии можно ожидать постоянного поступления аминокислот и GTP / ATP.Однако с небольшими изменениями в коде можно реализовать более подробную модель, где такие функции были динамическими. Полное описание модели вместе с обоснованием кинетических скоростей на основе экспериментальных данных приводится во вспомогательной информации.
Рис. 1. Схема кинетической модели рибосомы.
(A) Иллюстрация реакционной сети, моделируемой в модели. Аминоацилирование тРНК (пунктирные прямоугольники) указывают на область, где имеется ограниченное знание биохимической кинетики и требуется дополнительная экспериментальная работа.(B) Обзор этапов реализации. Конкретные последовательности мРНК и концентрация рибосом используются в качестве входных параметров. Программа определяет количество факторов удлинения и т. Д., Которые ожидаются от количества рибосом на основе экспериментальных данных [19]. Примеры выходных данных показаны в последнем столбце.
https://doi.org/10.1371/journal.pcbi.1007618.g001
Для моделирования кинетических реакций, перечисленных во вспомогательной информации, я реализую точную стохастическую модель Гиллеспи [20], в которой отдельные реакции «запускаются» случайным образом, одна за один раз, в соответствии с функцией склонности к реакции (1) Здесь i маркирует одну из мРНК N , j маркирует одну из M i возможных реакций для этой мРНК, а k ij — индивидуальные кинетические скорости для каждая реакция, где ϕ i обозначает сумму реакций с участием только мРНК i .Поскольку для моделирования точной модели Гиллеспи может потребоваться значительное время, я использую структуру бинарного дерева с узлами, представляющими частичные суммы ϕ i реакций с участием мРНК i , чтобы вычислить Φ и идентифицировать реакции на огонь на каждом шагу. Дерево просматривается с верхнего узла, выбирая ветвь, которая больше, чем r Φ, со случайным r ∈ [0, 1], до тех пор, пока не будет идентифицирован конкретный номер мРНК η , который удовлетворяет.После запуска определенной реакции в мРНК η , реакции в этой мРНК обновляются, и тот же путь через дерево повторно отслеживается, соответственно обновляя суммы. Таким образом, общая склонность Φ обновляется в log 2 ( N ) времени в соответствии с подходом, используемым в модели Gillepsie кинетики РНК, включающей реакции связывания отдельных оснований [21]. Этот метод сводится к изменению порядка реакций и, как отмечалось Cao et al. [22], приводит к траектории, которая будет статистически эквивалентна траектории, сформированной стандартным алгоритмом Гиллепси.Полную информацию о методе двоичного дерева Log (N) можно найти в справочной информации [21]. Моделирование, представленное в этой работе для случая μ = 1,0 удвоений в час, занимает полдня, чтобы достичь 10 3 секунд времени моделирования на одном процессоре. Моделирование при более высокой скорости роста μ = 2,5 занимает 3-4 дня из-за большего количества присутствующих рибосом и увеличения количества реакций, которые должны произойти, чтобы достичь 10 3 секунд времени моделирования.Однако индивидуальные реакции реализуются для обоих случаев за логарифм 2 ( N ) времени. Таким образом, если клетка удваивается со скоростью один раз в час ( μ = 1,0), то кинетическая модель, представленная в этой работе, может моделировать всю продукцию белка, которая происходит в отдельной клетке в течение одного полного клеточного цикла примерно за 30 часов вычислительного времени.
Проверка модели экспериментальными наблюдениями
Чтобы убедиться, что модель повторяет экспериментальные наблюдения трансляции у прокариот, я выполнил моделирование кинетики трансляции при экспоненциальном умножении E.coli с тремя разными темпами роста; μ = 0,7, μ = 1,0 и μ = 2,5 удвоения в час. Перед их моделированием необходимо сконструировать репрезентативный транскриптом, который имитирует то, что потенциально может наблюдаться in vivo . Каждая клетка E. coli будет иметь временный динамический транскриптом из-за экспрессии разных генов в ответ на различные сигналы окружающей среды и / или нахождения на разных стадиях клеточного цикла. Таким образом, точное представление транскриптома отдельной клетки трудно измерить, поскольку измерения часто усредняются по многим клеткам.Более того, [23] показали при измерении транскрипционного временного ряда оперона Lac с использованием sm-FISH, что количество мРНК для гена LacZ не только изменяется в ответ на внутриклеточную концентрацию лактозы, но и варьируется между клетками в соответствии с геометрическим / пуассоновским распределением. при низких / высоких уровнях экспрессии генов.
Используя эти наблюдения, я сконструировал транскриптомы, выбрав гены из протеома E. coli случайным образом и назначив количество копий мРНК для каждого гена, отобранного в соответствии с двумя типами вероятностных распределений (геометрическое / пуассоновское).Следует отметить, что нуклеотидная последовательность мРНК не соответствует аутентичным мРНК E. coli , но вместо этого кодоны выбираются так, чтобы смещения кодонов соответствовали содержанию тРНК в Таблице K в тексте S1 (см. Методы). Это привело к транскриптомам T07, T10 и T25 для использования в моделировании скорости роста μ = 0,7, 1,0 и 2,5 соответственно. Хотя транскриптомы T07, T10 и T25 являются искусственными, в следующем разделе (Биологические прогнозы модели) я покажу, что без корректировки кодонного смещения транскриптома для соответствия количеству тРНК (или наоборот) эффективность трансляции чрезвычайно высока. бедных.
Транскриптом T07 содержит 650 мРНК, содержащих N нуклеотидов = 0,56M нуклеотидов, в то время как транскриптомы T10 и T25 содержат в общей сложности 1265 мРНК с 1,2M нуклеотидами и 5151 мРНК с 5,0M нуклеотидами. Таблица 1 (c. Общее количество нуклеотидов в каждом транскриптоме было выбрано примерно в соответствии с экспериментальными значениями из [19], которые по существу фиксируют с точностью до 10% общее количество мРНК, которые использовались в моделировании.Говоря более конкретно, количество мРНК, которые используются для транскритпом T07, T10 и T25, находится в пределах 10% от значения, определенного экспериментально. Моделирование было выполнено с использованием общего количества факторов удлинения, тРНК и т.д., перечисленных в таблицах K-N в тексте S1. Предполагается, что каждый из этих факторов линейно увеличивается с количеством рибосом в клетке, следуя Бремеру и Деннису [19]. Таким образом, пользователям нужно только указать количество рибосом и отдельные последовательности мРНК для моделирования (см. Рис. 1B).Кинетические скорости были идентичны для всех скоростей роста и приведены во вспомогательной информации. Объем E. coli колеблется от v = 0,83 до v = 1,12 мкм 3 для скоростей μ = 1,3 до μ = 2,1 [19]. Поскольку это изменение объема имеет незначительное влияние на общую кинетическую скорость в модели Gillepsie, я использовал средний размер объема v = 1,0 мкм 3 для всех симуляций.Наконец, хотя моя модель может теоретически вычислить сайт связывания рибосомы (RBS) и скорость инициации мРНК на основе детального знания ее 5 ’UTR-последовательности и вторичной структуры, эта функция требует дополнительной экспериментальной проверки, прежде чем она может быть полностью реализована. Таким образом, на данный момент я предположил, что рибосомы инициируются на всех мРНК с максимальной скоростью, то есть в ситуации, когда 5 ’UTR неструктурирована и присутствует последовательность Шайна-Далгарно. Это дает дополнительное преимущество для тестирования / проверки фаз терминации и рециклинга, которые должны быть достаточно быстрыми для обработки максимально транслируемых мРНК.Это требует, чтобы кинетика стадий терминации и рециклинга была такой, чтобы существенное срывание или полномасштабная транспортная пробка не приводили к максимальной трансляции мРНК. Фиксация мРНК в случае максимальной инициации позволила проверить, что моя модель не приводит к неэффективной трансляции максимально транслируемых мРНК, и показала, что одна конкретная экспериментальная модель терминации больше соответствовала этому требованию, чем альтернатива (см. Вспомогательную информацию ).
На рис. 2 показан процент рибосом на разных стадиях процесса трансляции, а также процент свободного прединициативного комплекса 30S (30S: PIC) и свободного 50S при трех скоростях роста. Проценты рассчитываются относительно общего количества доступных 50S (или, что эквивалентно, 30S) субъединиц. При всех скоростях роста примерно 15% субъединиц 50S рибосомы являются свободными, в то время как оставшиеся β r = 85% находятся на одной из стадий трансляции. Конкретные значения для начального, удлиненного и конечного звеньев перечислены в таблице 1.Процент застопорившихся удлиняющихся рибосом указан в столбце% S. Хотя значение β r согласуется с данными Бремера и Денниса [19], я обнаружил, что оно имеет сложную зависимость по крайней мере от четырех факторов: (1) общее количество сайтов инициации, (2) общее количество нуклеотидов в транскриптоме, (3) разная длина открытых рамок считывания и их относительное количество в транскриптоме, и (4) скорость инициации рибосомы на всех мРНК.Наконец, на рис. 3 показаны рассчитанные скорости удлинения пептидной цепи ( C p ) для всех скоростей роста. Как видно на рис.3, среднее значение C p составляет примерно 15 кодонов в секунду при скорости роста μ = 0,7, 18 кодонов в секунду при 1,0, в то время как 21 кодон в секунду при скорости роста. мкм = 2,5. Эти значения очень хорошо сравниваются с ожидаемыми скоростями 15, 18 и 22 кодонов в секунду, соответственно, о которых сообщают Бремер и Деннис [19, 24].
Рис. 2. Трансляционная кинетика рибосом при различных скоростях роста E. coli .
Временные графики для процента рибосом (по сравнению с общей массой рибосом), которые являются инициирующими (черный), удлиняющимися (зеленый), завершающимися (красный), остановившимися (фиолетовый) или свободными 50S (синий) и свободными 30S: PIC ( коричневый) показаны для скоростей роста (A) μ = 0,7, (B) μ = 1,0 и (C) μ = 2,5 удвоения в час. Экспериментально ожидаемое соотношение рибосом в удлиненных комплексах (70S: EC — зеленая линия) к общему количеству рибосом равно 0.80–0,85 для всех темпов роста [19], что соответствует прогнозу модели. Временные курсы представляют собой в среднем три отдельных моделирования.
https://doi.org/10.1371/journal.pcbi.1007618.g002
Рис. 3. Скорость удлинения пептидной цепи при разных скоростях роста E. coli .
Скорости удлинения пептидной цепи ( C p ) в аминокислотах в секунду показаны для моделирования при скоростях роста μ = 0.7,1,0 и 2,5 удвоения в час. Промежуточные средние значения C p более 1000 отдельных событий синтеза белка представлены красными кривыми и показывают среднее удлинение пептидной цепи C p = 15,18 и 21 аминокислот в секунду. для μ = 0,7, 1,0 и 2,5 удвоения в час соответственно. Все модельные предсказания скоростей удлинения пептидов совпадают с экспериментальными оценками [24].
https: // doi.org / 10.1371 / journal.pcbi.1007618.g003
Биологические предсказания модели
Скорость удлинения увеличивается со скоростью роста клеток.
Как видно на рис. 3, C p уменьшается по мере уменьшения скорости роста, даже несмотря на то, что все моделирование используют точно такие же кинетические скорости для реакций удлинения. Предыдущие модели, такие как Rudorf [25], сообщали об использовании различных кинетических скоростей для фазы элонгации рибосомы, чтобы обеспечить наблюдаемые значения C p , в то время как стохастическая структура, использованная в Vieira et al.[4] обнаружили, что не было увеличения C p с увеличением скорости роста. Здесь разница в скоростях удлинения пептидной цепи возникает из-за сложной взаимозависимости различных факторов трансляции, то есть это возникающее свойство модели. Можно предположить, что снижение C p , которое следует за уменьшением скорости роста, возникает исключительно из-за падения концентрации тРНК и факторов элонгации, поскольку они напрямую связаны с кинетикой элонгации рибосомы.Это неверно, однако, поскольку значение C p , а также общая кинетика трансляции рибосомы устойчивы к попыткам увеличения скорости удлинения белковой цепи за счет оптимизации концентраций нескольких факторов трансляции. Чтобы продемонстрировать это, я выполнил моделирование со скоростью роста μ = 0,7 удвоения в час с тем же количеством рибосом и тем же транскриптомом, что и модели T 07, показанные на рис. 2A, но удвоил количество определенных компонентов. следующее.Когда только тРНК и коэффициенты элонгации Ef-Tu, Ef-Ts и Ef-G удваиваются, C p = 15,1, но с дополнительным последствием, что остановилось вдвое больше удлиненных 70S рибосом. на мРНК (из-за недостаточных факторов рециклинга). Удвоение только количества коэффициентов Ef-Tu, Ef-Ts или рециклинга привело к значениям C p = 16,0, 15,5 и 15,6, соответственно. Наконец, выбор различных случайных транскриптомов (путем выборки разных генов) также не повлиял на C p .Только когда все тРНК, EF и RF удвоились одновременно, C p увеличилось, демонстрируя, как скорость удлинения пептидной цепи является новым свойством модели.
Скорость элонгации зависит от количества тРНК и смещения кодонов транскриптома.
Хотя кинетика трансляции рибосомы устойчива к изменениям факторов трансляции, она очень чувствительна к количеству тРНК относительно смещения кодонов в транскриптоме.Донг и др. . ранее измерили молярное содержание тРНК из E. coli при различных скоростях роста с помощью двумерного электрофореза (см. Таблицу 5 в [26]). Кроме того, они оценили использование кодонов в транскриптоме при разных скоростях роста, используя кодирующие последовательности из Genbank и предыдущие измерения из [27] обилия белков при разных скоростях роста (см. Таблицу 3 в [26]). Используя данные Genbank и Pedersen, Донг дает частоту использования кодонов для AAA как 4.9% при мкм = 1,0. Однако тРНК, родственная AAA, составляет только 1,5% от общей молярной массы тРНК, которую они измерили. Следовательно, использование кодонов, указанное Донгом на основании данных Pederson и Genbank, не совсем соответствует профилю тРНК, который они измерили. Чтобы проиллюстрировать драматические эффекты, которые это несоответствие между количеством тРНК и использованием кодонов в транскриптоме может иметь на эффективность трансляции, я сконструировал транскриптом T10a, который был адаптирован из T10, чтобы иметь одинаковое количество мРНК с одинаковой длиной рамки считывания для каждой.Однако кодоны в T10a были изменены таким образом, чтобы иметь те же смещения кодонов, что и данные Pederson и Genbank, представленные в таблице 3 [26], то есть T10a имеет смещение кодонов, отражающее транскриптом E. coli дикого типа. Однако, в то время как смещение кодонов в транскриптоме T10a отражает то, что наблюдалось в экспериментах Pedersen et al. [27] для E. coli дикого типа потребность в тРНК, которая подразумевает использование этого кодона , не будет соответствовать относительному содержанию тРНК из Dong et al. используется в моделировании.
Моделирование трансляции с использованием T10a в соответствии с той же процедурой, что и T10, показывает, что удлинение существенно замедляется со средней скоростью удлинения C p = 8,1 кодонов в секунду при усреднении по всему транскриптому и значительным 13% рибосомы застопорились (см. Таблицу 1). Как видно на рис.4, результирующие соотношения тРНК в свободном тройном комплексе (TC) для моделирования T10a варьируются для разных видов тРНК намного больше, чем при моделировании T10, при этом некоторые виды тРНК имеют только 10% от их общего числа в свободных TC. .Это несоответствие между количеством тРНК и кодонным смещением транскриптома приводит к тому, что у нескольких видов тРНК очень мало из их общего числа доступно в свободных ТС, что приводит к увеличению времени декодирования кодонов, зависящих от этих тРНК. Однако, в отличие от транскриптомов T07, T10 и T25, у которых есть кодонные смещения, соответствующие содержанию тРНК, процент тРНК в свободном ОК примерно одинаков для всех видов тРНК, что показывает, как количества тРНК соответствуют скорости их использования при трансляции рибосом. в этих случаях.
Рис. 4. Процент каждой тРНК в свободном тройном комплексе.
Для каждой тРНК, перечисленной в таблице K в тексте S1, процент тРНК, которая находится в свободном тройном комплексе (TC), вычисляется путем взятия отношения количества тРНК в свободном TC к общему количеству тРНК. Среднее соотношение для каждой тРНК (за последние 100 секунд симуляции трансляции) показано для транскриптомов T07 (черный), T10 (красный) и T25 (синий и T10a (зеленый). до максимального для каждой симуляции отдельно.
https://doi.org/10.1371/journal.pcbi.1007618.g004
Результаты для транскриптомов T10a аналогичны результатам предыдущего исследования марковской модели, проведенного Rudorf et al. [28], которые показали, что содержание тРНК в свободных ОК становится асимметричным относительно общей концентрации тРНК в результате несоответствия между тРНК и частотой использования кодонов в мРНК. В таблице 2 сравнивается соотношение тРНК в свободном TC к общему количеству этой тРНК для транскриптома T10a (зеленые данные на фиг. 3) с таковым Rudorf et al.[28]. Как видно из таблицы, существуют аналогичные эффекты на содержание тРНК между T10a и теми, о которых сообщалось в Rudorf et al. [28] — например. наибольшее количество тРНК содержится в тРНК-Arg2, Arg3, Arg4 и тРНК-Arg5, а наименьшее — в тРНК-Lys. Однако есть некоторые различия, и они, вероятно, связаны с двумя факторами. Во-первых, в модели Рудорфа и Липовски Ef-Tu не имеет реакции на обмен, опосредованный GTP / GDP, посредством Ef-Ts, хотя, как и в моей модели, это присутствует (см. Рис. 1A). Это, вероятно, самый большой вклад в разницу, поскольку примерно 21% Ef-Tu находится в комплексе с GDP или Ef-Ts (при μ = 1.0) в моей модели и, следовательно, неспособен связывать заряженные тРНК с образованием свободного TC. Во-вторых, в этой работе учитываются эффекты задержки, которая может замедлить время высвобождения тРНК, которые декодируют редкие кодоны, тем самым еще больше уменьшая их количество в свободных TC. Этот эффект можно проиллюстрировать на рис. 5, на котором показаны мои модели, предсказанные средним временем декодирования для каждого кодона (в а.к. / сек), а также частоты остановки для каждого из 61 смыслового кодона. Как можно видеть, небольшие эффекты смещения кодонов могут резко изменить время декодирования кодонов, создавая обратную связь по количеству тРНК в свободных TC, влияя на общие свойства трансляции транскриптома.
Рис. 5. Прогнозируемое время декодирования кодонов и частота остановок.
Среднее время декодирования кодона и частоты остановки для каждого смыслового кодона вычисляется из 215M отдельных событий декодирования, которые происходят во всем транскриптоме за 1000 секунд времени моделирования. Синие и красные столбцы указывают транскриптомы T10 и T10a соответственно. События остановки рассчитываются как частота остановки рибосомы, которая происходит на данном кодоне.
https: // doi.org / 10.1371 / journal.pcbi.1007618.g005
Источником медленной средней трансляции транскриптома T10a являются дополнительные реакции, управляющие обменом GTP / GDP на Ef-Tu и связыванием аминоцил-тРНК с Ef-Tu. : GTP для создания бесплатного ТК. Эти реакции создают ситуацию, когда аминоацил-тРНК должны конкурировать за доступный Ef-Tu: GTP с образованием свободного TC. Недостаточно используемые аминоацил-тРНК будут иметь преимущество в образовании TC по сравнению с чрезмерно используемыми, что приведет к избытку недостаточно используемых тРНК в свободных TC.Таким образом, ситуации, когда относительные количества тРНК не соответствуют их потребности, подразумеваемой смещением кодонов транскриптома, будут приводить к сдвигам в количестве тРНК, доступной в свободных TC (как можно видеть на Фиг.4 для T10a). Чтобы дополнительно продемонстрировать резкое различие в трансляционном поведении, которое можно наблюдать, когда учтены все реакции, я выполнил моделирование, в котором реакции, управляющие связыванием Ef-Tu с вновь заряженными тРНК, выключаются, а тРНК немедленно возвращаются в свободный TC после изгнание из удлиненной рибосомы.Это то же предположение, которое использовали Виерия и др. [4] и предположение 3 в Zouridis et al. [29]. Пренебрежение этими реакциями приводит к средней скорости трансляции C p = 18,4 ака / сек для T10 и C p = 17,7 aa / sec для T10a, в отличие от менее эффективного C p = 8,1 а.о. / сек. Средняя трансляция, которая получается для транскриптома T10a с учетом этих реакций. Аналогичным образом, увеличение концентраций Ef-Tu (и Ef-Ts) на 25%, 50% и 75% приводит к значениям C p для T10a, равным 12.1, 14.2 и 15.1, соответственно, уменьшая эффекты конкуренции между заряженными тРНК за Ef-Tu: GTP, поскольку их количество становится все более распространенным. Оба этих результата хорошо согласуются с недавними моделями Rudorf et al. [28, 30], которые также приняли во внимание эффекты конкуренции между вновь заряженными тРНК за Ef-Tu: GTP и влияние кодонного смещения на общий процесс трансляции.
Плотность рибосом на мРНК зависит от транскриптома.
В то время как количество тРНК относительно использования кодонов в мРНК, по-видимому, оказывает сильное влияние на эффективность трансляции, распределение длины мРНК и их общее количество контролируют среднюю плотность рибосом по всему транскриптому (при условии фиксированного количества рибосомных субъединиц).Чтобы проиллюстрировать этот феномен, я сконструировал два дополнительных транскриптома, T10b и T10c. Первый, T10b, имеет по существу то же содержание нуклеотидов, что и T10 (всего 1,24 М нуклеотидов), но имеет тенденцию к короткой длине мРНК примерно от 600 до 900 нуклеотидов. Это приводит к транскриптому T10b, который имеет примерно такое же общее количество нуклеотидов, что и T10, но большее количество общих мРНК к 2040 году. Последний, T10c, имеет такое же количество мРНК, что и T10b, но не имеет смещения в выборе длины. , и, следовательно, имеет такое же распределение длин, как и T10.Следовательно, T10c имеет как более высокое общее содержание нуклеотидов (2,0M в данном случае), так и больше мРНК в целом по сравнению с T10. Чтобы рассчитать плотность рибосом, я сначала рассчитываю среднее расстояние между нуклеотидами между рибосомами, следуя [19] (2) где N nt — общее количество нуклеотидов в транскриптоме, β r — активность рибосомы и N 50 — общее количество доступных субъединиц рибосомы 50S.Значение плотности рассчитывается из ρ = 1/ d r , что равно количеству рибосом на нуклеотид. Обратите внимание, что d r имеет минимальное значение, соответствующее рибосомному следу, что указывает на максимальную физически возможную плотность рибосом. Следует отметить, что оценки рибосомного следа варьируют от 10 до 14 кодонов [1, 31]. Моя модель выделяет определенный расширенный след (8 кодонов 5 ’сайта P и 6 кодонов 3’ его) для рибосомы, контактирующей в мРНК, после анализов защиты от РНКазы, обсуждаемых в Berkhout et al.[31].
В таблице 1 показаны результаты для T10b и T10c с использованием тех же настроек для скоростей и количества тРНК и т. Д., Что и для T10. Поскольку инициация происходит с максимальной скоростью на всех мРНК, а постоянное расстояние между первой и второй рибосомами достигается в среднем при моделировании, можно предположить, что среднее количество нуклеотидов на рибосому должно зависеть только от общего содержания нуклеотидов, как предполагалось. в [19]. Однако, как показано в таблице 1, это не так, поскольку общее расстояние между центром рибосомы для T10b составляет d r = 86.5, а для T10 — d r = 92,9, что указывает на более высокую плотность рибосом в транскриптоме T10b. Увеличение плотности приводит к тому, что большее количество рибосом находится в остановленном состоянии, при этом 5% рибосом теперь остановлены по сравнению с 3% в T10. Очень интересно, что это увеличенное срывание имеет лишь незначительное влияние на общую среднюю скорость удлинения: C p = 17,7 для T10b по сравнению с C p = 18.1 для T10. Таким образом, хотя в любой момент времени на мРНК останавливается больше рибосом, это должно происходить случайным образом и временно, чтобы любые застопорившиеся рибосомы быстро снова начинали двигаться, прежде чем заставили дополнительные рибосомы застрять позади них, создавая полную пробку. Наконец, моделируя транскриптом T10c, у которого увеличивается как количество мРНК, так и общее количество нуклеотидов по сравнению с T10, можно заметить, что среднее расстояние между рибосомами составляет примерно d r = 135.9, что указывает на меньшую плотность рибосом в T10c, хотя активность рибосом составляет около 98%.
Моделирование с использованием
мРНК E. coli .Хотя все транскриптомы T07, T10 и T25 воспроизводят ожидаемые характеристики трансляционных процессов in vivo , которые были выделены Бремером и Деннисом [19], они представляют собой искусственные транскриптомы с кодонными смещениями, которые не наблюдаются. в E. Coli . Таким образом, естественно возникает вопрос о способности модели воспроизводить трансляционную динамику на реальной информации мРНК / транскриптома.Чтобы исследовать этот вопрос, я создал транскриптомы T07wt, T10wt и T25wt, которые имеют почти такие же номера нуклеотидов и мРНК, что и искусственные транскриптомы T07, T10 и T25, но мРНК в этих транскриптомах были взяты из предсказанных открытых рамок считывания (ORF). ) штамма MG1655 E. Coli K12 (код доступа U00096). Таблица 3 сообщает о средних скоростях трансляционного удлинения с использованием содержания тРНК, измеренного Dong et al. [26], и сравнивается с моделированием с использованием альтернативных количеств тРНК, показанных в таблице 4.Содержание тРНК в таблице 4 представляет собой одно возможное теоретическое решение проблемы сопоставления использования тРНК / кодонов, то есть идентификацию относительного содержания тРНК, так чтобы процент каждой тРНК от общего количества соответствовал частоте использования кодона (ов), который он декодирует для. Важно отметить, что из-за перекрестного распознавания кодонов множеством тРНК существует несколько решений этой проблемы, и поэтому может существовать более оптимальное решение.
Как видно из Таблицы 3, используя экспериментально измеренные содержания тРНК от Dong et al.[26] приводит к крайне плохому переводу ( C p ≤ 6,0 а.о. / сек) для всех скоростей роста. Однако, используя смещение тРНК, которое соответствует частоте кодонов в ORF E. Coli , мы можем видеть, что эффективность трансляции резко повышается для транскриптомов T25wt и T10wt, в то время как транскриптом T07wt по-прежнему страдает плохой транскрипцией. При исследовании квазистационарного распределения тРНК в свободном ТС для моделирования T07wt, тРНК Arg4 и Arg5, которые декодируют очень редкие кодоны аргинина AGA и AGG, имеют по существу ноль тРНК в свободном ТС.Это говорит о том, что минимальный порог тРНК может быть важным для обеспечения эффективного цикла через процесс перезарядки, и могут существовать дополнительные ограничения на численность тРНК.
Хотя использование количества тРНК в таблице 4, которое соответствует смещению кодонов мРНК, улучшает трансляцию в транскриптомах wt, динамика трансляции не соответствует экспериментальным наблюдениям Бремера и Денниса, а также искусственного транскриптома с изобилием тРНК от Dong et al. . [26].Этому есть много возможных объяснений, а также возможные способы настройки скорости / концентрации для достижения лучшего соответствия экспериментам с транскриптомами дикого типа. Во-первых, возможно, что альтернативное распределение тРНК, которое также соответствует смещению кодонов, является более эффективным, или что тРНК должны немного отклоняться от смещения кодонов по другим неизвестным причинам. Во-вторых, возможно, что кинетические скорости процесса элонгации, которые были оптимизированы для содержания тРНК Донга Rudorf et al.[25] необходимо повторно откалибровать или изменить другие кинетические скорости, например, для перезарядки аминоацил-тРНК. В-третьих, могут быть некоторые известные / неизвестные реакции удлинения или перезарядки тРНК, которые необходимо учитывать в модели. В-четвертых, концентрации факторов удлинения, таких как Ef-Tu, могут быть слишком низкими, поскольку увеличение Ef-Tu увеличивает скорость трансляции T10a. Наконец, может быть комбинированная оптимизация тРНК и кинетической скорости, которая должна выполняться в тандуме, наряду с потенциально другими факторами, чтобы получить хорошее соответствие транскриптомов дикого типа экспериментальным данным по трансляции Бремера и Денниса [19].
Обсуждение
В этой работе я разработал стохастическую модель кинетики рибосом, основанную на алгоритме моделирования [20], который способен моделировать трансляцию тысяч уникальных мРНК с явной нуклеотидной последовательностью в контексте in vivo . Модель включает ряд важных биофизических свойств процесса трансляции одновременно и учитывает различные скорости трансляции кодонов, которые, в свою очередь, будут зависеть от количества тРНК и использования другими мРНК.Более того, он учитывает эффекты отдельных рибосом, конкурирующих за факторы трансляции, и полисомное состояние нескольких рибосом, которые должны одновременно связываться с мРНК, а также принимая во внимание исключенный объем рибосом и образование и разрешение пробок. Вычислительный код настроен для предсказания скорости инициации мРНК на основе последовательности и вторичной структуры вокруг стартового кодона, что дает возможность в ближайшем будущем для экспериментов и теории выяснить влияние последовательности на инициацию трансляции.
Как показано выше, мои предсказания моделей трансляции для активности рибосом β r для данной скорости роста и содержания нуклетидов мРНК согласуются с экспериментальными наблюдениями [19] для E. coli . Кроме того, увеличение скорости удлинения пептидной цепи с увеличением скорости роста согласуется с экспериментом, по крайней мере, с тремя различными скоростями роста [24]. Однако, в отличие от работы [25], для реакций удлинения необходим только один набор кинетических параметров, чтобы воспроизвести это явление.Действительно, представленная здесь модель трансляционной кинетики демонстрирует классические черты сложной динамической системы, в которой свойства возникают в результате сложных взаимодействий всех компонентов. Скорость удлинения пептидной цепи является ярким примером этого явления, поскольку увеличение значений C p возникает естественным образом в результате изменений сложной динамики всех трансляционных компонентов, которые происходят при увеличивающихся концентрациях. Попытки увеличить значения C p за счет увеличения концентрации только одного или нескольких компонентов системы не дали результата, что дополнительно иллюстрирует сложность процесса трансляции.Это прямо противоположно данным Vieira et al. [4], которые не наблюдали этот эффект, используя стохастическую каркасную модель перевода. Вероятно, это происходит из-за отсутствия реакций связывания, управляющих образованием свободного TC, а также из-за отсутствия стадий обрыва, связанных с факторами рециклинга. Это показывает важность включения этих реакций в трансляционные модели.
Однако одним из факторов, который, по-видимому, имеет сильное влияние на динамику трансляции, был состав транскриптома, как в отношении его кодонного смещения относительно концентраций тРНК, так и его длины и общего содержания нуклеотидов.Сверхчувствительность процесса трансляции к количеству тРНК по отношению к смещению кодонов также была отмечена Rudorf et al. когда реакции образования Ef-Tu и TC были учтены в их трансляционных моделях [28, 30]. Однако предварительная работа по воспроизведению наблюдаемой динамики трансляции с транскриптомами E. Coli дикого типа с использованием мРНК из предсказанных ORF показала, что, хотя сопоставление содержания тРНК с кодонным смещением увеличивало эффективность трансляции до значений, близких к ожидаемым экспериментально, дополнительные необходима оптимизация параметров или общей модели.
Значение результатов для численности тРНК и их влияние на эффективность трансляции, как также обсуждается в Rudorf et al. [28], заключаются в том, что изменения смещения кодонов транскриптомов из-за чрезмерной экспрессии определенных мРНК (таких как lacz) из-за клеточных ответов на окружающую среду могут потенциально привести к изменениям скорости элонгации других мРНК из-за перераспределения тРНК в свободных TC . В приложениях для бесклеточного синтеза белка результаты показывают потенциальную потребность исследователей в тщательной настройке концентраций тРНК в соответствии с требованиями, вытекающими из использования кодонов транскриптомов, для максимизации синтеза белка.Эти наблюдения указывают на необходимость рассматривать кинетику трансляции с более целостной точки зрения, когда необходимо учитывать эффекты трансляции из-за присутствия гетерогенных популяционных мРНК. Более того, моделирование с T10, T10a, T10b и T10c, иллюстрирует, как плотность рибосом, вероятно, контролируется сложным набором факторов, которые включают общее количество рибосом, мРНК, а также длину мРНК и их относительную численность и скорость инициации рибосом.Как сообщили Бремер и Деннис, наблюдаемая рибосомная активность β r примерно постоянна для разных скоростей роста E. coli , а соответствующее содержание нуклеотидов мРНК составляет примерно 1,0 М, 2,0 и 4,6 М. нуклеотидов для скорости роста μ = 0,7, 1,0 и 2,5 удвоения в час соответственно [19]. Хотя это немного отличается от значений нуклеотидов 0,56M, 1,2M и 5,0M, используемых здесь, расхождение, вероятно, связано с тем, что мРНК имеют разные скорости инициации и уровни экспрессии в действительности, в то время как здесь все мРНК были произвольно зафиксированы для максимальной инициации. темп.Учет различных скоростей инициации мРНК, вероятно, также приведет к тому, что среднее расстояние между рибосомами будет больше соответствовать экспериментальным измерениям, которые, по расчетам Бремера и Денниса, составляют примерно дней r = 160 для μ = 1,0 , по сравнению со значением d r = 93, которое я вычислил здесь. Однако корректировка транскриптома и некоторых кинетических параметров для стадии инициации трансляции потребует знания скоростей инициации для всех мРНК в транскриптоме, что выходит за рамки этой первоначальной работы.Несмотря на это, используемая здесь трансляционная модель выявила ряд неожиданных эффектов, связанных с составом транскриптома.
Модель, которую я разработал, открывает многочисленные возможности для увязки экспериментальных измерений с теоретическими предсказаниями и для проверки физической осуществимости моделей, которые были постулированы на основе экспериментальных наблюдений. Действительно, путем тестирования и настройки этой модели, чтобы резюмировать экспериментальные наблюдения, я обнаружил, что ряд экспериментально выдвинутых моделей неспособен привести к устойчивому состоянию синтеза белка (см. Дополнительную информацию для обсуждения).Наконец, это также может помочь в разработке упрощенных моделей за счет выбора лучших параметров модели. Например, наблюдения этой более сложной модели могут помочь моделям TASEP учитывать дополнительные особенности, такие как динамическое время инициации, которые могут иметь решающее значение для моделирования конкретных особенностей трансляционного процесса.
Методы
Построение и параметризация модели
Подробные сведения о построении модели, наряду с обоснованием кинетических скоростей и концентраций трансляционных факторов, основаны на большом количестве экспериментальной литературы, и все подробности можно найти во вспомогательной информации.Программное обеспечение и данные транскриптома, использованные в симуляциях, можно загрузить с http://www-users.york.ac.uk/∼ecd502/ или запросить у автора по электронной почте.
Построение транскриптома
Транскриптомы, использованные в моделировании, были сконструированы с использованием известного протеома E. coli , который был получен из базы данных uniprot https://www.uniprot.org/proteomes/UP000000625. В этой базе данных указано количество аминокислот в каждом из 4353 идентифицированных белков в E.coli K12 вместе с аминокислотной последовательностью белка. Для достижения максимальной скорости трансляции 22 кодонов в секунду при самых высоких скоростях роста частота использования кодонов в мРНК должна соответствовать количеству тРНК, которые могут их декодировать. Следовательно, отдельные аминокислотные последовательности игнорировались, и кодоны для мРНК выбирались в соответствии с относительной численностью тРНК в таблице K в тексте S1, сохраняя при этом длину рамки считывания для каждого гена. Для тРНК, таких как тРНК-Lys, которая родственна кодонам AAA и AAG, предполагается, что количество тРНК (4360 при μ = 1.0) подразумевает использование равной частоты 2180 для обоих кодонов. Суммирование этих вкладов в кодоны по всем тРНК и нормализация дает частоту использования кодонов, которая затем отбирается для построения репрезентативных мРНК для каждого гена в базе данных uniprot.
Для создания транскриптома индивидуальные мРНК, соответствующие одному гену, выбираются случайным образом, а количество копий мРНК распределяется на высокое (вероятность 5%), промежуточное (вероятность 35%) или низкое (вероятность 60). %) категория выражения.Затем определяются числа копий ( k ) для каждой мРНК путем выборки из распределения Пуассона, p ( k ) = e −λ λ k / k !, Для высокое выражение (λ = 6,8) или геометрическое распределение, p ( k ) = (1 — λ) k λ, для среднего (λ = 0,58) и низкого (λ = 0,93) категории выражений. Гены и соответствующие им последовательности мРНК выбираются по одному до тех пор, пока не будет достигнуто общее содержание нуклеотидов и / или общее количество мРНК.
Благодарности
ECD благодарит профессора Р. Тварока и доктора Р. Дж. Бингема за внимательное чтение рукописи и их полезные отзывы.
Ссылки
- 1. Цур Х., Таллер Т. Прогностическое биофизическое моделирование и понимание динамики трансляции мРНК и ее эволюции. Исследование нуклеиновых кислот. 2016; 44 (19): 9031–9049. pmid: 275
- 2. Чу Д., фон дер Хаар Т. Архитектура эукариотического перевода.Исследование нуклеиновых кислот. 2012. 40 (20): 10098–10106. pmid: 22965119
- 3. Чу Д., Забет Н., фон дер Хаар Т. Новый и универсальный вычислительный инструмент для моделирования трансляции. Биоинформатика. 2011. 28 (2): 292–293. pmid: 22113083
- 4. Vieira JP, Racle J, Hatzimanikatis V. Анализ динамики удлинения трансляции в контексте клетки Escherichia coli. Биофизический журнал. 2016; 110 (9): 2120–2131. pmid: 27166819
- 5. Макдональд CT, Гиббс JH, Пипкин AC.Кинетика биополимеризации на шаблонах нуклеиновых кислот. Биополимеры: оригинальные исследования биомолекул. 1968; 6 (1): 1–25.
- 6. Макдональд CT, Гиббс JH. О кинетике синтеза полипептидов на полирибосомах. Биополимеры: оригинальные исследования биомолекул. 1969. 7 (5): 707–725.
- 7. Хиерно Дж. О некоторых стохастических моделях биосинтеза белка. Биофизическая химия. 1974. 2 (1): 70–75. pmid: 4414908
- 8. Шоу Л. Б., Зия Р., Ли К. Х.Полностью асимметричный процесс исключения с протяженными объектами: модель синтеза белка. Physical Review E. 2003; 68 (2): 021910.
- 9. Reuveni S, Meilijson I., Kupiec M, Ruppin E, Tuller T. Анализ удлинения трансляции в масштабе генома с моделью потока рибосом. Вычислительная биология PLoS. 2011; 7 (9): e1002127. pmid: 210
- 10. фон дер Хаар Т. Математическое и компьютерное моделирование движения рибосом и синтеза белка: обзор. Журнал вычислительной и структурной биотехнологии.2012; 1 (1): e201204002. pmid: 24688632
- 11. Шах П., Гилкрист Массачусетс. Влияние коррелированных количеств тРНК на ошибки трансляции и эволюцию систематической ошибки использования кодонов. PLoS генетика. 2010; 6 (9): e1001128. pmid: 20862306
- 12. Каннароцци Г., Шраудольф Н.Н., Фати М., фон Рор П., Фриберг М.Т., Рот А.С. и др. Роль кодонов в динамике трансляции. Клетка. 2010. 141 (2): 355–367. pmid: 20403329
- 13. Димелов Р.Дж., Уилкинсон С.Дж. Контроль инициации трансляции: модельный анализ ограниченных экспериментальных данных.Журнал Интерфейса Королевского общества. 2008. 6 (30): 51–61.
- 14. Грейлих П., Чандрини Л., Аллен Р.Дж., Романо М.С. Смешанная совокупность конкурирующих полностью асимметричных простых процессов исключения с общим резервуаром частиц. Physical Review E. 2012; 85 (1): 011142.
- 15. Мацуура Т., Танимура Н., Хосода К., Йомо Т., Симидзу Ю. Анализ динамики реакции восстановленной системы трансляции белка Escherichia coli с помощью компьютерного моделирования. Труды Национальной академии наук.2017; 114 (8): E1336 – E1344.
- 16. Завьялов А. В., Хаурилюк В. В., Эренберг М. Обмен гуаниновых нуклеотидов на связанном с рибосомами факторе элонгации G инициирует транслокацию тРНК. Журнал биологии. 2005; 4 (2): 9. pmid: 15985150
- 17. Wilden B, Savelsbergh A, Rodnina MV, Wintermeyer W. Роль и время связывания и гидролиза GTP во время EF-G-зависимой транслокации тРНК на рибосоме. Труды Национальной академии наук. 2006. 103 (37): 13670–13675.
- 18. Индризиунайте Г., Павлов М.Ю., Эургуэ-Хамард В., Эренберг М. О зависимости от pH RF-зависимой терминации трансляции мРНК класса 1. Журнал молекулярной биологии. 2015; 427 (9): 1848–1860. pmid: 25619162
- 19. Бремер Х., Деннис П.П. и др. Модуляция химического состава и других параметров клетки скоростью роста. Escherichia coli и Salmonella: клеточная и молекулярная биология. 1996. 2 (2): 1553–69.
- 20. Gillespie DT.Точное стохастическое моделирование связанных химических реакций. Журнал физической химии. 1977; 81 (25): 2340–2361.
- 21. Dykeman EC. Реализация алгоритма Гиллеспи для кинетики РНК с логарифмическим обновлением времени. Исследование нуклеиновых кислот. 2015. 43 (12): 5708–5715. pmid: 259
- 22. Cao Y, Li H, Petzold L. Эффективная формулировка алгоритма стохастического моделирования для химически реагирующих систем. Журнал химической физики. 2004. 121 (9): 4059–4067.pmid: 15332951
- 23. So Lh, Ghosh A, Zong C, Sepúlveda LA, Segev R, Golding I. Общие свойства транскрипционных временных рядов в Escherichia coli. Генетика природы. 2011; 43 (6): 554.
- 24. Liang ST, Xu YC, Dennis P, Bremer H. Состав мРНК и контроль экспрессии бактериальных генов. Журнал бактериологии. 2000. 182 (11): 3037–3044. pmid: 10809680
- 25. Рудорф С., Томмен М., Роднина М. В., Липовски Р. Выведение кинетики синтеза белка in vivo из скоростей перехода, измеренных in vitro.Вычислительная биология PLoS. 2014; 10 (10): e1003909. pmid: 25358034
- 26. Донг Х., Нильссон Л., Курляндия К.Г. Совместная вариация обилия trna и использования кодонов inescherichia coliat с разными скоростями роста. Журнал молекулярной биологии. 1996. 260 (5): 649–663. pmid: 8709146
- 27. Педерсен С., Блох П.Л., Рих С., Нейдхардт ФК. Паттерны синтеза белка в E. coli: каталог количества 140 отдельных белков с разной скоростью роста. Клетка. 1978. 14 (1): 179–190.pmid: 352533
- 28. Рудорф С., Липовски Р. Синтез белка в E. coli: зависимость кодон-специфической элонгации от концентрации тРНК и использования кодонов. ПлоС один. 2015; 10 (8): e0134994. pmid: 26270805
- 29. Зоуридис Х., Хатзиманикатис В. Модель трансляции белка: самоорганизация полисом приводит к максимальной скорости синтеза белка. Биофизический журнал. 2007. 92 (3): 717–730. pmid: 17098800
- 30. Рудорф С. Эффективность ингибирования синтеза белка зависит от состава тРНК и кодонов.Вычислительная биология PLoS. 2019; 15 (8): e1006979. pmid: 31369559
- 31. Беркхоут Б., Шмидт Б.Ф., ван Стриен А., ван Бум Дж., Ван Вестренен Дж., Ван Дуин Дж. Ген лизиса бактериофага MS2 активируется посредством терминации трансляции в перекрывающемся гене оболочки. Журнал молекулярной биологии. 1987. 195 (3): 517–524. pmid: 3656424
Структурная основа сдвига рамки рибосомы во время трансляции генома РНК SARS-CoV-2
( A ) Поперечный разрез структуры рибосомы с псевдоузлом с паузой, показывающий выходной туннель.Возникающий C-конец Nsp10 (оранжевый) и N-конец Nsp11 / Nsp12 (фиолетовый) видны от PTC до периферии выходного туннеля рибосомы (LSU в синем). ( B ) Схематическое изображение пути растущего пептида вдоль выходного туннеля. Arg 4387 складывается из 28 остатков рРНК S A 1555 на сайте сужения. Далее вниз, где туннель расширяется, C-концевой домен цинкового пальца Nsp10 сворачивается котрансляционно, при этом Trp 4376 укладывается на A 2261 из 28 S рРНК.( C ) Хорошо упорядоченная плотность видна для Arg 4387 Nsp10, когда он складывается на A 1555 из 28 S рРНК в месте сужения и стабилизируется Leu 4386 . Структура показана на крио-ЭМ карте с двумя контурами (серым и красным). ( D и E ) Наложение котрансляционно свернутого домена цинкового пальца с кристаллической структурой Nsp10 [зеленый, PDB 2FYG ( 37 )] показывает структурное сходство.( F ) Исследование роли взаимодействий зарождающейся цепи с выходным туннелем рибосомы с использованием системы RRL in vitro. Мутации взаимодействующих остатков тестировали на предмет их влияния на сдвиг рамки, показанный по сравнению со сдвигом рамки WT (41% сдвиг рамки был нормализован до 100%). Замена всей зарождающейся цепи несвязанной последовательностью приводит к относительному увеличению сдвига кадра на 35%, что лишь частично связано с потерей 5′-контура аттенюатора. Взаимодействия вокруг сайта сжатия, вероятно, служат для ослабления сдвига кадра, потому что замена взаимодействующего Arg 4387 и стабилизации Leu 4386 (LR) на Ala (AA) увеличивает сдвиг кадра на 30%.Планки погрешностей представляют собой стандартное отклонение. NS, не имеет значения, и ** P t test. ( G ) Выравнивание SARS2 с близкородственными последовательностями других коронавирусов, подчеркивающее сохранение мутантных остатков [окрашено, как в (F)]. Показанный участок последовательности охватывает C-концевой домен цинкового пальца Nsp10 (оранжевый) и части Nsp11 / Nsp12 (фиолетовый), видимые в нашей реконструкции. Остатки растущей цепи Leu 4386 и Arg 4387 , которые взаимодействуют с туннелем выхода рибосом, строго консервативны, тогда как консервативность соседних остатков ниже.Звездочки представляют четыре цистеина цинкового пальца Nsp10. Однобуквенные сокращения аминокислотных остатков следующие: A, Ala; C, Cys; D, Asp; E, Glu; F, Phe; G, Gly; H, Его; Я, Иль; К, лиз; L, лей; M, Met; N, Asn; P, Pro; Q, Gln; R, Арг; S, Ser; Т, Тр; V, Val; W, Trp; и Y, Tyr.Сьюзан Мефферт | Профили UCSF
Susan M. Meffert M.D., M.P.H. является доцентом кафедры психиатрии UCSF и филиалом факультета медицинских наук UCSF.После работы в сфере гуманитарной помощи д-р.Мефферт посещала медицинскую школу с целью изучения психиатрической помощи травмированным группам населения в странах с низким и средним уровнем доходов (СНСД). Она является активным исследователем в области глобального психического здоровья (GMH) с 2004 года. Доктор Мефферт провела свою первую оценку потребностей в психиатрической помощи во время обучения в ординатуре, когда она работала с беженцами из Дарфура, живущими в Каире, Египет. Во время своей исследовательской стажировки она опиралась на эту работу и провела рандомизированное контролируемое испытание (РКИ) адаптированного психиатрического лечения для дарфурских беженцев в Каире, проводимого членами общины.В 2009 году доктор Мефферт получил Премию Берка за карьеру в области глобальных медицинских наук и поступил на факультет в качестве доцента кафедры психиатрии. С 2009 по 2012 год она прошла оценку потребностей в психиатрической помощи, РКИ межличностной психотерапии (IPT) для выживших после землетрясения в Сычуани возле Шифаня, Китай, и успешно участвовала в конкурсе на получение награды K12 от UCSF Building Interdisciplinary Research Careers in Women’s Health (BIRCWH). .
С 2009 года д-р Мефферт работает в Кисуму, Кения, в программе «Семейные услуги по уходу и образованию в связи со СПИДом» (FACES), совместном сайте UCSF в провинции Ньянза, финансируемом PEPFAR.Она завершила гибридное исследование типа I эффективности и внедрения интегрированной психиатрической помощи, оказываемой неспециалистами в рамках платформы первичной медико-санитарной помощи FACES (n = 300, исследование «Психическое здоровье, ВИЧ и домашнее насилие» [MIND]). Д-р Мефферт и его коллеги финансируются совместным грантом NIMH и Глобального альянса по хроническим заболеваниям (GACD) на проведение исследования «Партнерство по вопросам депрессии и первичной медико-санитарной помощи для исследования эффективности внедрения» (DAPPER) (R01 Mh215512). DAPPER поддерживает гибридное рандомизированное исследование эффективности и внедрения психотерапии в сравнении с фармакологическим лечением депрессии (n = 2000) для оценки неспециализированного оказания научно обоснованной помощи, интегрированной в существующий окружной центр здравоохранения государственного сектора (окружная больница Кисуму [KCH]) в отношении клинической эффективности и параметрам реализации, включая надежный экономический анализ.Д-р Мефферт и его коллеги впоследствии получили награду (R01 Mh213722), которая использует исследование DAPPER для добавления рандомизированного, неспециализированного лечения второй линии для пациентов с депрессией и / или посттравматическим стрессовым расстройством (ПТСР), не получающих ремитенты, с созданием последовательного множественного назначения. рандомизированное исследование (SMART-DAPPER, n = 2710).
Кредит на подоходный налог, уплаченный другому государству или стране
Налоговый кредит предоставляется физическому лицу, которое является резидентом Северной Каролины, в отношении налога, взимаемого и уплачиваемого другим штатом или страной на доход, который также облагается налогом в Северной Каролине, при соблюдении следующих условий:
- Доход должен быть получен из источников в другом штате или стране и облагаться налогом в соответствии с законодательством штата или страны, независимо от юридического места жительства налогоплательщика.
- Допустимый зачет — это меньшая из сумм чистого налога, уплаченного другому штату или стране с дохода, также облагаемого Северной Каролиной, или продукта, полученного путем умножения налога Северной Каролины, рассчитанного до вычета, на дробь, в которой числитель является частью скорректированного дохода Северной Каролины, который облагается налогом в другом штате или стране, а знаменатель — это общий скорректированный доход, полученный во время проживания в Северной Каролине. Если требуются кредиты для налогов, уплаченных более чем одному штату или стране, необходимо произвести отдельный расчет для каждого штата или страны и объединить отдельные кредиты для определения общей суммы кредита.
- Квитанция или другое доказательство, подтверждающее уплату подоходного налога другому штату или стране, и копия декларации, поданной в другой штат или страну, должны быть представлены вместе с декларацией Северной Каролины. Не разрешается зачет подоходного налога, уплаченного городу, округу или другому политическому подразделению штата или страны или федеральному правительству. Некоторые зарубежные страны не требуют от физических лиц подачи налоговой декларации. Вместо этого их обязательство по подоходному налогу выплачивается путем удержания.Департамент примет доказательства удержания для обоснования налогового кредита.
Если какой-либо налог, по которому резидент запросил налоговый кредит в декларации о доходах Северной Каролины, возвращается в любое время другим штатом или страной, налог, равный той части кредита, разрешенной для налогов, начисленных или возвращенных другой штат или страна подлежат оплате и подлежат штрафам и пени.
После завершения возврата в другом штате заполните свое заявление в Северной Каролине и включите все доходы как внутри штата, так и за его пределами.Рассчитайте свой налог так, как если бы кредит не запрашивался. Заполните Часть 1 формы D-400TC, чтобы определить допустимый налоговый кредит. Распространенной ошибкой является указание в строке 6 Части 1 общей суммы налога, удержанного другим штатом или страной.
