16. Автоклавирование, устройство автоклава. Стерилизация горячим воздухом, устройство сухожарового шкафа. Режимы стерилизации.
Автоклав — паровой стерилизатор. В его состав входят термометр, манометр, источник тепла, вводный и выпускной краны.
Действующим агентом является горячий пар под давлением. Материалы загружаются в автоклав в биксах. Работа автоклава контролируется показаниями манометра и термометра.
Существует три режима стерилизации:
при давлении 1,1 атм — 60 мин;
при давлении 1,5 атм — 45 мин;
при давлении 2 атм — 30 мин.
Стерилизация в сухожаровых шкафах проводится горячим воздухом. Инструменты укладывают на полки стерилизатора и сначала высушивают 30 мин при температуре 80 градусов с приоткрытой дверцей. Стерилизация осуществляется с закрытой дверцей в течение 60 мин при температуре 180 градусов.
Методы стерилизации эндоскопических аппаратов. Профилактика СПИДа.
Для очистки эндоскопов используют моющие растворы. Для обработки применяют раствор хлоргексидина, этанола, глутарового альдегида, перекись водорода. Отдельные части обрабатывают путем погружения. Остатки антисептика удаляют дистилированной водой, затем воздухом удаляют жидкость из каналов. Эндоскопические аппараты стерилизуют в специальном газовом стерилизаторе ГПД-250. Предметы помещают в герметичную камеру, которую заполняют окисью этилена. Время экспозиции — 16 ч при температуре 18 градусов. Также можно проводить стерилизацию смесью окиси этилена и бромида метилена при температуре 55 градусов в течение 6 ч.
Профилактика СПИДа предусматривает своевременное выявление инфицированных больных. Правила личной безопасности предусматривают выполнение любой работы в перчатках, во время операции необходимо применять специальные маски и очки. При попадании крови и других биологических жидкостей на кожу необходима обработка антисептиками. Инструменты после использования замачивают в 3% растворе хлорамина на 30 мин или 6% перекиси водорода на 90 мин.
18. Профилактика имплантационной инфекции. Методы стерилизации шовного материала, дренажей, скобок и др. Лучевая (холодная) стерилизация.
К материалам, имплантируемым в организм человека, относят шовный материал, скрепки, скобки, протезы сосудов, суставов, ткани и органы, дренажи, катетеры, шунты.
Шовный материал стерилизуют гамма-излучением в заводских условиях. Металлический шовный материал стерилизуют в автоклаве или кипячением. Капрон, лавсан, лен, хлопок можно стерилизовать по методу Кохера. Это вынужденный метод, он предусматривает механическую очистку шовного материала горячей водой с мылом. Мотки моют в мыльной воде в течение 10 мин, дважды меняя воду, затем отмывают от моющего раствора, высушивают и наматывают на стеклянные катушки, которые помещают в банки с притертой пробкой и заливают диэтиловым эфиром на 24 часа для обезжиривания, после чего перекладывают в банки с 70% спиртом на такой же срок. После этого шелк кипятят в течение в течение 10-20 мин в растворе дихлорида ртути 1:1000 и перекладывают в герметичные банки с 96% спиртом. Через 2 сут проводят бак.контроль.
Стерилизация кетгута химическим способом предусматривает предварительное обезжиривание, для чего нити кетгута помещают в герметичные банки с диэтиловым эфиром на 24 часа. При стерилизации по Клаудиусу эфир из банки сливают, кетгут заливают на 10 сут водным раствором Люголя, затем заменяют на свежий и оставляют еще на 10 сут. После этого раствор Люголя заменяют 96% спиртом и через 4-6 сут проводят контроль на стерильность. Метод Губарева предусматривает стерилизацию кетгута спиртовым раствором Люголя в течение 20 сут.
Лучевая стерилизация осуществляется гамма-лучами. Используются изотопы кобальта и цезия. Доза проникающей радиации должна быть значительной.
Виды шовного материала. Стерилизация.
Существует более 40 видов шовного материала. Применяют рассасывающиеся и нерассасывающиеся нити. Рассасывающимися являются нити из кетгута, дексона, викрила. Нерассасывающиеся нити — из шелка, хлопка, конского волоса, льна, капрона, лавсана, нейлона.
Шовный материал должен удовлетворять следующим требованиям:
иметь гладкую, ровную поверхность, не вызывать при проколе дополнительного повреждения тканей.
Обладать хорошими манипуляционными свойствами.
Быть прочным в узле, не обладать гигроскопичными свойствами.
Быть биологически совместимым с живыми тканями, не оказывать аллергического действия на организм.
Разрушение нитей должно совпадать со сроками заживления раны.
Шовный материал стерилизуют гамма-излучением в заводских условиях. Металлический шовный материал стерилизуют в автоклаве или кипячением. Капрон, лавсан, лен, хлопок можно стерилизовать по методу Кохера. Это вынужденный метод, он предусматривает механическую очистку шовного материала горячей водой с мылом. Мотки моют в мыльной воде в течение 10 мин, дважды меняя воду, затем отмывают от моющего раствора, высушивают и наматывают на стеклянные катушки, которые помещают в банки с притертой пробкой и заливают диэтиловым эфиром на 24 часа для обезжиривания, после чего перекладывают в банки с 70% спиртом на такой же срок. После этого шелк кипятят в течение в течение 10-20 мин в растворе дихлорида ртути 1:1000 и перекладывают в герметичные банки с 96% спиртом. Через 2 сут проводят бак.контроль.
Стерилизация кетгута химическим способом предусматривает предварительное обезжиривание, для чего нити кетгута помещают в герметичные банки с диэтиловым эфиром на 24 часа. При стерилизации по Клаудиусу эфир из банки сливают, кетгут заливают на 10 сут водным раствором Люголя, затем заменяют на свежий и оставляют еще на 10 сут. После этого раствор Люголя заменяют 96% спиртом и через 4-6 сут проводят контроль на стерильность. Метод Губарева предусматривает стерилизацию кетгута спиртовым раствором Люголя в течение 20 сут.
Виды антисептики. Характеристика физической и механической антисептики: определение, задачи и методы.
Различают механическую, физическую, химическую и биологическую антисептику.
Механическая антисептика.
Удаление из инфицированной, гнойной раны, гнойного очага нежизнеспособных тканей, гноя, фибрина. Варианты механической антисептики предусматривают ПХО раны, целью которой является иссечение краев, стенок и дна раны в пределах здоровых тканей. Вместе с иссекаемыми тканями из раны удаляют кровоизлияния, гематомы, сгустки крови, инородные тела. Если в инфицированной ране начала развиваться микробная флора, или рана с самого начала носит гнойный характер, применяют ВХО раны. Иссечение при этом не производится, а удаляются механическим путем — скальпелем, ножницами, вакуумом, промыванием струей жидкости под давлением — некротизированные ткани, гной, фибрин. Вскрывают гнойные карманы, эвакуируют затеки. При этом также удаляется и микробная флора. Туалет раны также носит элементы механической антисептики. Удаление пропитанных кровью, гноем повязок, тампонов, промывание раны струей жидкости просушивание раны способствуют удалению из нее микробной флоры.
Физическая антисептика.
Методы основаны на использовании законов капиллярности, гигроскопичности, диффузии, осмоса, принципа сифона, воздействия лазера и ультразвука.
Дренирование ран, гнойных очагов предусматривает создание условий для оттока раневого отделяемого во внешнюю среду. Его можно производить с помощью марлевых тампонов, тампона Микулича-Радецкого, резиновых трубок разного размера. Используется также проточно-промывной дренаж. Если дренируемая полость герметична, применяют активную аспирацию — вакуумное дренирование.
Абактериальная среда.
Лазерное излучение малой мощности. На стенках и дне раны под воздействием лазера образуется тонкая коагуляционная пленка, препятствующая проникновению в ткани микроорганизмов.
Ультразвук в жидкой среде проявляет физические и химические свойства. В среде, подвергшейся воздействию УЗ, создается эффект кавитации, также происходит ионизация воды, под влиянием чего в микробной клетке прекращаются окислительно-восстановительные процессы.
Химическая, биологическая и смешанная антисептика. Определение. Задачи и методы.
Химическая антисептика.
Используются вещества, позволяющие создать высокую концентрацию антибактериального препарата непосредственно в очаге воспаления. Местное применение — использование повязок с антисептическими препаратами при лечении ран и ожогов, мазей, присыпок. Введение растворов в рану, закрытые полости с последующей аспирацией через дренажи. Для санации брюшной полости применяют препараты, допустимые для внутривенного введения. Общее применение включает прием препаратов внутрь с целью местного воздействия на микрофлору ЖКТ и общего воздействия на организм после всасывания в кровь. Внутривенное введение некоторых препаратов.
Предусматривает использование средств биологической природы.
Антибиотики:
Протеолитические ферменты. Лизируют некротизированные ткани, фибрин, гной, оказывают противоотечное действие и усиливают лечебное воздействие антибиотиков. Животного происхождения — трипсин, химотрипсин, рибонуклеаза, коллагеназа. Бактериального происхождения — террилитин, стрептокиназа, аспераза. Растительного — папаин, бромелаин. Применяют местно при лечении гнойных ран, трофических язв в виде растворов или порошков. Растворы ферментов используют для внутриполостного введения — в плевральную полость при гнойном плеврите, полость сустава при гнойном артрите, полость абсцесса. При лечении воспалительных инфильтратов применяют электрофорез ферментов. Как противовоспалительные средства трипсин и химотрипсиин вводят внутримышечно.
Бактериофаги.
Используют антистафилококковый, антистрептококковый бактериофаги, бактериофаг анти-коли. Есть также поливалентные бактериофаги. Используют для орошения ран, инфильтрации окружающих рану тканей, введения в гнойные полости, при сепсисе — внутривенно.
Анатоксины.
Применяют для активной иммунизации. Стафилококковый и столбнячный анатоксины.
Антистафилококковая, антисинегнойная, антиколибациллярная гипериммунные плазмы.
Антистафилококковый и противостолбнячный гамма-глобулины.
Иммунностимулирующие препараты — продигиозан, левамизол, лизоцим, экстракт тимуса.
Смешанная антисептика — сочетание разных видов антисептики. Применяется для повышения эффективности действия.
Биологическая антисептика. Классификация антибиотиков. Характеристика.
Основные виды антибиотиков:
пенициллины. Одни из наиболее эффективных. Природный пенициллин — бензилпенициллина натриевая или калиевая соли. Полусинтетические — ШСД(ампициллин, карбенициллин) ; пенициллиназоустойчивые — оксациллин.
Цефалоспорины. Нарушают синтез клеточной стенки. ШСД.
Стрептомицины. Подавляют функцию рибосом. ШСД. Ототоксичны, нефротоксичны, гепатотоксичны, угнетают гемопоэз.
Тетрациклины. Подавляют функцию рибосом. ШСД. Гепатотоксичны.
Макролиды. Нарушают синтез белка, гепатотоксичны, возможно нарушение функции ЖКТ.
Аминогликозиды. Нарушают синтез клеточной стенки, ШСД. Ото- и нефротоксичны.
Левомицетины. Нарушают синтез белка, ШСД. Угнетают гемопоэз.
Фторхинолоны. Подавляют ДНК-гиразу. ШСД.
Антисептические средства. Механизм действия. Классификация. Характеристика.
Химические антисептики:
галоиды. Йод, спиртовый раствор. Для наружного применения. Йодинол, 1% раствор. Для наружного применения, полоскания. Йодонат и йодопирон. 1% растворы, для обработки операционного поля. Повидон-йод. Для обработки кожи и ран. Раствор Люголя — для стерилизации кетгута. Хлорамин Б, 1-3% раствор для дезинфекции.
Соли тяжелых металлов. Сулема — 1:1000 для дезинфекции. Нитрат серебра — наружный антисептик. Протаргол, колларгол — для смазывания слизистых, промывания мочевого пузыря.
Спирты. Этиловый спирт — для обработки рук, операционного поля.
Альдегиды. Формалин — 0,5 — 5% растворы для дезинфекции.
Фенолы. Карболовая кислота. Тройной раствор — формалин, карболовая кислота, сода и вода. Для дезинфекции.
Красители. Бриллиантовый зеленый, метиленовый синий.
Кислоты. Борная кислота, салициловая кислота.
Щелочи. Аммиак.
Окислители. Перманганат калия, перекись водорода.
Детергенты. Хлоргексидин, дегмицид, церигель.
Производные нитрофурана. Фурацилин, фурадонин.
Основные виды антибиотиков:
пенициллины. Одни из наиболее эффективных. Природный пенициллин — бензилпенициллина натриевая или калиевая соли. Полусинтетические — ШСД(ампициллин, карбенициллин) ; пенициллиназоустойчивые — оксациллин.
Цефалоспорины. Нарушают синтез клеточной стенки. ШСД.
Стрептомицины. Подавляют функцию рибосом. ШСД. Ототоксичны, нефротоксичны, гепатотоксичны, угнетают гемопоэз.
Тетрациклины. Подавляют функцию рибосом. ШСД. Гепатотоксичны.
Макролиды. Нарушают синтез белка, гепатотоксичны, возможно нарушение функции ЖКТ.
Аминогликозиды. Нарушают синтез клеточной стенки, ШСД. Ото- и нефротоксичны.
Левомицетины. Нарушают синтез белка, ШСД. Угнетают гемопоэз.
Фторхинолоны. Подавляют ДНК-гиразу. ШСД.
studfiles.net
Технология стерилизации в медицинском автоклаве
Чтобы обеспечить полную стерильность медицинских инструментов оптимальным вариантом служит обработка инвентаря в специальном оборудовании – автоклаве.

Стерилизация: принципы работы автоклава
Обезжиривание инструментов происходит под действием насыщенного пара в температурном диапазоне 120-132 С. Давление – 1,5-2 am. При этом происходит стерилизация и обезжиривание, которое не влияет на характеристики и функциональные возможности обрабатываемых элементов. Режимы стерилизации в автоклаве существенно отличаются и зависят от вида инструмента, который находится в устройстве. Оборудование универсальное, подходит для воздействия на различные виды инструментов:
Автоклав для стерилизации маникюрных инструментов
Инвентарь косметологического кабинета нуждается в тщательной и регулярной обработке. С помощью оборудования можно полностью обезжирить и очистить от бактерий любой косметологический инструмент. Если вы планируете купить автоклав для стерилизации маникюрных инструментов, цена на него в «Мед-Тех» вас приятно удивит.
Стерилизация стоматологических инструментов в автоклаве
Инвентарь зубной больницы – еще одна группа инструментов, которые подлежат обработке. Компактное оборудование отлично подходит для очистки хирургических элементов, скейлеров, также можно использовать автоклав для стерилизации наконечников в стоматологии.
Стерилизация биксов в автоклаве
Стерилизация перевязочного материала в автоклаве также возможна. Ткани требует предварительной обработки. Время стерилизации в автоклаве может существенно изменяться, поскольку обработка коробок и барабанов с материалом – профилактическая процедура. Вместе с биксами может проводиться стерилизация перчаток в автоклаве, а также белья. Режимы стерилизации перчаток, белья и биксов в автоклаве стандартный. Обработка осуществляется с помощью высокой температуры и давления. Такой тандем позволяет пару проникать беспрепятственно во все конструкции, вне зависимости от сложности их устройства.
Режим стерилизации шприцев и игл в автоклаве
Для повышения бактерицидных свойств, а также дополнительной очистки изделий используется повышенный режим воздействия – продувку или удаление воздуха насосом.
Методы стерилизации в автоклаве
Процесс стерилизации в автоклаве происходит с помощью воздействия сильного давления и высоких температур. Создаваемый пар оказывает дезинфицирующую, антибактериальную и очистительную функцию. Мощность потока позволяет ионам проникать даже в самые мелкие и удаленные отверстия любого обрабатываемого инвентарная. Контроль и режим стерилизации инструментов в автоклаве происходит по двум основным типам:
- Для инвентаря, устойчивого к коррозии – ткани, стекло, стойкие металлы.
При давленими 2 атм, температура стерилизации в автоклаве – 132 °С. длительность процедуры – 20 минут. - Для резиновых, латексных и полимерных изделий – перчатки, жгуты, зонды, катетеры.
Режим работы автоклава во время стерилизации существенно отличается. Потребуется 45 минут времени, а также давление 1,1 атм и температура 120°С.
Давление при стерилизации в автоклаве, а также время обработки является ключевым моментом при воздействии на различные типы медицинских инструментов.
У нас на сайте вы сможете найти полную таблицу стерилизации в автоклаве, в которой отмечены данные, позволяющие использовать стерилизатор максимально эффективно и безопасно. Выбирая режимы стерилизации инструментов в автоклаве на основе данных по режимам стерилизации в автоклаве, таблица по которым доступна всем, можно избежать длительного процесса настройки и подгонки, а также негативных последствий.
Автоклав для стерилизации – устройство от «Тех- Мед»
Наша компания предлагает разнообразное оборудование для различных типов медицинских учреждений. Вы сможете подобрать компактные варианты с паровой стерилизацией, автоклавы по доступной цене, а также сложные, многопрофильны системы, с большим количеством режимов. Кроме этого, всегда доступен большой выбор пакетов и упаковок для стерилизации в автоклаве.
Стерилизация паром в автоклаве – это удобный и эффективный метод обработки медицинских и хирургических инструментов. Хотите приобрести? Продукция нашей компании для вас!
teh-med.ru
Паровой метод стерилизации (автоклавирование)
При паровом методе стерилизации (автоклавирование) стерилизующим средством является водяной насыщенный пар под избыточным давлением, температурой 120-132 °С; стерилизацию осуществляют в паровых стерилизаторах (автоклавах).
Паровой стерилизатор – металлический шкаф с прочными стенками, состоящий из двух котлов: водопаровой и стерилизационной камер, вставленных друг в друга и герметически закрывающихся крышкой при помощи крепёжных винтов. Аппарат снабжён манометрами, некоторые виды снабжены термометром и таймером.
В зависимости от конструкций различают паровые стерилизаторы со встроенным или внешним парогенератором, вертикальные или горизонтальные.
| Режим стерилизации | Контроль качества стерилизации | Наименование объектов | Вид упаковочного материала | ||
| T,oC | Р, атм | Время, мин | |||
| 2,0 | — Мочевина — Термоиндикаторная лента ИС-132 | ® Перевязочный и шовный материал; ® Хирургическое белье; ® Изделия из металла и стекла | Стерилизационная коробка б/фильтра Двойная упаковка из бязи Буга мешочная непропитанная Бумага мешочная влагопрочная Бумага крепированная для медицинских целей (однослойная упаковка) Срок хранения 3 суток Стерилизационная коробка с фильтром Бумага крепированная для медицинских целей (двухслойная упаковка) Срок хранения 20 суток | ||
| 1,1 | — Бензойная кислота — Термоиндикаторная лента ИС-120 | Изделия из резины, латекса,полимерных материалов |
Химическая стерилизация
Стерилизация растворами химических препаратов
Данный метод следует применять для стерилизации изделий, в конструкцию которых входят термолабильные материалы, не позволяющие использовать физические методы стерилизации.
Конструкция изделия должна позволять стерилизовать его растворами химических средств.
При стерилизации растворами химических средств используют стерильные емкости из стекла, металлов, термостойких пластмасс, выдерживающих стерилизацию паровым методом, или покрытые эмалью.
Стерилизацию проводят при полном погружении сухих изделий в раствор, разъемных — в разобранном виде. Каналы и полости заполняют раствором.
После стерилизации все манипуляции проводят, строго соблюдая правила асептики. Изделия извлекают из раствора с помощью стерильных пинцетов (корнцангов), удаляют раствор из каналов и полостей, а затем промывают дважды в стерильной жидкости, выдерживая экспозицию по 5 минут (согласно рекомендациям методического документа по применению конкретного средства). Промытые стерильные изделия после удаления остатков жидкости используют сразу по назначению или помещают с помощью стерильных пинцетов, корнцангов на хранение в стерильную стерилизационную коробку, выложенную стерильной простыней, на срок не более 3 суток.
ПРИНЦИПЫ ОБЕСПЕЧЕНИЯ СТЕРИЛЬНОСТИ
— К стерильному предмету прикасайтесь только другим стерильным предметом, чтобы избежать контаминации.
— Держите стерильные предметы всегда на уровне выше пояса.
— Стерильное поле всегда должно быть в пределах види-мо-сти.
— Старайтесь не говорить, не кашлять, не чихать или не наклоняться над стерильной поверхностью, так как приходящие при этом в движение потоки воздуха содержат микроорганизмы.
— Пограничную зону вокруг стерильного поля шириной около 2,5 см считают потенциально зараженной.
— Не допускайте промокания салфеток над стерильной поверхностью, так как любая жидкость проникает сквозь гкань, а вместе с ней и микроорганизмы.
— Если стерильный предмет коснулся нестерильного, всё стерильное поле считают загрязненным, подготавливают новое стерильное поле.
— Считайте предмет загрязненным, если вы не уверены в его стерильности.
infopedia.su
Воздушный метод стерилизации: режимы. Стерилизация изделий медицинского назначения: воздушный метод стерилизации (сухой горячий воздух)
Спасать человеческие жизни – это очень ответственная задача, возложенная на медицинских работников. И чтобы качественно справиться с ней, важно использовать простерилизованные, чистые медицинские инструменты. В статье подробно рассмотрим воздушный метод стерилизации и его особенности, положительные и отрицательные стороны.
Что такое стерилизация медицинских принадлежностей?
Стерилизация – это очищение медоборудования, удаление с его поверхности микробов, их спор, вирусов путем химического и физического воздействия. Медицинское изделие является стерильным, когда его вероятная биологическая нагрузка меньше или равна 10 в -6 степени. Все, в том числе и воздушный метод стерилизации, применяется для изделий из металла, стекла (подробнее рассмотрим ниже), которые контактируют с кровью человека, с поверхностью ран, прикасаются к слизистым оболочкам и могут нарушить их целостность.
Основные этапы стерилизации
Весь процесс стерилизации состоит из трех этапов:
- Дезинфекция медицинских принадлежностей.
- Проведение тщательной предстерилизационной очистки.
- Непосредственно стерилизация.
Важно помнить, что стерилизация изделий медицинского назначения (воздушный метод) будет проведена качественно только при последовательном выполнении всех трех этапов. В противном случае на инструментах могут остаться микроорганизмы, которые при контакте с ранами или слизистой оболочкой приведут к заражению. Паровой, воздушный методы стерилизации очень похожи между собой, но у них есть существенные различия в режимах работы. Рассмотрим подробнее.
Главные требования к стерилизации мединструментов
Стерилизация является сложным процессом, поэтому для качественного ее проведения нужно соблюдать некоторые требования:
- Эффективное очищение.
- Необходимые упаковочные материалы.
- Упаковка медицинских инструментов должна проходить с соблюдением всех правил.
- Загружать стерилизатор медицинскими изделиями нужно по определенной технологии.
- Мединструменты, которые подвергаются стерилизации, должны быть отличного качества и в строго соблюдаемом количестве.
- После проведения стерилизации материал нужно правильно хранить, умело обращаться с ним и соблюдать правила транспортировки.
Весь процесс стерилизации инструментов проводится с того момента, когда была закончена операция, и до момента, когда инструмент сложен на хранение (либо до следующего использования). Правильно проведенная дезинфекция обеспечит стерильность и продлит возможный срок использования инструментов.

Все, в том числе и воздушный метод стерилизации, проводится по следующему алгоритму:
- Провести механическую очистку использованного инструмента.
- Проверить, нет ли повреждений на поверхности.
- Затем помыть изделия.
- Потом инструменты сушатся.
- Затем их нужно сложить в стерилизационную упаковку.
- Проводится непосредственно стерилизация.
- После этого изделия хранятся в стерильном месте или используются при ближайшей необходимости. При правильной упаковке мединструменты могут храниться от суток до полугода.
Воздушный метод стерилизации
Способ воздушной стерилизации используется для обработки медицинских изделий, деталей аппаратов, которые сделаны из металлов, устойчивых к коррозии, стеклянных изделий с пометкой 200°С, а также резиновых медицинских изделий.
Перед стерилизацией нужно обязательно провести предстерилизационную очистку и тщательно высушить инструменты при температуре 85°С. Для сушки используют специальный сушильный шкаф. Весь процесс стерилизации по времени занимает около 2,5 часа (150 минут).
Предстерилизационная обработка медицинских изделий
Воздушный метод стерилизации может быть использован только после тщательной подготовки инструментов к этому процессу.
Итак, предстерилизационная обработка – это мероприятия, с помощью которых с поверхности медицинских инструментов удаляют белковые, жировые и лекарственные загрязнения. Этот процесс помогает сделать стерилизацию более эффективной, снизить риск пирогенных реакций.
Для правильной подготовки инструментов к стерилизации:
- Готовят моюще-дезинфицирующий раствор и замачивают в нем использованные медицинские принадлежности.
- Используя ватно-марлевые тампоны или ершики, тщательно вымывают инструменты в этом же растворе. Особое внимание нужно уделить местам соединений (замкам, просветам каналов), так как именно в них скапливаются вредные микроорганизмы. Ершики после использования нужно помыть и оставить в сухом месте, а ватные тампоны – выбросить.
- Чистый инструмент прополаскивают в проточной воде, чтобы удалить следы и запах моющего раствора.
- После этого каждый мединструмент отдельно прополаскивают в дистиллированной воде в течение 30 секунд.
- После полоскания изделие тщательно высушивают. Его можно оставить сохнуть на открытом воздухе, а можно воспользоваться сухожаровым шкафом при температуре 85 градусов.
- После проведения всех этапов проводится контроль качества предстерилизационной обработки путем постановки проб.

Когда обработка закончена, можно приступать непосредственно к стерилизации инструментов сухим горячим воздухом.
Режимы воздушного метода
Воздушный метод стерилизации режимы имеет разнообразные. Каждый из них отличается температурой и временем стерилизации. Именно разнообразие режимов работы и делает таким популярным воздушный метод стерилизации (сухой горячий воздух). Таблица расположена ниже.
| Температура | Время | Контроль за процессом | ||
| Значение | Допустимое отклонение | Значение | Допустимое отклонение | |
| 160 | +/- 3 | 150 | +/- 5 | Левомицетин |
| 180 | +/- 3 | 60 | +/- 5 | Винная кислота, тиомочевина |
| 200 | +/- 3 | 30 | +/- 3 | Ртутный термометр |
Основной режим стерилизации воздушным методом – это температура 180°С и час времени. Такой режим является наиболее надежным и оптимальным.

Условия проведения воздушной стерилизации
Чтобы медицинские инструменты были продезинфицированы правильно сухим горячим воздухом, необходимо соблюдение некоторых условий:
- Стерилизовать можно только полностью высушенные изделия.
- Стерилизовать можно изделия, упакованные в мешочную непропитанную бумагу, устойчивую к влаге бумагу или вовсе без упаковки. В зависимости от выбора упаковки (или ее отсутствия) будет определено время хранения простерилизованных инструментов.
- Запрещена стерилизация х/б материала.
Максимальные сроки хранения стерильных инструментов
Если инструменты были простерилизованы в упаковке (в бумаге), то их стерильность сохранится на протяжении трех суток. Что касается изделий, которые обрабатывались сухим горячим воздухом без упаковки, то их необходимо использовать сразу же после окончания процесса стерилизации.
Порядок работы на стерилизаторе при воздушном способе
Для проведения стерилизации горячим сухим воздухом используют воздушный стерилизатор. Есть несколько правил, которые необходимо соблюдать, чтобы избежать некачественной обработки инструментов.
Во-первых, нельзя загружать все предметы в стерилизатор навалом, они все должны быть аккуратно разложены.
Во-вторых, большие инструменты, которые занимают много места, нужно класть на верхнюю полку. Таким образом поток горячего воздуха будет равномерно распределен.
В-третьих, сложные изделия, такие как ножницы или зажимы, нужно складывать в стерилизатор раскрытыми, чтобы обработка воздухом была более качественной. Шприцы надо класть в разобранном виде, а медицинскую посуду нельзя складывать одну в другую. То есть нельзя поместить стакан в стакан. Каждый инструмент должен быть отдельно разложен.

Алгоритм работы на воздушном стерилизаторе
- Стерилизатор не нужно предварительно разогревать, все инструменты складываются внутрь холодного оборудования.
- После этого его включают, и он нагревается.
- Когда стерилизатор нагреется до нужной температуры (180 градусов), начинается отсчет времени стерилизации (один час).
- По истечении времени оборудование выключают и ждут, пока оно остынет до 40-50 градусов.
- Затем достают обработанные медицинские инструменты.
Преимущества воздушного способа стерилизации
Воздушный метод стерилизации имеет неоспоримое преимущество перед паровым методом: низкая себестоимость необходимого оборудования.
Кроме того, есть и другие положительные качества:
- Такой метод обладает низкими коррозийными свойствами.
- Глубоко проникает в материал и обеспечивает качественную обработку.
- Не нуждается в аэрации.
- Не наносит вреда окружающей среде.

Недостатки стерилизации сухим горячим воздухом
Несмотря на ряд преимуществ, воздушный метод стерилизации имеет и отрицательные стороны.
Недостатки этого метода:
- Большая энергоемкость метода.
- Слишком длительный цикл. Для стерилизации необходимо минимум полчаса и дополнительное время (около часа) на нагревание и остывание оборудования.
- Таким способом невозможно стерилизовать тканевые и пластмассовые изделия.
- Многие металлические инструменты не очень хорошо переносят обработку такой высокой температурой: они теряют свои свойства и быстро тупятся.
Заключение
В статье мы подробно изучили самый известный и широко используемый метод стерилизации медицинских инструментов — обработка сухим горячим воздухом (воздушный способ), его особенности, положительные и отрицательные стороны. Именно этим методом пользуются большинство современных больниц.

В заключение хочется сказать, что неважно, какой метод стерилизации был выбран, главное, чтобы чистка и дезинфекция изделий были проведены качественно и с соблюдением всех правил.
businessman.ru
|
ТОП 10: |
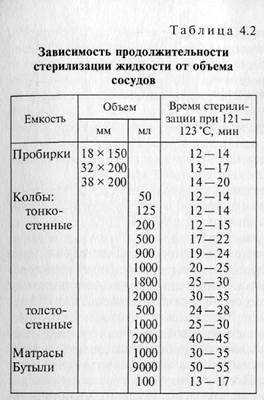
Семинар 3. Термические методы стерилизации МЕТОДЫ СТЕРИЛИЗАЦИИ Стерилизация является одним из важнейших и необходимых приемов в микробиологической практике. Слово «стерилизация» в переводе с латинского означает «обеспложивание». В практической работе под стерилизацией понимают методы, применяемые для уничтожения всех форм жизни как на поверхности, так и внутри стерилизуемых объектов. Микробиологи стерилизуют питательные среды, посуду, различные инструменты и другие необходимые предметы с целью не допустить развитие посторонних микроорганизмов в исследуемых культурах. Термин «стерильность» имеет абсолютное значение. Можно говорить только либо о стерильности, либо о нестерильности, но не может быть состояния «частичной или неполной стерильности», «близкого к стерильному», «почти стерильного». Различают термическую и холодную стерилизацию. В микробиологии находят применение следующие способы термической стерилизации: прокаливание в пламени и обжигание, сухожаровая стерилизация (горячим воздухом), стерилизация насыщенным паром под давлением (автоклавирование), дробная стерилизация (тиндализация), кипячение. Из методов холодной стерилизации микробиологи используют стерилизацию фильтрованием, газообразными средствами, ультрафиолетовыми лучами и другими видами излучений. Возможность и целесообразность применения того или иного способа определяются в первую очередь физико-химическими свойствами материала, подлежащего стерилизации, а иногда и целью исследования. Процесс автоклавирования. Отдельные операции процесса стерилизации в автоклавах разных типов могут быть несколько различными. Соответственно несколько различается и техника работы с ними, однако общий принцип проведения стерилизации в разных автоклавах одинаковый. Перед работой осматривают автоклав и контрольно-измерительную аппаратуру. При наличии любой неисправности (смещение стрелки манометра с нуля, трещина на водомерной трубке и др.) работать с прибором нельзя. После осмотра автоклава в водопаровую камеру наливают воду до верхней отметки на водомерной трубке. В стерилизационную камеру на специальную подставку из дерева помещают стерилизуемый материал. Предметы следует размещать не слишком плотно, так как пар должен свободно проходить между ними, иначе они не нагреются до нужной температуры и могут остаться нестерильными. Загрузив стерилизационную камеру, устанавливают и плотно завинчивают крышку (дверь) автоклава. Затем открывают кран, соединяющий стерилизационную камеру с наружным воздухом, и включают нагрев. После начала парообразования удаляют воздух из стерилизационной камеры. Это необходимое условие стерилизации, так как при одном и том же давлении температура чистого пара выше температуры смеси пара и воздуха. Если в автоклаве останется воздух, материал может не простерилизоваться. Наиболее простой и очень распространенный способ освобождения автоклава от воздуха — вытеснение воздуха паром. Пар и конденсат отводят либо в сосуд с водой, либо в специальное устройство, соединенное с канализацией. В первом случае на кран (2) надевают резиновый шланг, который опускают в воду. Началом продувания считается появление устойчивой непрерывной струи чистого пара. Пока в автоклаве еще имеется воздух, смесь воздуха и пара, проходя через воду, издает сильный треск. Чистый пар выходит с равномерным шипящим звуком. Его пропускают в течение 10 мин. В целом вся операция с момента появления пара с воздухом должна занимать не более 15 — 20 мин, иначе в автоклаве останется мало воды и он может испортиться. Чтобы уменьшить расход пара (воды), кран открывают не полностью. Степень открывания крана устанавливают на практике при эксплуатации автоклава. В наиболее совершенных автоклавах воздух из стерилизационной камеры удаляют с помощью вакуумного насоса. Когда воздух вытеснен, закрывают пароотводной кран, и давление пара доводят до показания, соответствующего режиму стерилизации. Режим автоклавирования часто выражают в единицах избыточного давления, указывая при этом длительность его поддержания, например стерилизация при 1 ати в течение 20 мин. На манометре автоклава обозначается именно то избыточное давление, которое создается в автоклаве сверх нормального. Нередко режим автоклавирования характеризуется температурой и временем. Как только стрелка манометра дойдет до указателя определенного дополнительного давления и, следовательно, температура пара достигнет соответствующего значения, этот уровень давления пара поддерживают в течение необходимого времени путем ручного или автоматического регулирования подачи пара. В автоматических автоклавах подачу пара регулируют электроконтактным манометром. По окончании времени стерилизации выключают нагрев автоклава. Давление в автоклаве постепенно падает и сравнивается с атмосферным. Лишь после этого открывают кран, выводящий пар. Преждевременное открывание крана недопустимо, так как перегретые среды при резком снижении давления сразу же бурно закипают, смачивают и даже иногда выталкивают ватные пробки, что нарушает стерильность материала. Когда пар выйдет, открывают крышку (дверь) автоклава, соблюдая при этом осторожность во избежание ожога паром лица и рук. Удаление пара из стерилизационной камеры автоклавов, оснащенных вакуумным насосом, осуществляют с помощью насоса. Одновременно происходит подсушивание стерильного материала. Поскольку автоклав работает при высоких давлениях и температурах, неправильное обращение с ним может быть причиной несчастных случаев. Установка автоклава и работа с ним производятся при точном и строгом выполнении правил, указанных в прилагаемой к автоклаву инструкции. К работе допускаются только подготовленные лица, имеющие специальное разрешение. При необходимости проконтролировать температуру в автоклаве пользуются разными веществами, плавящимися при определенной температуре. Эти вещества предварительно смешивают с нейтральными красителями и помещают в автоклав до начала стерилизации. В качестве индикаторов температуры используют фенантрен (температура плавления 98—100°С), бензаурин (115°С), серу (119 °С), бензойную кислоту (121 — 122 °С), мочевину (132°С), глюкозу (146°С), тиомочевину (180°С), аскорбиновую кислоту (187— 192 °С). На 100 г этих веществ берут 0,01 г красителя (фуксин, метиленовый синий), тщательно смешивают, рассыпают в стеклянные трубочки с одинаковым диаметром и толщиной стенок, запаивают и в вертикальном положении раскладывают между стерилизуемым материалом в автоклаве. По достижении в сосуде соответствующей температуры эти вещества расплавляются и окрашиваются в цвет добавленного в них красителя. Подготовка сред к стерилизации. При автоклавировании 3 — 5 % жидкости теряется в результате испарения, поэтому рекомендуется в приготавливаемые среды добавлять сверх объема примерно 5 % дистиллированной воды. Тогда после стерилизации среда (раствор) будет иметь требуемую концентрацию. Среды обычно стерилизуют в пробирках, колбах, бутылях. Емкости заполняют средой не более чем на половину их высоты, чтобы предотвратить смачивание пробок. Сосуды со средами закрывают ватными пробками. Они предохраняют среду от заражения микроорганизмами, находящимися в окружающем воздухе. Пробки должны быть достаточно плотными, чтобы выполнять эту функцию, но с достаточно равномерным распределением волокон ваты, так как через них происходит газообмен культур с окружающей средой. Слишком плотные пробки затрудняют снабжение культур воздухом. Для приготовления пробки плоский кусок ваты, взятый вдоль волокна, скатывают валиком. Чтобы придать пробке прочность, ее прокатывают между ладонью и чистым стеклом, лежащим на столе. Длина пробки для обычной пробирки примерно 4 см. Пробка должна входить в пробирку на 1,5 — 2,0 см (рис. 4.2). Для сохранения формы пробку вынимают из горлышка, слегка вращая. Удобно обернуть пробку чистой марлевой салфеткой. Перед стерилизацией пробки можно прикрыть бумажными колпачками. Нельзя обертывать пробки сосудов, которые будут стерилизоваться в автоклаве, целлофаном, фольгой или другими материалами, не пропускающими пар, так как пар должен проникать через пробку в сосуд, иначе среды не нагреются до нужной температуры и не простерилизуются. При использовании стеклянных, резиновых, корковых и других пробок их завертывают в двойной слой оберточной бумаги и стерилизуют привязанными к склянке, закрытой ватной пробкой. Пробки в сосуде меняют стерильно около пламени горелки. Подготовка посуды к стерилизации. Посуда перед стерилизацией должна быть тщательно вымыта и завернута в бумагу для сохранения стерильности после прогревания. Посуду развертывают непосредственно перед употреблением. В верхние концы пипеток вставляют ватные тампоны. Торчащие из пипеток волокна ваты сжигают в пламени горелки. Пипетки заворачивают в длинные полоски бумаги шириной 4 — 5 см. Обмотку начинают с оттянутого конца и постепенным движением бумаги по спирали заканчивают у конца с ватным тампоном. Завернутые пипетки для предохранения бумаги от загрязнения и разрывов перед стерилизацией упаковывают по несколько штук вместе или помещают в специальные металлические или картонные пеналы. Чашки Петри обычно заворачивают в пакеты по 2 —4 штуки, шпатели — по отдельности, но затем, как и пипетки, их объединяют в общий сверток. Колбы, пробирки и трубки Бурри закрывают ватными пробками. На пробки можно надеть бумажные колпачки, предохраняющие горлышко от пыли. Стерилизация. Посуду, подготовленную для стерилизации, загружают в стерилизатор (или сушильный шкаф) не слишком плотно, чтобы обеспечить циркуляцию воздуха и равномерный надежный прогрев стерилизуемого материала. Стерилизатор (сушильный шкаф) во время работы должен быть плотно закрыт. При отсутствии терморегулятора необходимо строго следить за температурой, так как при ее понижении не осуществится стерилизация, а при нагреве выше 180 °С бумага и пробки начинают обугливаться. По окончании стерилизации шкаф не открывают до тех пор, пока температура в нем не упадет до 80 °С, поскольку при резком охлаждении иногда нарушается стерильность материала, а сильно нагретое стекло может растрескаться. Лучше всего выгружать посуду, когда температура в стерилизаторе сравняется с комнатной. Посуду можно стерилизовать и в автоклаве. Режим стерилизации в этом случае существенно зависит от объема сосудов и толщины стекла (см. табл. 4.2). Для автоклавирования посуду готовят, как и для сухожаровой стерилизации. Следует иметь в виду, что в автоклаве посуда увлажняется. Стерилизация фильтрованием.
Фильтрованием стерилизуют синтетические среды строго определенного состава, которые содержат легкоразрушающиеся или летучие компоненты — витамины, аминокислоты (цистеин и цистин), белки, ароматические углеводороды, антибиотики и др. Фильтрование жидкостей осуществляют через мелко -пористые материалы, легко адсорбирующие клетки микроорганизмов: асбест, целлюлозу, фарфор, каолин и т.д. Стерилизующими фильтрами теоретически считают такие, размер пор которых не превышает 0,7 мкм. В практике же пригодность фильтров для стерилизации устанавливают путем пробной фильтрации через них суспензии какого-нибудь мелкого микроорганизма, например Serratia marcescens. Для проверки на стерильность фильтрат в большом количестве высевают на питательную среду. Если в течение 5 сут тест-организм не вырастет, фильтры могут быть использованы для стерилизации. Широкое распространение получили мембранные фильтры. Это диски разного размера, диаметра, напоминающие бумажные. Их готовят на основе нитроцеллюлозы. Мембранные фильтры в зависимости от величины пор применяют для фильтрования и стерилизации. Для стерилизации используют фильтры с номера 1 до номера 4 фирмы «Владипор» (Россия), фильтры с номера 5 до номера 10 фирмы «СИНПОР» (Чехия) и марок VF, VM, VC, SLGS, SLHA, DA фирмы «МИЛЛИПОР» (США). Плотные диски, изготовленные из смеси асбеста с целлюлозой, называются фильтрами Зейтца. В зависимости от диаметра пор они обозначаются разными индексами: ЕК — поры диаметром 1,5 — 1,8 мкм; ЕКS — 1,2—1,5; ЕКS-1 — 1,0— 1,2; ЕКР — 0,8— 1,0 мкм. В России выпускают асбестовые фильтры марок Ф2 и СФ. Стерилизующими являются СФ-3 и СФ-4. Асбестовую пластинку помещают в специальный держатель, который обычно изготавливают из нержавеющей стали, и крепко зажимают винтами между верхней (цилиндрической) и нижней (воронкообразной) частями держателя. Трубка нижней части держателя через резиновую пробку проходит в колбу Бунзена. Нередко весь этот прибор в собранном виде называют фильтром Зейтца.
Для стерилизации используют стеклянные пористые фильтры, а также изготовленные из каолина с примесью кварцевого песка — «свечи» Шамберлана и из инфузорной земли — «свечи» Беркефельда. Пористость первых обозначается буквой L с цифрами от 1 до 13 соответственно уменьшению диаметра пор фильтра от 9 до 1,2 мкм. Мелкопористые «свечи» обозначаются маркой В, крупнопористые — F. Фильтры Беркефельда обозначают буквами V, N, W, что соответствует следующим размерам пор (мкм): 8—12, 5 — 7, 3 — 4.
Мембранные фильтры стерилизуют автоклавированием при 1 ати 15 мин или длительным кипячением. Держатель вместе с резиновой пробкой заворачивают в бумагу и автоклавируют при 1 ати 20 — 30 мин. Фильтры Зейтца автоклавируют в собранном виде. «Свечи» стерилизуют вместе с резиновыми пробками в автоклаве. Колбу Бунзена закрывают ватной пробкой, в отводную трубку вставляют тампон и стерилизуют горячим воздухом — сухим жаром. СТЕРИЛИЗАЦИЯ ИНСТРУМЕНТОВ И ПРИБОРОВ Мелкие металлические инструменты: петли, иглы, пинцеты, ножницы, шпатели — стерилизуют прокаливанием в пламени (т.е. нагреванием докрасна) непосредственно перед использованием. На пламени кратковременно обжигают предметные и покровные стекла, стеклянные шпатели и палочки, фарфоровые ступки и пестики, горлышки колб, пробирок, бутылок, а также ватные пробки при пересевах культур и разливах сред. В пламени погибают и вегетативные клетки, и споры микроорганизмов. Наряду со стерильными одноразовыми шприцами в лабораторной практике широко распространены традиционные шприцы многократного использования. Их лучше всего стерилизовать сухим жаром при 160 °С в собранном либо в разобранном виде. В первом случае длительность стерилизации 75 мин, во втором —60 мин. Собранные шприцы вместе с иглой стерилизуют в пробирке, закрытой ватной пробкой, разобранные заворачивают в бумагу или ткань. Можно стерилизовать шприцы и в автоклаве при 1 ати в течение 15 — 20 мин. Автоклавируют их только в разобранном виде, иначе они повреждаются. Прокаливать шприцы нельзя, так как от этого они портятся. Термостойкие приборы для культивирования микроорганизмов, а также детали к этим приборам, резиновые пробки и шланги стерилизуют в автоклаве. При этом емкости завертывают в бумагу. Режим автоклавирования выбирают в соответствии с термостойкостью материала, из которого сделан прибор. Некоторые предметы (металлические инструменты, мелкие стеклянные детали, мембранные фильтры) иногда стерилизуют длительным (в течение 20 — 30 мин) кипячением в дистиллированной воде. Металлические и стеклянные предметы лучше всего кипятить в специальных закрытых сосудах — стерилизаторах. Можно использовать для этой цели и металлическую посуду. Мембранные фильтры обычно кипятят в колбе или химическом стакане, закрытых ватными пробками. Однако этим способом стерилизации в микробиологической практике пользуются редко в связи с тем, что длительное кипячение может повредить обрабатываемый материал, а сокращение времени кипячения может не обеспечить стерильность, так как споры некоторых микроорганизмов способны сохранять жизнеспособность даже после длительного кипячения. Надежность стерилизации при кипячении может быть увеличена внесением в воду какого-либо бактерицидного средства: 2%-го формальдегида, 1%-й бриллиантовой зелени или 0,1%-й сулемы. Но в этом случае возможно загрязнение биоцидами стерилизуемых предметов. Стерилизация облучением. Для стерилизации помещений, оборудования, некоторых медицинских принадлежностей, пищевых продуктов используют разные виды излучений: инфракрасное, ультрафиолетовое, рентгеновские лучи, альфа-, бета-, гамма-лучи радиоактивных элементов. Единицей дозы облучения является радиан (1 рад = 0,01 Гр), который эквивалентен поглощенной энергии примерно в 100 эрг/г. Стерилизующими являются дозы облучения 2 — 3 Мрад (104Гр, или рад). Чаще других в микробиологической практике используют ультрафиолетовое облучение. Основные способы стерилизации питательных сред, посуды и других лабораторных материалов обобщены в табл. 4.4. Следует отметить, что все большее распространение получают посуда и инструменты одноразового использования.
Семинар 3. Термические методы стерилизации МЕТОДЫ СТЕРИЛИЗАЦИИ Стерилизация является одним из важнейших и необходимых приемов в микробиологической практике. Слово «стерилизация» в переводе с латинского означает «обеспложивание». В практической работе под стерилизацией понимают методы, применяемые для уничтожения всех форм жизни как на поверхности, так и внутри стерилизуемых объектов. Микробиологи стерилизуют питательные среды, посуду, различные инструменты и другие необходимые предметы с целью не допустить развитие посторонних микроорганизмов в исследуемых культурах. Термин «стерильность» имеет абсолютное значение. Можно говорить только либо о стерильности, либо о нестерильности, но не может быть состояния «частичной или неполной стерильности», «близкого к стерильному», «почти стерильного». Различают термическую и холодную стерилизацию. В микробиологии находят применение следующие способы термической стерилизации: прокаливание в пламени и обжигание, сухожаровая стерилизация (горячим воздухом), стерилизация насыщенным паром под давлением (автоклавирование), дробная стерилизация (тиндализация), кипячение. Из методов холодной стерилизации микробиологи используют стерилизацию фильтрованием, газообразными средствами, ультрафиолетовыми лучами и другими видами излучений. Возможность и целесообразность применения того или иного способа определяются в первую очередь физико-химическими свойствами материала, подлежащего стерилизации, а иногда и целью исследования. |
infopedia.su
8. Автоклав
Автоклав – аппарат для стерилизации и обеззараживания медицинских инструментов, принадлежностей, материалов под воздействием горячего водяного пара( текучим или паром под давлением). Автоклав представляет собой котел с двойными стенками, между которыми находится водопаровая камера. В нее через воронку вливают воду. Образующийся пар проходит в стерилизационную камеру, где расположен стерилизуемый материал. Обязательно наличие термометра и манометра.
Виды :стационарные и переносные, горизонтальные и вертикальные, с одно и двусторонней загрузкой, круглые и квадратные, общего и специального назначения, электрические, огневые, электроогневые
Упакованные предметы укладывают в камеру. Стерилизуют при 2 атм в течение 20 мин (t132), при 1,1 атм 45 мин (t120)
Выделяют 4 стадии стерилизации : нагревания, уравновешивания, уничтожения, время охлаждения.
Контроль стерильности: физический ( основан на достижении точки плавления – в автоклав ставят пробирку с веществом, которое должно расплавится), бактериологический посев, исследование температуры при стерилизации (термометр) ,использование стеритестов.
При этом способе стерилизации действующим агентом служит горячий пар. Стерилизацию просто текучим паром в настоящее время не используют, так как температура пара в обычных условиях (100 ?С) не достаточна для уничтожения всех микробов.
В автоклаве (аппарат для стерилизации паром под давлением) возможно нагревание воды при повышенном давлении (рис. 2-4). Это повышает точку кипения воды и соответственно температуру пара до 132,9 ?С (при давлении 2 атм).
Хирургические инструменты, перевязочный материал, бельё и другие материалы загружают в автоклав в специальных металлических коробках — биксах Шиммельбуша (рис. 2-5). Биксы имеют боковые отверстия, которые перед стерилизацией открывают. Крышку бикса плотно закрывают.
После загрузки биксов автоклав закрывают герметичной крышкой и проводят необходимые манипуляции для начала его ра- боты в определённом режиме.
Работу автоклава контролируют при помощи показателей манометра и термометра. Существует три режима стерилизации:
• при давлении 1,1 атм (t = 119,6 ?С) — 1 ч;
• при давлении 1,5 атм (t = 126,8 ?С) — 45 мин;
• при давлении 2 атм (t = 132,9 ?С) — 30 мин.
По окончании стерилизации биксы некоторое время остаются в горячем автоклаве для просушки при немного приоткрытой дверце. При извлечении биксов из автоклава закрывают отверстия в стенках биксов и отмечают дату стерилизации (обычно на прикреплённом к биксу кусочке клеёнки). Закрытый бикс сохраняет стерильность находящихся в нём предметов в течение 72 ч.
Рис. 2-4. Автоклав (схема). Аи Б — наружная и внутренняя стенки автоклава; 1 — термометр; 2 — водомерное стекло; 3 — впускной кран; 4 — выпускной кран; 5 — манометр; 6 — предохранительный клапан

9. Виды и принципы укладок материала в биксы для стерилизации. Виды стерилизации
Перевязочный материал и бельё стерилизуют автоклавированием при стандартных режимах. Перед стерилизацией перевязочный материал и бельё укладывают в биксы. Существует три основных вида укладки бикса: универсальная, целенаправленная и видовая укладки.
1-Универсальная укладка. Обычно используют при работе в перевязочной и при малых операциях. Бикс условно разделяют на секторы, каждый из них заполняют определённым видом перевязочного материала или белья: в один сектор помещают салфетки, в другой — шарики, в третий — тампоны и т.д.
2-Целенаправленная укладка. Предназначена для выполнения типичных манипуляций, процедур и малых операций. Например, укладка для трахеостомии, катетеризации подключичной вены, перидуральной анестезии и пр. В бикс укладывают все инструменты, перевязочный материал и бельё, необходимые для осуществления процедуры.
3-Видовая укладка. Обычно используют в операционных, где необходимо большое количество стерильного материала. При этом в один бикс, например, укладывают хирургические халаты, в другой — простыни, в третий — салфетки и т.д.
В небольшом количестве используют перевязочный материал в упаковках, прошедший лучевую стерилизацию. Существуют и специальные наборы операционного белья одноразового использования (халаты и простыни), изготовленного из синтетических тканей, также подвергшихся лучевой стерилизации.
Вначале проверяют исправность бикса, затем на его дно помещают развёрнутую простыню, концы которой находятся снаружи. Перевязочный материал укладывают вертикально по секторам пачками или пакетами. Материал укладывают неплотно, чтобы обеспечить доступ пара, внутрь помещают индикаторы режима стерилизации (максимальные термометры, плавящиеся вещества или пробирки с тест-микробом), края простыни заворачивают, бикс закрывают крышкой и защёлкивают замок. К крышке бикса прикрепляют бирку из клеёнки с указанием даты стерилизации и фамилии осуществлявшего её.
Существуют 3 основных режима стерилизации: 1) при давлении 1,1 атм – 1 час; 2) при давлении 1,5 атм – 45 мин; 3) при давлении 2 атм – 30 мин.
studfiles.net
Стерилизация автоклавированием — Справочник химика 21
Глюкоза — 10,0 г Дистиллированная вода — до 1 л Вначале растворяют веронал и желатин примерно в 250 мл воды при 56 °С, затем добавляют остальные реактивы. После стерилизации автоклавированием в течение 10 мин при 1 атм доводят pH до нужного значения. [c.110]На практике чаще всего используют влажную и сухую стерилизацию жаром, а также стерилизацию фильтрованием. Примером влажной стерилизации может служить стерилизация посуды и сред автоклавированием. [c.57]
Выбор режима автоклавирования. В микробиологической практике стерилизацию в автоклавах осуществляют при температуре в пределах 111—138°, т. е. 0,5 до 2,5 ати. Температура ниже 111° Не может считаться надежной температура выше 138°, как правило, не является необходимой, к тому же, чем выше давление пара, тем сложнее условия эксплуатации автоклава. При использовании автоклавов без вакуумных насосов наиболее надежными считаются следующие режимы стерилизации 15—45 мин при 121° (1 ати) и 10—30 мин при 128° (1,5 ати). Микробиологи чаще всего стерилизуют среды при 0,5 и 1 атг/. [c.33]
Прп оценке возможности применения иолимерных. материалов в медицине необ.ходимо учитывать их устойчивость к воздействию 1)азличных видов стерилизации обработке водяным паром прп избыточном давлении 12() кп М-, или 1,2 кгс/см» (автоклавирование) прогреву до 120—130 С в течение 30. ИИ (т. наз. сухожарная стерилизация) обработке этиленоксидом или др. газами (газовая стерилизация) обработке р-рами гидроперекисей, хлорамина, четвертичных аммониевых оснований и др. облучеишо -луча ш, ускоренными элет тронами (радиационная стерилизация). Механизмы процессов, протекаюнщх ири стерилизации полимерных материалов, еще мало изучены. [c.183]
Стандартные приемы стерилизации жидких сред описываются в гл. 23 этого руководства. Для предотвращения распада термолабильных компонентов среды используют стерилизацию фильтрованием. Небольшие объемы простых сред, используемых для культивирования бактерий, автоклавируют непосредственно перед их использованием, но для автоклавирования больших объемов [c.407]
Для достижения температур выше точки кипения воды пользуются автоклавом. Температура насыщенного пара зависит от давления (рис. вЛ2). При доступе воздуха определенному давлению соответствует значительно более низкая температура. Поскольку гибель микроорганизмов под действием влажного жара зависит от температуры, а не от давления, необходимо закрывать автоклав лишь после того, как воздух будет из него вытеснен водяным паром. Воздух удаляется вместе с выходящим паром или в результате отсасывания. При автоклавировании следует измерять температуру, а не давление, хотя по соображениям простоты и безопасности обычно все еще измеряют давление. Продолжительность стерилизации, естественно, зависит от объема (теплоемкости) сосудов, в которых ее проводят (табл. 6.6). [c.208]
При изучения химической и термической устойчивости смол испытание выдержала лишь смола КУ-2. Как уже указывалось, химическая и температурная устойчивость катионитов совершенно обязательны при работе с кровью, так как это обеспечивает неизменность состава крови и позволяет проводить ее заготовку в стерильных условиях. Следует подчеркнуть, что при каждой обработке крови катионит дважды подвергается стерилизации автоклавированием в течение 30 мин. при 120° и 1,2 атм. давления. Хотя катионит в течение 1,5 лет работы подвергался многочисленному автоклавированию и регенерации, каких-либо заметных изменений обменной емкости и других свойств установить не удалось. С увеличением числа регенераций смола только несколько светлеет. [c.189]
Стерилизация насыщенным паром под давлением (автоклавирование) [c.29]
Укупорку культуральных сосудов — пробки или завинчивающиеся крышки — подвергают такой же обработке, как и всю посуду 1) укупорку на этапе мытья с детергентом и последующим полосканием в горячей проточной воде можно подвергнуть кипячению 2) после мытья укупорку следует рассортировать по размерам и разложить в чашки Петри, затем завернуть чашки в бумагу или фольгу 3) стерилизовать (для этих изделий допустим только один способ стерилизации) автоклавированием в течение 30 мин при температуре 121 °С. [c.38]
Культивирование гриба на жидких средах без автоклавирования, перемешивания и принудительной аэрации проводят без предварительной стерилизации среды, ее просто нагревают до кипения, разливают в деревянные каркасы, покрытые изнутри полиэтиленовой пленкой. Среду, охлажденную до 35—40°С, засевают сухими спорами. Сверху каркасы закрывают полиэтиленовой пленкой, которую после образования спороносной пленки гриба снимают. [c.77]
Как добавлять субстрат Если микроорганизм не загрязнен и хорошо растет, то прибавлять к нему субстрат можно несколькими способами. В том случае, когда не требуется специального оборудования, следует открыть колбу, добавить в нее субстрат и снова закрыть колбу, естественно соблюдая все условия асептики. Правда, риск внести загрязнение в этом случае много меньше, чем в начале выращивания культуры, вследствие того что питание уже истощено, а сильно разросшаяся культура будет подавлять рост любого другого организма. Жидкие субстраты вносятся как таковые, а твердые субстраты, тщательно очищенные, иногда могут быть добавлены и сами по себе, но чаще всего используются их растворы. К счастью, обычно нет необходимости подвергать субстрат стерилизации, поскольку большинство органических соединений неустойчиво в условиях автоклавирования. Тем не менее для уменьшения риска внести загрязнение при применении водных растворов используют стерильную воду. [c.219]
Стерилизация посуды производится в сушильном шкафу при 160 С в течение 1 часа или в автоклаве при 1 атм в течение 30 минут. При правильно произведенной стерилизации в сушильном шкафу бумага, в которую завертывается посуда, слегка буреет. После автоклавирования посуда вместе с оберточной бумагой просушивается. [c.184]
Условия проведения микробиологических трансформаций стероидов являются общими для всех реакций с микроорганизмами. Необходимой предпосылкой работы с чистыми культурами является стерильность всех операций, позволяющая избежать заражений. Стерилизация, в зависимости от объекта, осуществляется автоклавированием при 110—120°, [c.46]
В результате испытаний по режиму дезинфекция, мойка и стерилизация с использованием моющего раствора «Новость» с переки-. СЬЮ водорода, стерилизации — химической (6% раствор перекиси водорода), воздушной и паровой (автоклавирование) коррозионные потери не превышали 0,001 г/м без изменения поверхности. [c.47]
&e
www.chem21.info

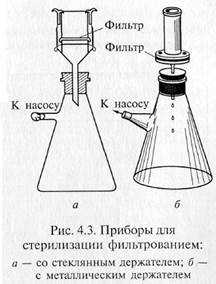
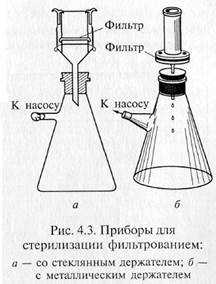
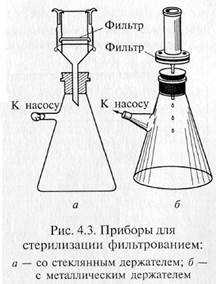
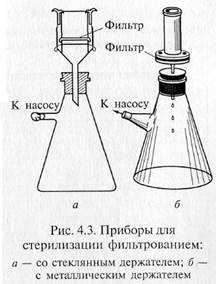
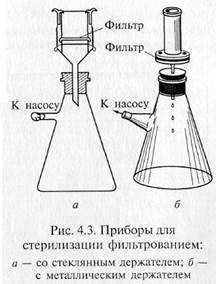
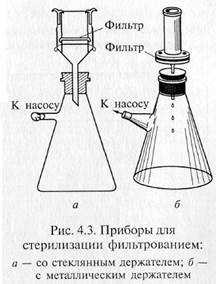
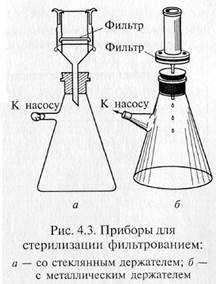 «Свечи» и специальные держатели с закрепленными в них асбестовыми фильтрами герметически соединяют с колбой Бунзена для фильтрации в вакууме (рис. 4.3). Перед употреблением фильтры, их держатели и приемник фильтрата должны быть простерилизованы.
«Свечи» и специальные держатели с закрепленными в них асбестовыми фильтрами герметически соединяют с колбой Бунзена для фильтрации в вакууме (рис. 4.3). Перед употреблением фильтры, их держатели и приемник фильтрата должны быть простерилизованы.