Опасные химические вещества и объекты :: SYL.ru
Сегодня в больших объемах в бытовой, сельскохозяйственной, промышленной сферах используются химически опасные вещества. Все они отличаются высокой токсичностью и представляют угрозу для людей и природы. Далее рассмотрим наиболее распространенные аварийно химически опасные вещества. 
Характер угрозы
Аварийно химически опасные вещества (АХОВ) применяются в производстве, переработке, для транспортных и прочих нужд. При их утечке заражению подвергаются воздух, вода, животные, люди, растения, почва. При аварии химических опасных веществ на предприятии создается угроза для жизни не только людей, находящихся непосредственно в его пределах. Токсичные соединения, способные быстро перемещаться с ветром, могут создать зону поражения на десятки километров. В России ежегодно случаются катастрофы, в результате которых происходит выброс химически опасных веществ. При этом с развитием промышленности и техники угроза только возрастает.
Опасные химические вещества и объекты: общие сведения
Крупнейшие запасы ядовитых соединений сконцентрированы на предприятиях нефтеперерабатывающей, металлургической, оборонной, мясомолочной, пищевой промышленности. В больших объемах АХОВ содержатся на химических и фармацевтических заводах. Токсичные соединения присутствуют на торговых и складских базах, на предприятиях ЖКХ, в различных АО, на хладокомбинатах. Наиболее распространенные опасные химические вещества — это:
- Синильная кислота.
- Бензол.
- Сернистый газ (серы двуокись).
- Аммиак.
- Фтористый и бромистый водород.
- Метилмеркаптан.
- Сероводород.
Особенности обработки
При обычных условиях химически опасные вещества в большинстве случаев имеют газообразное либо жидкое состояние. Но в процессе производства, применения, переработки, во время хранения газообразные соединения преобразовывают. Путем сжатия их приводят в жидкое состояние. За счет такого преобразования объем АХОВ значительно уменьшается. 
Характеристика токсичности
В качестве показателей вредности соединений используются такие категории, как максимально допустимая концентрация и токсодоза. Предельная норма представляет собой объем, ежедневное воздействие которого в течение длительного времени не провоцирует заболеваний и каких-либо изменений в организме человека. Максимально допустимая концентрация не используется при оценке опасности аварийной ситуации, поскольку при ЧП продолжительность токсического действия АХОВ достаточно ограничена. Токсодоза – это определенное количество соединения, способное вызвать отравляющий эффект.
Хлор
В нормальных условиях это соединение представляет собой желто-зеленый газ с раздражающим резким запахом. Его масса больше, чем у воздуха, приблизительно в 2,5 раза. Из-за этого хлор накапливается в тоннелях, колодцах, подвалах и низинах. Ежегодно это соединение потребляется в количестве 40 млн т. Перевозка и хранение хлора осуществляется в стальных емкостях и ж/д цистернах под давлением. При его утечке образуется едкий дым, который раздражающе действует на кожу и слизистые. Предельно допустимое содержание соединения в воздухе:
- 1 мг/м3 — в цеху предприятия.
- 0,1 мг/м3 – разовая максимальная концентрация.
- 0,03 мг/м3 – среднесуточная концентрация.
Опасным для жизни считается воздействие хлора в течение 30-60 минут в концентрации 100-200 мг/м3. 
Аммиак
В нормальных условиях это соединение представлено в виде бесцветного газа. Аммиак обладает резким запахом, небольшой массой (легче, чем воздух, вдвое). При выбросе в атмосферу образует дым и взрывоопасные смеси. Аммиак отличается высокой растворимостью в воде. Мировое производство этого соединения составляет ежегодно до 90 млн. т. Транспортировка аммиака осуществляется в сжиженном состоянии в емкостях под давлением. ПДК в воздухе:
- Максимальная разовая и средняя суточная концентрации – 0,2 мг/м3.
- В цеху предприятия – 20 мг/м3.
Угроза для жизни создается при концентрации в воздухе 500 мг/м3. В таких случаях высока вероятность смерти от отравления.
Синильная кислота
Эта прозрачная и бесцветная жидкость отличается дурманящим запахом, похожим на аромат миндаля. При нормальной температуре она обладает высокой летучестью. Капли синильной кислоты быстро испаряются: в зимнее время за час, в летнее — за 5 минут. ПДК в воздухе — 0,01 мг/м3. При концентрации 80 мг/м3 возникает отравление. 
Сероводород
Этот бесцветный газ обладает неприятным и очень резким запахом. Сероводород тяжелее воздуха в два раза. При авариях он накапливается в низинах, первых этажах сооружений, тоннелях, подвалах. Сероводород очень сильно загрязняет воду. При вдыхании соединение поражает слизистую, а также негативно воздействует на кожу. Среди первых признаков отравления следует отметить головную боль, светобоязнь, слезотечение и жжение в глазах, холодный пот, рвоту и тошноту, а также вкус металла во рту.
Особенности катастрофы
Как правило, при ЧП с разрушением емкости давление снижается до атмосферного. В результате опасные химические вещества вскипают и выделяются в виде аэрозоля, пара или газа. Образовавшееся непосредственно при повреждении емкости облако называют первичным. Опасные химические вещества, содержащиеся в нем, распространяются на достаточно большое расстояние. Оставшийся объем жидкости растекается по поверхности. Постепенно соединения также испаряются. Поступившие в атмосферу газообразные опасные химические вещества образуют вторичное облако поражения. Оно распространяется на меньшие расстояния. 
Зоны поражения
Это территории, которые заражены вредными соединениями в концентрациях, создающих угрозу для жизни людей. От уровня содержания АХОВ будет зависеть глубина зоны поражения (расстояние, на которое распространится воздух с опасными веществами). Немаловажное значение имеет и скорость ветра. Так, при потоках 1 м/с облако удалится от места ЧП на 5-7 км, при 2 м/сек – на 10-14 км, при 3 м/сек – на 16-21 км. При повышении температуры воздуха и почвы усиливается испарение токсичных соединений. Это, в свою очередь, способствует повышению концентрации веществ. От воздушного потока также зависит вид (форма) зоны заражения. Так, при 0,5 м/сек она выглядит как окружность, 0,6-1 м/сек – как полуокружность, 1,1 м/сек — как сектор с прямым (90 градусов) углом, 2 м/сек и более – как сектор с углом 45 градусов. 
Особенности поражения населенных пунктов
Необходимо сказать, что сооружения и здания в городе быстрее нагреваются от солнца, чем в сельской местности. В связи с этим в крупных населенных пунктах отмечается интенсивное перемещение воздуха. Это способствует тому, что опасные вещества проникают в тупики, подвалы, во дворы, на первые этажи домов, создавая там высокие концентрации, представляющие серьезную угрозу для населения.
www.syl.ru
Сообщение о любом простом химическом веществе (кто создал, почему так называется)
Ksushka1929 дек. 2016 г., 1:53:02 (год назад)
Алюминий (лат. Аluminium, химический символ Al, III группа периодической системы Менделеева, атомный номер 13, атомная масса 26,9815) — мягкий, легкий, серебристо-белый металл, быстро окисляющийся, удельная плотность 2,7 г/ см³, температура плавления 660 °C. По распространенности в земной коре алюминий занимает 3-е место после кислорода и кремния среди всех атомов и 1-е место — среди металлов. В природе представлен лишь одним стабильным нуклидом 27Al. Искусственно получен ряд радиоактивных изотопов алюминия, наиболее долгоживущий – 26Al имеет период полураспада 720 тысяч лет.
Алюминий — наиболее распространенный металл на земле, а по распространенности всех элементов в земной коре он занимает третье место. На его долю приходится 8% состава земной коры. Бокситная руда в настоящее время является главным сырьем для получения алюминия. Ежегодно в мире добывают от 80 до 90 млн. тонн бокситной руды. Почти 30% этого колличества добывают в Австралии и еще 15% на Ямайка. При нынешнем уровне мирового производства алюминия разведанных на земле запасов бокситов достаточно, чтобы обеспечивать потребности в алюминии еще несколько сотен лет.
Алюминий имеет наиболее разносторонние применения из всех металлов. Он широко используется в транспортном машиностроении, например для конструирования самолетов, судов, автомобилей. В химической промышленности алюминий используется в качестве восстановителя, в строительной промышленности — для изготовления оконных рам и дверей, а в пищевой промышленности — для изготовления упаковочных материалов. В быту он используется в качестве материала для кухонной посуды и в виде фольги для хранения пищевых продуктов.
атинское aluminium происходит от латинского же alumen, означающего квасцы (сульфат алюминия и калия KAl(SO4)2·12h3O), которые издавна использовались при выделке кож и как вяжущее средство. Из-за высокой химической активности открытие и выделение чистого алюминия растянулось почти на 100 лет. Вывод о том, что из квасцов может быть получена «земля» (тугоплавкое вещество, по-современному — оксид алюминия) сделал еще в 1754 немецкий химик А. Маргграф. Позднее оказалось, что такая же «земля» может быть выделена из глины, и ее стали называть глиноземом. Получить металлический алюминий смог только в 1825 датский физик Х. К. Эрстед. Он обработал амальгамой калия (сплавом калия со ртутью) хлорид алюминия AlCl3, который можно было получить из глинозема, и после отгонки ртути выделил серый порошок алюминия.
Только через четверть века этот способ удалось немного модернизировать. Французский химик А. Э. Сент-Клер Девиль в 1854 предложил использовать для получения алюминия металлический натрий, и получил первые слитки нового металла. Стоимость алюминия была тогда очень высока, и из него изготовляли ювелирные украшения.
Промышленный способ производства алюминия путем электролиза расплава сложных смесей, включающих оксид, фторид алюминия и другие вещества, независимо друг от друга разработали в 1886 году П. Эру (Франция) и Ч. Холл (США). Производство алюминия связано с высоким расходом электроэнергии, поэтому в больших масштабах оно было реализовано только в 20 веке. В Советском Союзе первый промышленный алюминий был получен 14 мая 1932 года на Волховском алюминиевом комбинате, построенном рядом с Волховской гидроэлектростанцией.
himia.neznaka.ru
Химические вещества: примеры, свойства :: SYL.ru
Элементарными частицами физической материи на нашей планете являются атомы. В свободном виде они могут существовать только при очень высоких температурах. В обычных условиях элементарные частицы стремятся к объединению между собой при помощи химических связей: ионной, металлической, ковалентной полярной или неполярной. Таким способом образуются вещества, примеры которых мы и рассмотрим в нашей статье.
Простые вещества
Процессы взаимодействия между собой атомов одного и того же химического элемента заканчиваются образованием химических веществ, называемых простыми. Так, уголь образован только атомами углерода, газ водород – атомами гидрогена, а жидкая ртуть состоит из частиц ртути. Понятие простое вещество не нужно отождествлять с понятием химического элемента. Например, углекислый газ состоит не из простых веществ углерода и кислорода, а из элементов карбона и оксигена. Условно соединения, состоящие из атомов одного и того же элемента, можно разделить на металлы и неметаллы. Рассмотрим некоторые примеры химических свойств таких простых веществ.

Металлы
Исходя из положения металлического элемента в периодической системе, можно выделить следующие группы: активные металлы, элементы главных подгрупп третьей – восьмой групп, металлы побочных подгрупп четвертой – седьмой групп, а также лантаноиды и актиноиды. Металлы – простые вещества, примеры которых мы приведем далее, имеют следующие общие свойства: тепло- и электропроводность, металлический блеск, пластичность и ковкость. Такие характеристики присущи железу, алюминию, меди и другим. С увеличением порядкового номера в периодах возрастают температуры кипения, плавления, а также твердость металлических элементов. Это объясняется сжатием их атомов, то есть уменьшением радиуса, а также накоплением электронов. Все параметры металлов обусловлены внутренним строением кристаллической решетки данных соединений. Ниже рассмотрим химические реакции, а также приведем примеры свойств веществ, относящихся к металлам.
Особенности химических реакций
Все металлы, имеющие степень окисления 0, проявляют только свойства восстановителей. Щелочные и щелочноземельные элементы взаимодействуют с водой с образованием химически агрессивных оснований – щелочей:
Типичная реакция металлов – окисление. В результате соединения с атомами кислорода, возникают вещества класса оксидов:
Это бинарные соединения, относящиеся к сложным веществам. Примерами основных окислов являются оксиды натрия Na2O, меди CuO, кальция CaO. Они способны ко взаимодействию с кислотами, в результате в продуктах обнаруживается соль и вода:

Вещества классов кислот, оснований, солей относятся к сложным соединениям и проявляют разнообразные химические свойства. Например, между гидроксидами и кислотами происходит реакция нейтрализации, приводящая к появлению соли и воды. Состав солей будет зависеть от концентрации реагентов: так, при избытке в реагирующей смеси кислоты, получаются кислые соли, например, NaHCO3 – гидрокарбонат натрия, а высокая концентрация щелочи вызывает образование основных солей, таких как Al(OH)2Cl – дигидроксохлорид алюминия.
Неметаллы
Наиболее важные неметаллические элементы находятся в подгруппах азота, карбона, а также относятся к группам галогенов и халькогенов периодической системы. Приведем примеры веществ, относящихся к неметаллам: это сера, кислород, азот, хлор. Все их физические особенности противоположны свойствам металлов. Они не проводят электрический ток, плохо пропускают тепловые лучи, имеют низкую твердость. Взаимодействуя с кислородом, неметаллы образуют сложные соединения – кислотные оксиды. Последние, реагируя с кислотами, дают кислоты:
Типичная реакция, характерная для кислотных окислов – это взаимодействие со щелочами, приводящее к появлению соли и воды.
Химическая активность неметаллов в периоде усиливается, это связано с увеличением способности их атомов притягивать электроны от других химических элементов. В группах наблюдаем обратное явление: неметаллические свойства ослабевают вследствие раздувания объема атома за счет добавления новых энергетических уровней.

Итак, мы рассмотрели виды химических веществ, примеры, иллюстрирующие их свойства, положение в периодической системе.
www.syl.ru
Вещество в химии — это что? Свойства веществ. Классы веществ
Основной вопрос, на который должен знать ответ человек для правильного понимания картины мира – что такое вещество в химии. Данное понятие формируется ещё в школьном возрасте и направляет ребёнка в дальнейшем развитии. Приступая к изучению химии важно найти точки соприкосновения с ней на бытовом уровне, это позволяет наглядно и доступно разъяснить те или иные процессы, определения, свойства и т.д.
К сожалению, в силу неидеальности системы образования, многие упускают некоторые фундаментальные азы. Понятие «вещество в химии» – это своего рода краеугольный камень, своевременное усвоение данного определения даёт человеку правильный старт в последующем развитии в области естествознания.
Формирование понятия
Перед тем как перейти к понятию вещества, необходимо определить, чем является предмет химии. Вещества – это то, что непосредственно изучает химия, их взаимные превращения, строение и свойства. В общем понимании вещество – это то, из чего состоят физические тела.
Итак, что такое вещество в химии? Сформируем определение путём перехода от общего понятия к чисто химическому. Вещество – это определённый тип материи, обязательно имеющий массу, которую можно измерить. Данная характеристика отличает вещество от другого вида материи – поля, которое массы не имеет (электрическое, магнитное, биополе и т.д.). Материя, в свою очередь, – это то, из чего созданы мы и всё, что нас окружает.
Несколько другая характеристика материи, определяющая то, из чего конкретно она состоит – это уже предмет химии. Вещества сформированы атомами и молекулами (некоторые ионами), а значит любая субстанция, состоящая из этих формульных единиц, и есть вещество.
Простые и сложные вещества
После усвоения базового определения можно перейти к его усложнению. Вещества бывают различных уровней организации, то есть простые и сложные (или соединения) – это самое первое деление на классы веществ, химия имеет множество последующих разделений, подробных и более сложных. Эта классификация, в отличие от многих других, имеет строго определённые границы, каждое соединение можно чётко отнести к одному из видов, взаимоисключающих друг друга.
Простое вещество в химии – это соединение, состоящее из атомов только одного элемента из периодической таблицы Менделеева. Как правило, это бинарные молекулы, то есть состоящие из двух частиц, соединённых посредством ковалентной неполярной связи – образования общей неподелённой электронной пары. Так, атомы одного и того же химического элемента имеют идентичную электроотрицательность, то есть способность удерживать общую электронную плотность, поэтому она не смещена ни к одному из участников связи. Примеры простых веществ (неметаллы) — водород и кислород, хлор, йод, фтор, азот, сера и т.д. Из трёх атомов состоит молекула такого вещества, как озон, а из одного – всех благородных газов (аргона, ксенона, гелия и т.д.). В металлах (магнии, кальции, меди т.д.) существует свой собственный тип связи – металлический, осуществляющийся за счёт обобществления свободных электронов внутри металла, а образования молекул как таковых не наблюдается. При записи вещества металла указывается просто символ химического элемента без каких-либо индексов.
Простое вещество в химии, примеры которого были приведены выше, отличается от сложного качественным составом. Химические соединения образованы атомами разных элементов, от двух и более. В таких веществах имеет место ковалентный полярный или ионный тип связывания. Так как разные атомы имеют отличающуюся электроотрицательность, то при образовании общей электронной пары происходит её сдвиг в сторону более электроотрицательного элемента, что приводит к общей поляризации молекулы. Ионный тип – это крайний случай полярного, когда пара электронов полностью переходит к одному из участников связывания, тогда атомы (или их группы) превращаются в ионы. Чёткой границы, между этими типами нет, ионную связь можно интерпретировать как ковалентную сильно полярную. Примеры сложных веществ — вода, песок, стекло, соли, оксиды и т.д.
Модификации веществ
Вещества, именуемые простыми, на самом деле имеют уникальную особенность, которая не присуща сложным. Некоторые химические элементы могут образовывать несколько форм простого вещества. В основе всё так же лежит один элемент, но количественный состав, строение и свойства кардинально отличают такие образования. Эта особенность имеет название аллотропии.
Кислород, сера, углерод и другие элементы имеют несколько аллотропных модификаций. Для кислорода – это О2 и О3, углерод даёт четыре типа веществ – карбин, алмаз, графит и фуллерены, молекула серы бывает ромбической, моноклинной и пластической модификации. Такое простое вещество в химии, примеры которого не ограничены вышеперечисленными, имеет огромное значение. В частности, фуллерены используются как полупроводники в технике, фоторезисторы, добавки для роста алмазных плёнок и в других целях, а в медицине это мощнейшие антиоксиданты.
Что происходит с веществами?
Каждую секунду внутри и вокруг происходит превращение веществ. Химия рассматривает и объясняет те процессы, которые идут с качественным и/или количественным изменением состава реагирующих молекул. Параллельно, часто взаимосвязано протекают и физические превращения, которые характеризуются лишь изменением формы, цвета веществ или агрегатного состояния и некоторых других характеристик.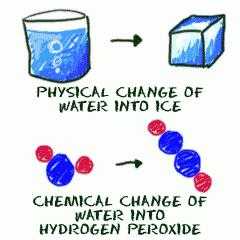
Химические явления – это реакции взаимодействия различных видов, например, соединения, замещения, обмена, разложения, обратимые, экзотермические, окислительно-восстановительные и т.д., в зависимости от изменения интересующего параметра. К физическим явлениям относят: испарение, конденсацию, сублимацию, растворение, замерзание, электропроводимость и т.д. Часто они сопровождают друг друга, например, молния во время грозы – это физический процесс, а выделение под её действием озона – химический.
Физические свойства
Вещество в химии – это материя, которой присущи определённые физические свойства. По их наличию, отсутствию, степени и интенсивности можно спрогнозировать, как вещество поведёт себя в тех или иных условиях, а также объяснить некоторые химические особенности соединений. Так, например, высокие температуры кипения органических соединений, в которых есть водород и электроотрицательный гетероатом (азот, кислород и т.д.), свидетельствуют о том, что в веществе проявляется такой химический тип взаимодействия, как водородная связь. Благодаря знанию о том, какие вещества имеют наилучшую способность проводить электрический ток, кабеля и провода электропроводки изготавливаются именно из определённых металлов.
Химические свойства
Установлением, исследованием и изучением другой стороны медали свойств занимается химия. Свойства веществ с её точки зрения – это их реакционная способность к взаимодействию. Некоторые вещества крайне активны в этом смысле, например, металлы или любые окислители, а другие, благородные (инертные) газы, при нормальных условиях в реакции практически не вступают. Химические свойства можно активировать или пассивировать при необходимости, иногда это не связано с особыми трудностями, а в некоторых случаях приходится нелегко. Учёные проводят многие часы в лабораториях, методом проб и ошибок добиваясь поставленных целей, иногда и не достигают их. Изменяя параметры окружающей среды (температуру, давление и т.д.) или применяя специальные соединения – катализаторы или ингибиторы — можно повлиять на химические свойства веществ, а значит и на ход реакции.
Классификация химических веществ
В основе всех классификаций лежит разделение соединений на органические и неорганические. Главный элемент органики – это углерод, соединяясь друг с другом и гидрогеном, атомы карбона образуют углеводородный скелет, который после заполняется другими атомами (кислородом, азотом, фосфором, серой, галогенами, металлами и другими), замыкается в циклы или разветвляется, обосновывая тем самым большое разнообразие органических соединений. На сегодняшний день науке известны 20 миллионов таких веществ. В то время как минеральных соединений всего лишь полмиллиона.
Каждое соединение индивидуально, но имеет и множество похожих черт с другими в свойствах, строении и составе, на этой основе происходит группировка в классы веществ. Химия имеет высокий уровень систематизации и организации, это точная наука.
Неорганические вещества
1. Оксиды – бинарные соединения с кислородом:
а) кислотные – при взаимодействии с водой дают кислоту;
б) основные – при взаимодействии с водой дают основание.
2. Кислоты – вещества, состоящие из одного или нескольких протонов водорода и кислотного остатка.
3. Основания (щёлочи) – состоят из одной или нескольких гидроксильных групп и атома металла:
а) амфотерные гидроксиды – проявляют свойства и кислот и оснований.
4. Соли – результат реакции нейтрализации между кислотой и щелочью (растворимым основанием), состоят из атома металла и одного или нескольких кислотных остатков:
а) кислые соли – анион кислотного остатка имеет в составе протон, результат неполной диссоциации кислоты;
б) основные соли – с металлом связана гидроксильная группа, результат неполной диссоциации основания.
Органические соединения
Классов веществ в органике великое множество, такой объём информации сложно сразу запомнить. Главное, знать основные разделения на алифатические и циклические соединения, карбоциклические и гетероциклические, предельные и непредельные. Также углеводороды имеют множество производных, в которых атом гидрогена замещён на галоген, кислород, азот и другие атомы, а так же функциональные группы.
Вещество в химии — это основа сущестования. Благодаря органическому синтезу человек на сегодняшний день имеет огромное количество искусственных веществ, заменяющих натуральные, а также не имеющих аналогов по своим характеристикам в природе.
fb.ru
Опасные вещества. Химические ожоги, отравления | ОБЖ. Реферат, доклад, сообщение, краткое содержание, конспект, сочинение, ГДЗ, тест, книга
В повседневной жизни люди пользуются различными средствами бытовой химии и лекарствами. Из курса химии можно узнать о свойствах химических веществ.
Средства бытовой химии условно делят на группы:
- более-менее безопасные (без предостерегающих надписей). Это мыло, стиральные порошки, пасты, косметика;
- опасные для кожи и глаз (с предостерегающими надписями, например, «Остерегаться попадания в глаза!»). Это отбеливатели, дезинфицирующие средства;
- огнеопасные (с надписями и условными обозначениями о запрете использования вблизи открытого огня). Это препараты в аэрозольной упаковке, лаки, краски, растворители, средства для обработки растений;
- ядовитые (с надписями «яд» или специальными обозначениями). Это сильнодействующие средства для борьбы с насекомыми, грызунами и т. п.
Все средства бытовой химии и лекарства имеют инструкции по использованию и хранению, которые следует соблюдать.
Нельзя нарушать инструкции по использованию и хранению средств бытовой химии и лекарств!
Чтобы избежать отравления средствами бытовой химии или лекарствами, а также травм:
- никогда не пользуйся неизвестными средствами бытовой химии;
- не зажигай спичек вблизи бутылок и банок с резким запахом;
- прежде чем использовать химическое средство, прочти инструкцию и чётко её выполняй.
Ожоги и отравления средствами бытовой химии, уксусной или соляной кислотой называют химическими. При химических отравлениях и ожогах необходимо обязательно вызвать скорую помощь. Ещё до приезда врача следует немедленно начать оказывать помощь себе или пострадавшему.
Если на кожу или слизистую оболочку попала концентрированная кислота (соляная, азотная, уксусная и т. п.), в этом месте быстро образуется тёмно-коричневый или чёрный струп (корка). Обожжённое кислотой место следует 15-20 мин промывать струёй холодной воды. Потом обработать его мыльной водой, раствором питьевой соды или слабым раствором марганцовки.
Если концентрированную кислоту случайно употребили внутрь, быстро возникают ожоги ротовой полости, глотки, гортани, пищевода, желудка. Прежде всего необходимо промыть желудок большим количеством тёплой воды. Можно выпить также молоко, растительное масло, яичные белки, слизистые отвары.
Если на кожу попадает негашёная известь, ни в коем случае нельзя смывать её водой. Удалить известь и обработать ожог нужно любым жиром, например растительным маслом.
При химическом ожоге глаз их в течение 20 мин тщательно промывают водой, удаляя химическое вещество.
При химическом ожоге, даже незначительном, после оказания первой помощи надо обязательно обратиться к врачу.
Лекарства помогают бороться с болезнью. Однако иногда они могут повредить здоровью. Очень опасно принимать лекарства в больших дозах, чем рекомендует врач. Даже передозировка витаминов может вызвать отравление.
При отравлении медикаментами необходимо: Материал с сайта //iEssay.ru
- вызвать скорую помощь;
- вызвать рвоту.
Не забывай, что в термометре содержится опасное вещество — ртуть. Парами ртути можно отравиться: болит голова, живот, появляется слабость. При длительном воздействии пары ртути поражают мозг и нервную систему. Если ты увидел капельки ртути, то немедленно скажи об этом взрослым. Взрослые в марлевой повязке соберут капельки ртути резиновой грушей в баночку с водой.
Ядохимикаты очень опасны для здоровья.
В сельской местности часто применяют ядохимикаты, в частности пестициды, а также минеральные удобрения.
Случается, что их оставляют без надзора. Чтобы не подвергаться опасности, ядохимикаты и удобрения ни в коем случае нельзя трогать.
В мире выпускают свыше 60 тыс. разнообразных химических веществ, среди которых около 3 тыс. — в значительном количестве.
На этой странице материал по темам:- химические отравления и ожоги
- сочинения отравления
- обж.сообщение вещество
iessay.ru
перечень, использование и общее токсическое воздействие :: BusinessMan.ru
Невозможно себе представить современную жизнь и производство без химических веществ. При близком контакте с ними на организм человека оказывается некоторое влияние. Надо отметить, что есть и такие соединения, которые проявят свое влияние по прошествии некоторого промежутка времени. В статье попробуем разобраться, какие существуют химические факторы, классы опасности вредных веществ, а также, как они влияют на организм человека.
Применение химических веществ человеком
Сейчас известно несколько миллионов химических соединений, и большую часть из них человек использует в различных отраслях. Если рассматривать с точки зрения применения классы опасности химических веществ, перечень может выглядеть так:
- Вещества ядовитые, используемые в промышленности. Сюда можно отнести: красители (анилин), среди растворителей это дихлорэтан, например.
- В сельскохозяйственной отрасли широко используются пестициды.
- Химические соединения, которые используются в быту: средства гигиены, для проведения санитарной обработки.
- Ядовитые вещества, имеющие естественное происхождение, например, яды растений и животных.
- Вещества отравляющего действия: иприт, фосген и другие.

Различные классы опасности вредных химических веществ способны попадать в организм через органы дыхательной системы, кожу или слизистые оболочки. Вещества могут оказывать свое негативное влияние избирательно, то есть, на определенную систему органов. Например, свинец влияет на репродуктивную систему человека, а оксиды азота могут спровоцировать отек легочной ткани.
Токсическое воздействие химических веществ
Если рассматривать класс опасности химических веществ, ГОСТ выделяет несколько групп. В каждой есть еще свои подразделения.
Выделяют пять классов в зависимости от токсического воздействия и средней величины смертельной дозы.
- Первый класс опасности включает соединения, которых требуется совсем мало для поражения организма. Например, при попадании через желудок это количество составляет 50 мг на килограмм веса человека.
- 2 класс включает вещества, концентрация которых может быть выше, чтобы спровоцировать токсическое воздействие. Это может быть от 5 до 50 мг на м3, если попадание происходит через кожу или ЖКТ.
- В 3 и 4 классы входят соединения, которых требуется больше, чем первых двух классов и обычно составляет это количество до 5000 единиц.
- В пятый класс входят вещества, вызывающие глубокое токсическое поражение.
Химические вещества и орган зрения
Если взять во внимание влияние химических веществ на орган зрения, выделяют следующие классы:
- Первый класс включает соединения, которые приводят к необратимым изменениям глазного аппарата, а все это заканчивается нарушениями зрения.
- Второй класс содержит вещества, вызывающие патологические изменения зрения, но они способны проходить в течение нескольких недель.
Воздействие химических веществ на кожные покровы
Есть еще одна классификация, она выделяет классы химических веществ, оказывающих негативное влияние на кожу. При делении соединений использовали два критерия. Учитывая первый, выделяют три класса:
- К первой группе относятся вещества, приводящие к видимому некрозу кожи.
- Ко второму классу относят вещества, которые вызывают обратимые повреждения. Примерно за две недели происходит восстановление кожных покровов.
- Вещества, относящиеся к третьему классу, вызывают лишь небольшое раздражение кожи, которое обычно проходит за пару дней.

Второй критерий классификации используют в тех случаях, когда недостаточно данных для отнесения веществ к первым трем группам.
Воздействие химических соединений на окружающую среду
Согласно ГОСТу, имеется также классификация, которая учитывает влияние химических соединений на окружающую среду. В этой группе выделяют следующие категории веществ:
- Губительные для озонового слоя.
- Оказывающие острое токсическое воздействие на водную среду.
- Вещества, которые оказывают постепенное отравляющее действие на обитателей водных ресурсов.
Все эти вредные соединения можно еще подразделить на категории по вредности. Для оказания токсического эффекта хватит концентрации 0,1 мг/л.
Классификация химических веществ по классам опасности
В огромном многообразии известных веществ не все являются одинаково опасными для человеческого организма. Выделяют следующие классы:
- К первому классу относятся чрезвычайно опасные вещества и соединения. Для летального исхода будет достаточно попадания в желудок 15 мг вещества на килограмм веса человека. Примеры можно привести следующие: цианид калия, ртуть, никотин и другие.
- Второй класс включает высокоопасные вещества. Летальная дозировка составляет от 15 до 150 мг на килограмм массы тела, учитывая свойства вещества. Эти соединения оказывают негативное воздействие не только на человека, но и на окружающую природу. Сюда можно отнести: мышьяк, литий, свинец, хлороформ.
- Умеренно опасные – это третий класс опасности химических веществ. Для летального исхода достаточно 500-2500 мг/кг. При попадании через желудок летальная доза составляет 150-5000 мг/кг веса. К этому классу относятся: бензин, соединения алюминия и марганца. Так как многие вещества этого класса используются часто в повседневной жизни, то нельзя халатно с ними обращаться.
- Малоопасные вещества самые безобидные, так как они отличаются своей низкой токсичностью и опасностью. Эти вещества часто нас окружают, например, аммиак можно найти в каждой аптечке, керосин используют в лампах, этанол применяют в медицине и он содержится в алкогольных напитках.

Неважно, сколько классов опасности химических веществ существует, важно относиться ко всем с особой осторожностью, соблюдать все меры безопасности при работе с ними.
Классификация веществ по воздействию на организм
Все имеющиеся химические вещества и соединения отличаются друг от друга не только степенью токсичности, но и характером воздействия на человека.
В зависимости от принадлежности к классу опасности всем веществам присвоен определенный цвет.
- Чрезвычайно опасные вещества обозначают красным цветом.
- Высокая степень опасности отмечается оранжевым цветом.
- Умеренно опасные имеют желтый цвет.
- Вещества, которые относятся к малоопасным, обозначают зеленым цветом.
Классификация веществ с точки зрения токсического воздействия
Совершенно разная токсичность химических веществ, классы опасности в связи с этим выделяют следующие:
- Вещества, которые оказывают нервнопаралитическое действие, сюда можно отнести: инсектициды, никотин, зарин.
- Соединения, вызывающие воспалительные процессы и некротические изменения в совокупности с общетоксическим воздействием. Примером могут служить: уксусная эссенция, мышьяк, ртуть.
- Соединения, вызывающие судороги, кому, отек мозга, то есть, оказывающие общетоксическое воздействие. Сюда можно отнести: синильную кислоту, угарный газ, алкоголь.
- Удушающие вещества (фостен, оксиды азота).
- Вещества, вызывающие слезоточивость и раздражение слизистых оболочек. В качестве примера можно привести: пары кислот и щелочей.
- Вещества и соединения, оказывающие воздействие на психику. Сюда относятся наркотические вещества, атропин и другие.

Если предстоит использовать или контактировать с этими веществами, то необходимо соблюдать особую осторожность.
Международная классификация
Мы рассмотрели, сколько классов опасности химических веществ существует согласно ГОСТу, но есть еще и разделение на основе международных требований. Оно представляет 9 групп, каждая из которых имеет свои правила для транспортировки и хранения.
- Вещества, которые легко могут взрываться или загораться.
- Ко второму классу относятся вещества, легко воспламеняющиеся, ядовитые, химически неустойчивые.
- Химические вещества в жидком состоянии, которые легко воспламеняются, относятся к 3 классу.
- К 4 классу относят твердые вещества, способные к самовоспламенению или возгоранию после внешнего воздействия.
- Органические окислители относятся к 5 классу, так как они способны выделять кислород, поддерживающий горение.
- 6 класс – это токсичные вещества, вызывающие сильное отравление или приводящие к смертельному исходу при вдыхании паров.
- Следующий класс – это радиоактивные вещества.
- Едкие вещества – это восьмой класс опасности.
- К 9 классу отнесли все остальные вещества, которые не попали в предыдущие классы, но в какой-то степени могут быть опасными.

Как защититься от опасных веществ
Важно не только знать класс опасности химических веществ, но и уметь минимально снизить степень влияния на человеческий организм и природу. Для этого можно использовать следующие способы:
- Располагать ядовитые и вредные вещества на предприятиях как можно дальше от рабочих мест.
- Иметь современную и эффективную систему вентиляции для удаления опасных веществ.
- Своевременно использовать индивидуальные средства защиты.
- Использовать современные методы очистки воды перед тем, как выбрасывать ее в окружающую среду.
- Разбавлять вредные соединения до допустимых концентраций.

Применение этих доступных методов позволит максимально обезопасить человека и природу от воздействия вредных химических веществ.
Подведем итоги
Если подвести итоги всего сказанного, то можно не только выделить класс опасности химических веществ,но и отметить следующие типы воздействия вредных соединений:
- Раздражающее действие, если попадают на кожу, то вызывают покраснения, например, фтор, фосфор и т.д.
- Прижигающего действия вещества могут вызывать ожоги разной степени. Сюда можно отнести: аммиак, соляную кислоту.
- Удушающие вещества могут привести к асфиксии и смертельному исходу. Таким действием обладают фосген и хлорпикрин.
- Вещества с токсическим воздействием могут вызывать отравления различной степени тяжести. К таковым относятся: сероводород, синильная кислота, окись этилена и другие.
- Мутагенные вещества способны спровоцировать появление мутаций.
- Канцерогенное воздействие приводит к развитию онкологических заболеваний.
Некоторые классификации выделяют еще наркотические вещества, которые, попадая внутрь организма, вызывают привыкание и постепенное отравление организма.
Вот мы и познакомились с многообразием химических веществ, которые практически везде нас окружают. Без химии уже практически невозможно представить себе современную промышленность и производство. Но для того, чтобы в процессе взаимодействия с вредными веществами не причинить вред своему организму, необходимо соблюдать особую осторожность и знать правила хранения и транспортировки.
businessman.ru
Реферат Химические вещества
скачатьРеферат на тему:
План:
- Введение
- 1 Различие между веществом и полем
- 2 Свойства вещества
- 3 Классификация веществ
- 3.1 Химическая
- 3.1.1 Индивидуальные вещества и смеси
- 3.1.2 Неорганические вещества
- 3.1.3 Органические вещества
- 3.2 Физическая
- 3.2.1 Агрегатные состояния
Литература - 3.1 Химическая
Введение
Вещество́ (в химии) — физическая субстанция со специфическим химическим составом.
Вещество в физике — форма материи, в отличие от поля обладающая массой покоя. Вещество состоит из частиц, среди которых чаще всего встречаются электроны, протоны и нейтроны. Последние два образуют атомные ядра, а все вместе — атомы (атомное вещество), из которых — молекулы, кристаллы и т. д.
Вещество в биологии — материя, образующая ткани организмов, входящая в состав органелл клеток.
Согласно современной теории, в том числе квантовой, вещество — разновидность материи, которая содержит число химических частиц от 1015 и более. Структурные единицы макроскопического вещества — электроны и ядра. Отсюда следует, что определение «вещество состоит из атомов и молекул» не совсем верно. Не во всех макроскопических веществах мы можем выделить молекулы. А электроны и ядра мы можем выделить при любых условиях. Поэтому все вещества и частицы состоят из электронов и ядер. Тогда, атом — это одноядерная, в целом нейтральная система, а молекула — неодноядерная, в целом нейтральная система.
1. Различие между веществом и полем
Поле, в отличие от веществ, характеризуется непрерывностью. Известны электромагнитное и гравитационное поля, поле ядерных сил, волновые поля различных элементарных частиц.
Современное естествознание нивелирует различие между веществом и полем, считая, что и вещества, и поля состоят из различных частиц, обладающих корпускулярно-волновой (двойственной) природой. Выявление тесной взаимосвязи между полем и веществом привело к углублению представлений о единстве всех форм и структуры материального мира.
Однородное вещество характеризуется плотностью — отношением массы вещества к его объёму:
где ρ — плотность вещества, m — масса вещества, V — объём вещества.
Физические поля такой плотностью не обладают.
2. Свойства вещества
Каждому веществу присущ набор специфических свойств — объективных характеристик, которые определяют индивидуальность конкретного вещества и тем самым позволяют отличить его от всех других веществ. К наиболее характерным физико-химическим свойствам относятся константы — плотность, температура плавления, температура кипения, термодинамические характеристики, параметры кристаллической структуры. К основным характеристикам вещества принадлежат его химические свойства.
3. Классификация веществ
Число веществ в принципе неограниченно велико; к известному числу веществ всё время добавляются новые вещества, как открываемые в природе, так и синтезируемые искусственно.
3.1. Химическая
3.1.1. Индивидуальные вещества и смеси
В химии принято разделять все объекты изучения на индивидуальные вещества (иначе — соединения) и их смеси. Под индивидуальным веществом понимают абстрактное понятие, обозначающее набор атомов, связанных друг с другом по определённому закону. Граница между индивидуальным веществом и смесью веществ довольно расплывчата, так как существуют вещества непостоянного состава, для которых, вообще говоря, нельзя предложить точной формулы. Кроме того, индивидуальное вещество остаётся абстракцией в силу того, что практически достижима лишь конечная чистота вещества. Это значит, что любой конкретный, реально существующий образец представляет собой смесь веществ, пусть и с подавляющим преобладанием одного из них. Несмотря на кажущуюся надуманность этого ограничения, зачастую чистота вещества играет ключевую роль в его свойствах. Так, знаменитая прочность титана проявляется только после того, как он очищен от кислорода до определённого предела (менее сотых долей процента).
и Сложное вещество.
3.1.2. Неорганические вещества
- Соли
- Кислоты
- Основания
3.1.3. Органические вещества
- Амиды
- Амины
- Кетоны и альдегиды
- Кислоты и ангидриды
- Нитрилы
- Сероорганические соединения
- Спирты
- Углеводороды
- Замещенные углеводороды
- Простые эфиры
- Сложные эфиры
- Аминокислоты
- Тривиальные названия неорганических соединений
3.2. Физическая
3.2.1. Агрегатные состояния
Все химические вещества в принципе могут существовать в трёх агрегатных состояниях — твёрдом, жидком и газообразном. Так, лёд, жидкая вода и водяной пар — это твёрдое, жидкое и газообразное состояния одного и того же химического вещества — воды H2O. Твёрдая, жидкая и газообразная формы не являются индивидуальными характеристиками химических веществ, а соответствуют лишь различным, зависящим от внешних физических условий состояниям существования химических веществ. Поэтому нельзя приписывать воде только признак жидкости, кислороду — признак газа, а хлориду натрия — признак твёрдого состояния. Каждое из этих (и всех других веществ) при изменении условий может перейти в любое другое из трёх агрегатных состояний.
При переходе от идеальных моделей твёрдого, жидкого и газообразного состояний к реальным состояниям вещества обнаруживается несколько пограничных промежуточных типов, общеизвестными из которых являются аморфное (стеклообразное) состояние, состояние жидкого кристалла и высокоэластичное (полимерное) состояние. В связи с этим часто пользуются более широким понятием «фаза».
В физике рассматривается четвёртое агрегатное состояние вещества — плазма, частично или полностью ионизированное состояние, в котором плотность положительных и отрицательных зарядов одинакова (плазма электронейтральна).
Литература
- Химия: Справ. изд./ В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.: Пер. с нем. — М.: Химия, 1989
wreferat.baza-referat.ru
