Как поменять СНИЛС при смене фамилии
Чтобы исправить данные лицевого счета, нужно подать заявление об изменении анкетных данных, содержащихся в индивидуальном лицевом счете зарегистрированного лица.
Органом, ответственным за ведение лицевого счета, согласно Федеральному закону от 01.04.1996 № 27-ФЗ, является Пенсионный фонд Российской Федерации. Регламент регистрации и изменения данных в системе персучета установлен Постановлением Правления ПФ РФ от 21.05.2020 № 291п.
Способов подачи заявлений несколько:
— лично;
— через законного представителя;
— по почте;
— по e-mail;
— через МФЦ;
— посредством госуслуг;
— на официальном сайте ведомства;
— через уполномоченного представителя в структурном подразделении ПФР.
Результат получения госуслуги можно получить:
— лично
— через законного представителя
— по почте;
— e-mail;
— через МФЦ;
— посредством госуслуг;
— на официальном сайте ведомства;
— через уполномоченного представителя в структурном подразделении ПФР.
Заявление, поданное лично в ПФР, в том числе поданное через работодателя, регистрируется в день обращения в территориальный орган ПФР. Подробнее о процедуре подачи заявки через ПФР читайте далее.
Электронное заявление зарегистрируется в автоматическом режиме в день его поступления в территориальный орган ПФР. Подробнее о процедуре подачи заявки по ТКС читайте далее.
Заявление, поданное через многофункциональный центр, передается в территориальный орган ПФР в сроки, предусмотренные соглашением о взаимодействии, и регистрируется в течение одного рабочего дня, следующего за днем его поступления в ПФР. Подробнее о процедуре подачи заявки через МФЦ читайте далее.
Поступление заявки, направленной по почте, зафиксируют в журнале не позднее рабочего дня, в котором оно получено пенсионным фондом. При регистрации заявлению присвоят номер по порядку. Если заявка поступит в ПФР в нерабочие дни или праздники, его зарегистрируют на следующий за ними рабочий день.
При любом способе подачи заявления важно, какие документы необходимо приложить для успешного завершения процедуры. Исчерпывающий перечень установлен пунктами 16—18 административного регламента, утвержденного Постановлением Правления ПФ РФ от 21.05.2020 № 291п. Согласно ему кем бы ни была подана заявка, личность заявителя должен удостоверять соответствующий законодательству документ. Представитель также должен подтвердить свои полномочия документами о законном представительстве или доверенностью. Если доверенность заверена нотариусом, паспорт застрахованного, чьи интересы представляются, предъявлять не надо.
Исчерпывающий перечень установлен пунктами 16—18 административного регламента, утвержденного Постановлением Правления ПФ РФ от 21.05.2020 № 291п. Согласно ему кем бы ни была подана заявка, личность заявителя должен удостоверять соответствующий законодательству документ. Представитель также должен подтвердить свои полномочия документами о законном представительстве или доверенностью. Если доверенность заверена нотариусом, паспорт застрахованного, чьи интересы представляются, предъявлять не надо.
Если менять данные системы персучета решено с использованием услуг почтовой связи, к заявлению нужно приложить копии всех необходимых документов, заверенные нотариально.
Заменить или восстановить СНИЛС при утере в 2021 году
СНИЛС — страховой номер индивидуального лицевого счета. Он записан на зеленой карточке — страховом свидетельстве, поэтому и саму карточку часто называют «СНИЛС»
Вероника Нецова
бережно хранит свой СНИЛС
Профиль автораЕсли вы потеряли страховое свидетельство, то восстанавливать его не нужно. С 1 апреля 2019 года изменились правила выдачи СНИЛС: получать, хранить и восстанавливать зеленую карточку больше не нужно.
С 1 апреля 2019 года изменились правила выдачи СНИЛС: получать, хранить и восстанавливать зеленую карточку больше не нужно.
Сами лицевые счета никуда не делись. Если вы поменяли паспорт или изменили личные данные, то нужно сообщить об этом в пенсионный фонд.
Подробно обо всех нововведения — в нашем материале.
Как восстановить СНИЛС при утере
Если вы потеряли страховое свидетельство, то восстанавливать его не нужно. Выдачу зеленых карточек со страховым номером прекратили с 1 апреля 2019 года. Вместо них появились специальные бумажные уведомления о регистрации в системе индивидуального учета по форме АДИ-РЕГ (Приложение 1 к Постановлению Правления ПФР от 13 июня 2019 года № 335п). Еще раз: СНИЛС остался, но страховые свидетельства в виде зеленых карточек больше не выдают.
При утере зеленой карточки можно получить бумажное уведомление, подтверждающее регистрацию в системе.
Вот как можно получить уведомление:
- Лично в ПФР.
 Понадобится паспорт и заполненное на месте заявление.
Понадобится паспорт и заполненное на месте заявление. - Онлайн в личном кабинете ПФР.
- В МФЦ.
В пенсионном фонде
Получить бумажное уведомление можно в любом отделении независимо от места регистрации и жительства. Понадобится паспорт и заполненное заявление. Уведомление выдадут во время приема. Можно взять сразу несколько таких уведомлений: например, одно — для работодателя, второе — для социальной службы, третье — для банка.
Проще и быстрее всего запросить уведомление в личном кабинете на сайте Пенсионного фонда. Для доступа к личному кабинету нужно авторизоваться под своей учетной записью на портале Госуслуг. Такая учетная запись должна быть подтвержденной. Хотя само свидетельство уже не выдают, функция на сайте ПФР пока называется по-старому. В ответ на обращение придет электронное уведомление — оно юридически равнозначно бумажному формату.
Выберите «Подать заявление о выдаче дубликата страхового свидетельства». Электронный документ придет вам на почту
Электронный документ придет вам на почтуЧерез МФЦ
В МФЦ можно прийти с паспортом и заполнить заявление о выдаче уведомления на месте, если центр предоставляет такую услугу. Убедитесь в этом заранее.
Восстановление СНИЛС для безработных
Если безработный потерял страховое свидетельство со СНИЛС, он тоже получает уведомление о регистрации в системе. Для безработного эта процедура не отличается от описанной выше последовательности.Как заменить СНИЛС при смене фамилии
Если вы поменяли фамилию, об этом нужно сообщить в пенсионный фонд. Это можно сделать лично или через работодателя. Пенсионный фонд изменит ваши данные в системе, но при этом новое пластиковое свидетельство не выдаст. Вместо него можете запросить уведомление о регистрации — уже с новой фамилией.
Понадобятся следующие документы:
- Заявление.
- Паспорт.
- Документ, на основании которого были изменены анкетные данные. Например, свидетельство о браке или перемене фамилии.

Добрый день! — Паспорт гражданина Российской Федерации, удостоверяющий личность гражданина Российской Федерации за пределами территории Российской Федерации — Фотография в цветном или черно-белом варианте, на матовой фотобумаге, размером 35 x 45 мм — Дипломатические, служебные, консульские карточки или удостоверения, выданные МИД России (Сотрудники дипломатических представительств и консульских учреждений иностранных государств в Российской Федерации и члены их семей, сотрудники международных организаций и их представительств, аккредитованных при МИД России, и члены их семей дополнительно представляют дипломатические, служебные, консульские карточки или удостоверения, выданные МИД России) Требования к фотографии водителя для оформления международного водительского удостоверения (предоставляется заявителем): размер фотографии 35х45 мм матовая фотобумага в чёрно-белом или цветном исполнении, фотография должна иметь чёткое изображение лица строго в анфас без головного убора (допускается представление фотографий в головных уборах, не скрывающих овал лица, гражданами, религиозные убеждения которых не позволяют показываться перед посторонними лицами без головных уборов), для граждан, постоянно носящих очки, обязательно фотографирование в очках без тонированных стекол. Заявителем по собственной инициативе могут быть представлены: Вы можете дополнительно проконсультироваться в любом МФЦ в окне консультаций или обратиться по телефону 8 (8422) 37-31-31. При планировании посещения МФЦ рекомендуем воспользоваться предварительной записью. Предварительно записаться возможно по ссылке https://mfc.  ulgov.ru/reception/, по телефону 8 (8422) 37-31-31. ulgov.ru/reception/, по телефону 8 (8422) 37-31-31.
|
Поменять СНИЛС в связи со сменой фамилии в 2021 году
Как поменять СНИЛС после замужества
Если после регистрации брака женщина меняет фамилию, то ей необходимо переоформить документы, удостоверяющие ее личность. СНИЛС не является таким документом, однако там указана фамилия, и его замена также продиктована требованиями закона об индивидуальном (персонифицированном) учете. Замене подлежит прежде всего сама карточка или свидетельство о прохождении регистрации в системе ПФР. Номер счета, выделенный гражданке ранее, останется прежним.
Будьте внимательны, если замена СНИЛСа не будет произведена, а работодатель продолжит переводить пенсионные взносы по старым паспортным данным и старой фамилии, ваши накопления могут быть утеряны.
О том, как поменять СНИЛС при смене фамилии, поговорим чуть ниже. Пока лишь отметим, что срок обмена свидетельства законодательно не установлен (это не относится к случаю утраты). Но сделать это желательно как можно быстрее, чтобы в дальнейшем информация о фамилии застрахованного лица всегда была достоверной. ПФР рекомендует произвести замену в двухнедельный срок.
Но сделать это желательно как можно быстрее, чтобы в дальнейшем информация о фамилии застрахованного лица всегда была достоверной. ПФР рекомендует произвести замену в двухнедельный срок.
Где можно поменять СНИЛС при смене фамилии
Есть несколько вариантов смены этой ламинированной карточки с фамилией. Можно сделать смену через своего работодателя, а можно самостоятельно, обратившись в ПФР или МФЦ. Рассмотрим каждый вариант подробнее.
Через работодателя
Это самый простой и удобный способ, поскольку вам не придется никуда ехать и стоять в очереди. Единственный минус — такой вариант оформления документа займет немного больше времени, чем при личном обращении. Но если вы никуда не торопитесь, цените комфорт своего кабинета, то это верный вариант. Тем более что фамилию вы уже поменяли.
Согласно статье 15 Федерального закона от 01.04.1996 № 27-ФЗ, работодатель обязан оказать помощь в замене СНИЛСа своему работнику, с которым заключен трудовой или гражданско-правовой договор. Поэтому если вы решили выбрать именно этот путь, берите паспорт, документ о смене фамилии и старое свидетельство и отправляйтесь с ними в бухгалтерию. Там вас попросят заполнить специальную анкету по установленной форме с уже новой фамилией, сделают ксерокопии документов и вместе со старым СНИЛСом отправят по почте заказным письмом (с описью вложения) либо лично передадут в ПФР. После получения нового документа сотрудник бухгалтерии передаст его вам и попросит расписаться в специальной ведомости. Вот так без лишних хлопот можно произвести замену СНИЛС, или, как еще его называют, «зеленой карточки».
Поэтому если вы решили выбрать именно этот путь, берите паспорт, документ о смене фамилии и старое свидетельство и отправляйтесь с ними в бухгалтерию. Там вас попросят заполнить специальную анкету по установленной форме с уже новой фамилией, сделают ксерокопии документов и вместе со старым СНИЛСом отправят по почте заказным письмом (с описью вложения) либо лично передадут в ПФР. После получения нового документа сотрудник бухгалтерии передаст его вам и попросит расписаться в специальной ведомости. Вот так без лишних хлопот можно произвести замену СНИЛС, или, как еще его называют, «зеленой карточки».
В случае если вы решили осуществить смену самостоятельно, тогда с аналогичным пакетом документов можно обратиться в Пенсионный фонд или МФЦ. Обычно такой путь выбирают неработающие граждане (или работающие неофициально), индивидуальные предприниматели или люди, не желающие обращаться в бухгалтерию по данному вопросу.
ПФР
Можно обратиться в ближайший УПФР. Там традиционно выдают свидетельства и дубликаты СНИЛС и других подобных бланков, согласно регистрации или месту жительства. Заявитель, если он россиянин, может обратиться лично, иностранец или лицо без гражданства — только при помощи и через своего работодателя.
Заявитель, если он россиянин, может обратиться лично, иностранец или лицо без гражданства — только при помощи и через своего работодателя.
МФЦ
Этот вариант для тех, кого интересует, можно ли поменять СНИЛС в МФЦ. Отвечаем: можно. Причем законом разрешено пользоваться услугами любого центра, без привязки к прописке заявителя. Но подавать заявление таким способом могут только граждане РФ.
Интернет
Это был бы неплохой вариант, но, к сожалению, пока он не работает. Отвечая на вопрос, как поменять СНИЛС в госуслугах, мы, к сожалению, вынуждены вас огорчить. Осуществить смену фамилии на свидетельстве таким образом не получится. Онлайн-вариантов получения такой услуги нет. Если что-то изменится, мы обязательно вам сообщим.
Какие документы нужны, чтобы получить СНИЛС
Так, мы разобрались, где поменять СНИЛС при смене фамилии. Теперь переходим к списку бумаг, которые понадобятся чиновникам для оказания этой услуги. На самом деле список короткий и состоит всего из четырех пунктов:
- заявление — бланк обращения о смене свидетельства нужной формы АДВ-2.
 Порядок его заполнения можно посмотреть и скачать ниже, заполняется он печатными буквами дома или непосредственно на приеме с госслужащим;
Порядок его заполнения можно посмотреть и скачать ниже, заполняется он печатными буквами дома или непосредственно на приеме с госслужащим; - ранее выданная «зеленая карточка» — из нее выписывают номер счета, иные сведения, но указывают иные персональные данные заявителя, одновременно обновляя и производя смену сведений в базе. Старое свидетельство не возвращают, а выдают новое;
- свидетельство о браке;
- ну и, конечно же, паспорт заявителя с новой фамилией.
Заполненный образец заявления
Сроки оказания услуги по смене СНИЛС
Еще один важный вопрос: сколько времени уходит на оформление бумаг? Ответ простой: если услугу оказывают в отделении Фонда, смена произойдет в тот же день, новый документ с новой фамилией предоставят практически сразу же. Если обращение подано в МФЦ, на пересылку и подготовку бумаг уйдет до 5 дней.
Бланк заявления
Скачать
Как определить слизней и улиток | Журнал BBC Wildlife
Все иллюстрации Фелисити Роуз Коул
Влажное лето ослабляет энтузиазм многих орнитологов и наблюдателей за насекомыми, но для конхологов это рай. Слизни и улитки процветают в дождливую погоду, что приводит к наблюдениям в гораздо большем количестве.
Слизни и улитки процветают в дождливую погоду, что приводит к наблюдениям в гораздо большем количестве.
Не у всех есть слабость к этим чудесным моллюскам, но даже увлеченные садоводы должны найти время, чтобы восхититься разнообразием их форм.Мы изобразили 14 видов, обладающих богатым разнообразием цветов и форм раковин.
Многие слизни, такие как желтые и червячные слизни, тесно связаны с людьми и часто посещают сады и парки. Это помогает узнать их специфические требования к среде обитания: например, древесный слизень любит лазить по стволам деревьев, особенно в сырую погоду. Обыкновенная улитка-куколка скользит под плющом, а колючая улитка прячется в опавших листьях.
Мягкие влажные ноябрьские ночи идеально подходят для поиска слизней и улиток, но вы также можете заглянуть днем под кирпичи, камни и листву.Итак, почему бы не заменить свои шарики от слизняков на ручную линзу?
Большой серый слизень (
Limax maximus , см. выше) Этот слизень, вырастающий до внушительных 20 см, также называется леопардовым слизнем из-за его темных пятен. Его много в садах и лесах, он может карабкаться по деревьям и стенам, хотя слизистый след не очень липкий на ощупь.
Его много в садах и лесах, он может карабкаться по деревьям и стенам, хотя слизистый след не очень липкий на ощупь.
Отметины могут быть весьма разнообразными, но темные пятна обычно располагаются тремя линиями на спине. В других вариациях пятна выглядят более хаотично, как у леопарда.Реже некоторые слизни полностью лишены пятен.
Два слизняка висят на нитях слизи, чтобы размножаться в странных брачных образах.
Желтый слизень (
Limax flavus )Этот слизень может вырасти до 10 см и имеет более желтую окраску, чем аналогичный большой серый слизень, с пятнистыми серыми и желтыми пятнами и голубоватыми щупальцами. Его можно встретить в садах, подвалах и хозяйственных постройках, а также он может лазить по стенам — ему комфортно жить среди людей.
Слизни — детритофаги, питающиеся грибами и гниющими мертвыми растениями. Однако в некоторых областях слизень проигрывает аналогичному ирландскому желтому слизнюку, который имеет более тусклый желтый цвет.
Большой черный слизень (
Arion ater )Крупные черные слизни, вырастающие примерно до 14 см, обычно черного цвета с оранжевой оборкой (вверху), но также встречаются коричневые, серые и оранжевые формы. Слизь этой группы очень вязкая. Его также можно отличить по тому, как он раскачивается из стороны в сторону, когда ему угрожают.
Он обитает в садах и лесах круглый год, кроме зимы, и лучше всего виден после дождя или ночью, когда воздух более влажный. Их сферические яйца кремового цвета обычно можно найти в садах. Поскольку он предпочитает гниющие растительные остатки живым растениям, он не является вредителем в саду. Он также будет есть падаль и навоз.
Древесный слизень (
Lehmannia marginata ) В 8 см этот слизень выглядит скорее как маленький большой серый слизень, но пятна, как правило, удлиненные, из-за чего он выглядит более пестрым, чем большой серый слизень.Он также имеет более полосатый вид с одной преобладающей более светлой полосой вдоль спины.
Обычно встречается в лесах, где лазает по деревьям, часто довольно высоко, чтобы пастись на водорослях и лишайниках. Специализированная диета означает, что слизень не представляет угрозы для садовых растений, но это также означает, что им угрожает загрязнение воздуха и его влияние на рост лишайников.
Червячный слизень (
Boettgerilla pallens )Вырастающий до 6 см слизень-червь светло-сероватый или коричневатый и тонкий; червеобразный.Голова сужается, а нижняя сторона слизняка светло-желтая. У них короткая продолжительность жизни, они умирают вскоре после откладывания яиц, а зимой вылупляются новые слизни.
Обычно встречается в садах, под кирпичами или мусором. Червячный слизень — это интродуцированный вид, впервые отмеченный в Великобритании в 1972 году. Он может рыть под землей и проводит там большую часть своего времени, перемещаясь по тропам дождевых червей на глубине до 60 см под поверхностью.
Колючая улитка (
Acanthinula aculeata ) Диаметр раковины колючей улитки составляет всего 2 мм, поэтому для изучения этого вида необходима ручная линза. Он покрыт безошибочно узнаваемыми шипами. Богатые кальцием почвы производят самые впечатляющие образцы, но декоративные структуры могут быть повреждены в течение жизни улитки.
Он покрыт безошибочно узнаваемыми шипами. Богатые кальцием почвы производят самые впечатляющие образцы, но декоративные структуры могут быть повреждены в течение жизни улитки.
Он процветает в лесах и живых изгородях, предпочитая более сухие места обитания, чем другие улитки.
Хрустальная улитка (
Vitrea crystallin )Панцирь этого слизняка имеет почти круглую форму диаметром 3–4 мм; стекловидные и прозрачные, с правильными оборотами. Иногда он кажется плоским на спине улитки, а не стоящим.Из-за прозрачности через скорлупу можно увидеть серую пищеварительную железу с темными прожилками.
Встречается в лесах, на лугах и обочинах дорог, предпочитает защищенные места и избегает торфяных почв. Его вряд ли можно увидеть на почве, и, скорее всего, он будет спрятан в затененной опавшей листве.
Округлая улитка (
Discus rotundatus ) Раковина этого слизняка диаметром всего около 5–7 мм имеет круглую форму с расходящимися бороздками и коричневыми полосами. Если внимательно присмотреться, на скорлупе можно увидеть красные пятна.
Если внимательно присмотреться, на скорлупе можно увидеть красные пятна.
Очень часто встречается в лесах, садах и живых изгородях, предпочитая укрываться среди камней и бревен, а также на земле (гниющая растительность и грибки). Улиткам требуется около года, чтобы достичь половой зрелости из яиц, которые вылупляются в феврале.
Поясная улитка (
Hygromia cinctella )Панцирь этого слизняка имеет примерно треугольную форму, вырастает до 10–12 мм. Он от бледного до шоколадно-коричневого цвета с белым «килем» — гребнем между оборотами.
Улитка предпочитает питомники и сады.Это интродуцированный средиземноморский вид, завезенный на садовых растениях и быстро распространяющийся. Девон был первым местом, где его заметили в 1950 году, но он распространился до центральной части страны.
Обыкновенная улитка-куколка (
Lauria cylindracea ) Луковицеобразная раковина напоминает куколку мотылька и имеет размер 3–4 мм. Ее трудно отличить от различных родственных улиток, но ее, скорее всего, можно увидеть, потому что она самая распространенная из всех. Привередливые энтузиасты улиток могут идентифицировать взрослых экземпляров по белой губе раковины и единственному «зубу» улитки — похожей на зуб структуре в отверстии раковины.
Ее трудно отличить от различных родственных улиток, но ее, скорее всего, можно увидеть, потому что она самая распространенная из всех. Привередливые энтузиасты улиток могут идентифицировать взрослых экземпляров по белой губе раковины и единственному «зубу» улитки — похожей на зуб структуре в отверстии раковины.
Эти улитки живут в садах, лесах и скалистых местах; часто под плющом на стенах. Он может жить во влажной и сухой среде обитания.
Дверная улитка обыкновенная (
Clausilia bidentata )Элегантная раковина этой улитки может вырасти до 12 мм. Этот вид является одним из нескольких шпилевидных улиток, обитающих на коре или стенах деревьев. Их можно увидеть в любое время года, но чаще всего ночью или после дождя.
Встречаются в лесах и скалистых местах, где проводят время, питаясь водорослями и лишайниками.Иногда водоросли отбеливают раковину и в ее зерне появляются белые бороздки.
Дверная улитка плетеная (
Cochlodina laminata ) Эта улитка крупнее и крепче, чем Clausilia , с раковиной 15–17 мм и красновато-коричневым цветом «полированного дерева».
Они предпочитают старые леса, а также каменистую местность, питаются водорослями и растительностью и лазают по деревьям после дождя, чтобы добраться до лакомых кусочков. Молодые особи появляются весной и летом, поэтому спаривание и откладка яиц, вероятно, происходят в начале весны.
Чесночная улитка (
Oxychilus alliarius )6–8 мм. Полупрозрачная, блестящая, бледно-коричневая оболочка, темно-серое тело. Издает сильный чесночный запах, если его потревожить.
Коричневогубая улитка (
Cepaea nemoralis )Разнообразный рисунок, но обычно желтоватый и коричневый. Всегда имеет темный край у внутреннего отверстия скорлупы.
Большой прудовик (
Lymnaea stagnalis )Поедает водоросли и гниющие вещества. Самая большая прудовая улитка; раковина до 50 мм длиной, резко сужающаяся.
Большая улитка-баран (
Planorbis corneus ) Поедает водоросли и гниющие вещества. Самый крупный из нескольких подобных видов; оболочка диаметром 30–35 мм.
Самый крупный из нескольких подобных видов; оболочка диаметром 30–35 мм.
Как принять участие
- Купите ручную линзу , чтобы просматривать свои находки. Хорошей моделью является тройная лупа (10x).
- Используйте идентификационный ключ , созданный Британским конхологическим обществом на сайте conchsoc.org/node/638 .
- Отправить записи о опоясанных улитках обществу, которое помогает отслеживать их распространение в Великобритании.
| Applesnail ( Pomacea canaliculata, Pomacea insularum ) ОПИСАНИЕ: Раковина яблони желобчатой ( Pomacea canaliculata ) имеет ширину от 1,5 до 2,3 дюймов и высоту от 1,75 до 3 дюймов. Раковина имеет от 5 до 6 оборотов, которые разделены глубоким зазубренным швом, отсюда и название вида «canaliculata» или «каналообразный». ПУТИ/ИСТОРИЯ: Желеобразная яблоня произрастает в Аргентине с умеренным климатом и к северу от бассейна Амазонки. Островная яблоня, P. insularum , произрастающая в Южной Америке, исторически путалась с желобчатой яблоней, P. РИСКИ/ВЛИЯНИЕ: Инвазивные яблони могут быстро распространяться из сельскохозяйственных районов в заболоченные земли и другие естественные пресноводные системы, где они могут оказать серьезное воздействие. Как и все инвазивные виды, яблочные улитки могут конкурировать с местными видами за ограниченные ресурсы. Эти два вида улиток питаются всеми видами водных растений. Такое интенсивное потребление растений может изменить естественный баланс водной системы. Кроме того, их быстрое и обильное размножение в сочетании с отсутствием хищников в Соединенных Штатах может привести к взрывному росту их популяции, что вызовет дополнительные проблемы.Каналированная яблоня — серьезный вредитель риса во многих странах Юго-Восточной Азии. УПРАВЛЕНИЕ: После того, как все инвазивные яблочные улитки будут укоренены, искоренить их невозможно. Таким образом, основным подходом к управлению должна быть профилактика. Для предотвращения интродукции и распространения необходимо ввести строгий карантин. На рисовых полях и полях таро следует использовать растения из районов, где, как известно, нет улиток. Использование экрана на водоприемниках также может помочь замедлить распространение. ЧТО ВЫ МОЖЕТЕ СДЕЛАТЬ: Аналогичный вид, Pomacea bridgesii , является популярным аквариумным видом, который, как известно, не является инвазивным. Однако этот вид, также неместный, трудно отличить от инвазивных яблонь. Если вы настаиваете на содержании неместных улиток, делайте это в аквариуме, а не в декоративных прудах на открытом воздухе. Не выпускайте какие-либо аквариумные виды в естественную среду. Если вам больше не нужен питомец, верните его в местный зоомагазин для перепродажи или обмена, отдайте другому любителю или отдайте в школу, дом престарелых или больницу.Удалите все фрагменты растений, смойте всю грязь или мусор с оборудования и оборудования для брода и слейте всю воду с лодок, прежде чем покинуть зону доступа. Перевозка фрагментов растений на лодках, трейлерах и в живых колодцах является одним из основных путей интродукции улиток и других водных инвазивных видов в новые озера и реки. Общая профилактика вредных водных видов: не выпускайте в окружающую среду аквариумных питомцев или живой корм. ПРЕДОСТАВЛЕНИЕ ПРОФИЛЯ: Сьюзан Пасько, NOAA, Энн Мари Эйх и Дэвид Бриттон, USFWS — ПРЕДОСТАВЛЕНИЕ ИЗОБРАЖЕНИЯ: USFWS |
Масс-спектрометрия MALDI-TOF для идентификации пресноводных улиток из Сенегала, включая промежуточных хозяев шистосом
Abstract
Пресноводные улитки родов Biomphalaria , Bulinus и Oncomelania являются промежуточными хозяевами шистосом, вызывающих шистосомоз человека, одну из самых значительных инфекционных запущенных болезней в мире.Идентификация пресноводных улиток обычно основана на морфологии и, возможно, методах на основе ДНК, но у них есть много недостатков, которые затрудняют их использование. MALDI-TOF MS произвел революцию в клинической микробиологии и появился в области медицинской энтомологии. Это исследование направлено на оценку профилирования MALDI-TOF MS для идентификации как замороженных, так и хранящихся в этаноле видов улиток с использованием белковых экстрактов из разных частей тела. Всего 530 полевых образцов, принадлежащих к девяти видам ( biomphalaria pfeifferi , bulinus forkalii , bulinus senegalensis , bulinus truncatus , bulinus globosu s, bolimya Unicolor , Cleopatra BuliMaides , Lymnaea Natalensis , Melanoides tuberculata ) и 89 выращенных в лаборатории образцов, в том числе три вида ( Bi . пфайффери , бу . форскалий , Бу . truncatus ) использовались для этого исследования. Что касается замороженных улиток, для проверки оптимизированного протокола MALDI-TOF MS использовались ноги 127 полевых и 74 выращенных в лаборатории образцов. Спектральный анализ показал внутривидовую воспроизводимость и межвидовую специфичность, что привело к правильной идентификации всех образцов в слепых запросах со значениями логарифмической оценки более 1,7.
Это исследование направлено на оценку профилирования MALDI-TOF MS для идентификации как замороженных, так и хранящихся в этаноле видов улиток с использованием белковых экстрактов из разных частей тела. Всего 530 полевых образцов, принадлежащих к девяти видам ( biomphalaria pfeifferi , bulinus forkalii , bulinus senegalensis , bulinus truncatus , bulinus globosu s, bolimya Unicolor , Cleopatra BuliMaides , Lymnaea Natalensis , Melanoides tuberculata ) и 89 выращенных в лаборатории образцов, в том числе три вида ( Bi . пфайффери , бу . форскалий , Бу . truncatus ) использовались для этого исследования. Что касается замороженных улиток, для проверки оптимизированного протокола MALDI-TOF MS использовались ноги 127 полевых и 74 выращенных в лаборатории образцов. Спектральный анализ показал внутривидовую воспроизводимость и межвидовую специфичность, что привело к правильной идентификации всех образцов в слепых запросах со значениями логарифмической оценки более 1,7. На втором этапе мы продемонстрировали, что MALDI-TOF MS также можно использовать для идентификации улиток, хранящихся в этаноле, с использованием белков, извлеченных из стопы, с использованием специальной базы данных, включающей большое количество образцов, сохраненных в этаноле.Это исследование впервые показывает, что MALDI-TOF MS является надежным инструментом для быстрой идентификации замороженных и хранящихся в этаноле пресноводных улиток без какой-либо малакологической экспертизы.
На втором этапе мы продемонстрировали, что MALDI-TOF MS также можно использовать для идентификации улиток, хранящихся в этаноле, с использованием белков, извлеченных из стопы, с использованием специальной базы данных, включающей большое количество образцов, сохраненных в этаноле.Это исследование впервые показывает, что MALDI-TOF MS является надежным инструментом для быстрой идентификации замороженных и хранящихся в этаноле пресноводных улиток без какой-либо малакологической экспертизы.
Резюме автора
Шистосомоз — паразитарное заболевание, вызываемое кровяными сосальщиками рода Schistosoma . Инфекционные церкарии выделяются пресноводными улитками, принадлежащими к трем родам: Biomphalaria , Bulinus и Oncomelania . Это одно из самых значительных запущенных инфекционных заболеваний в мире.Идентификация улиток чрезвычайно важна для мониторинга популяций улиток и шистосомоза. Идентификация в настоящее время основана на морфологических критериях и молекулярной биологии, оба из которых имеют несколько недостатков. Во многих исследованиях сообщалось о производительности MALDI-TOF MS, технологии, которая позволяет идентифицировать виды на основе их белков, как надежного, быстрого и простого в использовании инструмента во многих областях. Целью нашего исследования было создание базы данных улиток и оценка эффективности MALDI-TOF MS для идентификации улиток.Это исследование показывает, что MALDI-TOF MS может быстро идентифицировать как замороженные, так и хранящиеся в этаноле образцы различных видов. Эти результаты поддерживают использование MALDI-TOF MS в контексте эпидемиологических исследований в районах, эндемичных по Schistosoma .
Во многих исследованиях сообщалось о производительности MALDI-TOF MS, технологии, которая позволяет идентифицировать виды на основе их белков, как надежного, быстрого и простого в использовании инструмента во многих областях. Целью нашего исследования было создание базы данных улиток и оценка эффективности MALDI-TOF MS для идентификации улиток.Это исследование показывает, что MALDI-TOF MS может быстро идентифицировать как замороженные, так и хранящиеся в этаноле образцы различных видов. Эти результаты поддерживают использование MALDI-TOF MS в контексте эпидемиологических исследований в районах, эндемичных по Schistosoma .
Образец цитирования: Hamlili FZ, Thiam F, Laroche M, Diarra AZ, Doucouré S, Gaye PM, et al. (2021) Масс-спектрометрия MALDI-TOF для идентификации пресноводных улиток из Сенегала, включая промежуточных хозяев шистосом.PLoS Negl Trop Dis 15(9): e0009725. https://doi.org/10.1371/journal.pntd.0009725
Редактор: Игорь С. Алмейда, Техасский университет в Эль-Пасо, США
Алмейда, Техасский университет в Эль-Пасо, США
Поступила в редакцию: 18 ноября 2020 г.; Принято: 12 августа 2021 г .; Опубликовано: 13 сентября 2021 г.
Авторское право: © 2021 Hamlili et al. Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные содержатся в рукописи и файлах вспомогательной информации. База данных Snail MALDI-TOF MS общедоступна и может быть загружена со следующим номером DOI: https://doi.org/10.35088/f605-3922.
Финансирование: Это исследование было поддержано Instituto Hospitalo-Universitaire (IHU) Méditerranée Infection, Национальным исследовательским агентством в рамках программы «Investissements d’avenir», ссылка ANR-10-IAHU-03, регион Прованс-Альпы-Кот d’Azur и европейское финансирование FEDER PRIMI. Полевые работы и содержание улиток в нашей лаборатории проводились при поддержке Института исследований и разработок (IRD) в рамках проекта «Jeune Equipe Associée à l’IRD (JEAI), ESBILH-SEN». FZH получил стипендию доктора наук от IHU Méditerranée Infection. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Полевые работы и содержание улиток в нашей лаборатории проводились при поддержке Института исследований и разработок (IRD) в рамках проекта «Jeune Equipe Associée à l’IRD (JEAI), ESBILH-SEN». FZH получил стипендию доктора наук от IHU Méditerranée Infection. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Шистосомоз человека представляет собой паразитарное заболевание улиток, вызываемое кровяными трематодами рода Schistosoma [1]. Она считается одной из самых серьезных забытых тропических болезней (ЗТБ) в мире, поскольку она занимает второе место среди наиболее эндемичных паразитарных болезней в мире после малярии [2]. Почти 800 млн человек во всем мире подвержены риску заражения и примерно 250 млн человек страдают, в основном в Африке, в том числе 20 млн человек страдают тяжелой формой [3,4]. Заболевание было зарегистрировано более чем в 78 странах и является эндемичным в 52 странах с умеренным и высоким уровнем передачи [5,6]. Ежегодно оценивается более 280 000 смертей [7], и, несмотря на усилия, которые предпринимались в течение многих лет, число людей, пораженных шистосомозом, значительно не уменьшилось [8].
Заболевание было зарегистрировано более чем в 78 странах и является эндемичным в 52 странах с умеренным и высоким уровнем передачи [5,6]. Ежегодно оценивается более 280 000 смертей [7], и, несмотря на усилия, которые предпринимались в течение многих лет, число людей, пораженных шистосомозом, значительно не уменьшилось [8].
Schistosoma видов имеют сложный биологический цикл. В него входят пресноводные улитки родов Biomphalaria , Bulinus и Oncomelania в качестве промежуточных хозяев, у которых личинки трематод подвергаются бесполому размножению, и люди в качестве окончательных хозяев, у которых происходит половое размножение [9].Наиболее распространенными болезнетворными видами являются Schistosoma haematobium , S . мансони и S . японикум [6]. Оба S . haematobium и S . mansoni встречаются в Африке и на Ближнем Востоке. В Америке только S . мансони найдено. Schistosoma japonicum встречается в Азии, в частности на Филиппинах и в Китае [1]. Передача шистосомоза в значительной степени зависит как от распространения промежуточного хозяина-улитки, так и от освоения водных ресурсов в сельской местности.Среди промежуточных хостов, вида Bulinus ( BU , Truncatus , BU , GLOBOSUS , BU . Senegalensis , BU . Forskalii , BU . Camerunensis , BU . Африкан и Bu . Tropicus ) и биомфалария ( bi . pfeifferi , bi . choanomphala , bi . Александрина , Би . sudanica ) были основными промежуточными хозяевами S . haematobium и S . mansoni соответственно в Африке [10]. Biomphalaria pfeifferi — единственный вид, передающий S . mansoni , а Bu .
мансони найдено. Schistosoma japonicum встречается в Азии, в частности на Филиппинах и в Китае [1]. Передача шистосомоза в значительной степени зависит как от распространения промежуточного хозяина-улитки, так и от освоения водных ресурсов в сельской местности.Среди промежуточных хостов, вида Bulinus ( BU , Truncatus , BU , GLOBOSUS , BU . Senegalensis , BU . Forskalii , BU . Camerunensis , BU . Африкан и Bu . Tropicus ) и биомфалария ( bi . pfeifferi , bi . choanomphala , bi . Александрина , Би . sudanica ) были основными промежуточными хозяевами S . haematobium и S . mansoni соответственно в Африке [10]. Biomphalaria pfeifferi — единственный вид, передающий S . mansoni , а Bu . пупок , Bu . шаровидный , Bu . senegalensis и Bu . truncatus участвуют в S . haematobium трансмиссия [11,12]. В Сенегале встречаются два вида шистосом: S . mansoni , вызывающий кишечный шистосомоз, и S . haematobium , известный как основной возбудитель мочевого шистосомоза [13].
пупок , Bu . шаровидный , Bu . senegalensis и Bu . truncatus участвуют в S . haematobium трансмиссия [11,12]. В Сенегале встречаются два вида шистосом: S . mansoni , вызывающий кишечный шистосомоз, и S . haematobium , известный как основной возбудитель мочевого шистосомоза [13].
Необходимость точной идентификации промежуточных хозяев улиток имеет решающее значение для точных эпидемиологических исследований и борьбы с шистосомозом, а также способствует разработке новых эффективных стратегий борьбы [14].
Классификация улиток основывается главным образом на морфологических критериях. Однако правильная идентификация улиток Bulinus до уровня вида на основании только морфологии может быть сложной задачей [15,16]. Это также требует огромного опыта, а также неповрежденных образцов и специальной документации. В дополнение к морфологическим методам идентификации видов улиток также использовались молекулярные методы, такие как секвенирование области внутреннего транскрибируемого спейсера 2 улитки ( ITS2 ) и гена субъединицы I цитохром-с-оксидазы ( COI ) [17,18]. Однако молекулярные подходы ограничены тем, что требуют много времени и относительно высокими эксплуатационными расходами. Отсутствие эталонных последовательностей в GenBank также может препятствовать их использованию.
Однако молекулярные подходы ограничены тем, что требуют много времени и относительно высокими эксплуатационными расходами. Отсутствие эталонных последовательностей в GenBank также может препятствовать их использованию.
За последнее десятилетие MALDI-TOF MS (матричная лазерная десорбция/ионизационная времяпролетная масс-спектрометрия) произвела революцию в клинической микробиологии, обеспечив быструю и точную классификацию многих микроорганизмов (паразитов, грибков и бактерий). [19–26]. Совсем недавно MALDI-TOF MS стала надежным инструментом исследования в энтомологии, поскольку она была успешно применена к нескольким членистоногим-гематофагам с использованием определенных частей тела [27-29].Насколько нам известно, этот инновационный инструмент был впервые использован для идентификации морских гребешков [30], но еще не применялся для идентификации улиток, имеющих медицинское значение. Таким образом, цель этого исследования заключалась в оценке эффективности этого протеомного инструмента для идентификации замороженных и хранящихся в этаноле образцов улиток, включая виды, вовлеченные в передачу шистосом.
Методы
Заявление об этике
Исследование получило одобрение Национального комитета по этике Сенегала для исследований в области здравоохранения (CNERS), номер: 000017/MSAS/DPRS/CNERS.Дата: 2018-03-15.
Улитки
Улитки были собраны в эндемичных по шистосомозу районах Сенегала. Исследование проводилось с 2018 по 2019 год Ниахаром и Ричардом Толлом (рис. 1). Ричард Толл — город, расположенный на южном берегу реки Сенегал между 16°27 северной широты и 15°42 западной долготы. Средняя дневная температура составляет 29°C, колеблясь в среднем от минимума 22°C до максимума 36°C. Самые дождливые месяцы — июль, август и сентябрь. Ниахар (14°30 с.ш., 16°30 з.д.) — сельский район, расположенный в центральной части Сенегала, в 135 км к востоку от столицы Дакара.Он расположен в сахелианско-суданском климатическом районе с температурой от 24°C в декабре до 30°C в июне [31].
Рис. 1. Карта Сенегала с указанием мест сбора улиток и список пресноводных улиток, собранных в двух местах в Сенегале.
(I) Карта Сенегала с указанием участков, с которых производился сбор проб. «R» относится к видам, собранным в Ричарде Толле; Biomphalaria pfeifferi (239), Bulinus truncatus (127), Lymnaea natalensis (38), Melanoides tuberculata (37), Bellamya unicolor (20), C«N» относится к Bulinus senegalensis (68), собранному в Ниакаре и морфологически идентифицированному. (II) показаны раковины пресноводных улиток, подтвержденные молекулярно: Bu . форскалия (А), Бу . усеченный (Б), М . tuberculata (C), Be . одноцветный (D), L . natalensis (E), C . булимоиды (F) и Bi . пфайфери (Г).Карта, использованная в этом исследовании, не защищена авторским правом. Карта Сенегала: QGIS.org, 2021. Географическая информационная система QGIS. Ассоциация QGIS. http://www.qgis.org.
https://doi. org/10.1371/journal.pntd.0009725.g001
org/10.1371/journal.pntd.0009725.g001
В Ричард-Толле сбор улиток проводился в русле Тауэя реки Сенегал, а в Ниахаре улиток собирали из временных прудов. Улиток собирали с водных растений, опавших листьев и веток и любых твердых предметов в воде.Затем выздоровевших улиток транспортировали в лабораторию в предварительно маркированных пластиковых контейнерах, на которых указывалось место сбора (название местности, дата сбора). Затем их промывали для удаления грязи и подсчитывали. Таксономический статус отобранных особей оценивали с помощью микроскопии (Zeiss Axio Zoom.V16, Zeiss, Марли-ле-Руа, Франция) на уровне вида с использованием ключей идентификации, основанных на морфологии раковины улитки [32,33]. Затем каждую идентифицированную улитку помещали в стеклянную пробирку, содержащую 10 мл фильтрованной воды, и подвергали воздействию электрического света в течение 30–40 минут в рамках теста на выделение Schistosoma церкарий [34,35].Отрицательных особей выращивали в лаборатории до получения взрослых потомков, некоторые из которых затем содержали при -20°C (лабораторно выращенные улитки) для протеомных и молекулярных исследований. Кроме того, использовалась вторая проба улиток, собранная в поле и хранившаяся при -20°С или в 70% об./об. этаноле. Для исследования также использовали другие замороженные выращенные в лаборатории экземпляры улиток первого поколения. Образцы улиток транспортировались осторожно, чтобы убедиться, что они остались неповрежденными по пути в нашу лабораторию в Марселе (Франция) для протеомных и молекулярных исследований.
Кроме того, использовалась вторая проба улиток, собранная в поле и хранившаяся при -20°С или в 70% об./об. этаноле. Для исследования также использовали другие замороженные выращенные в лаборатории экземпляры улиток первого поколения. Образцы улиток транспортировались осторожно, чтобы убедиться, что они остались неповрежденными по пути в нашу лабораторию в Марселе (Франция) для протеомных и молекулярных исследований.
Оптимизация протокола MALDI-TOF MS
Замороженные образцы улиток.
Из сотен образцов, сохранившихся при -20°C, Bi . pfeifferi (n = 15), Bu . truncatus (n = 13) и Bu . senegalensis (n = 3) использовали для разработки протокола MALDI-TOF MS, который включал пять протестированных протоколов. Раковины улиток осторожно удаляли, и улиток препарировали под стереомикроскопом Leica ES2 10x/30x с использованием нового стерильного лезвия для извлечения ноги и головы.Нога улитки была выбрана для оптимизации протокола MALDI-TOF MS, поскольку было заявлено, что она является хорошим источником белков, чем другие ткани [36]. Рассеченные части промывали последовательно 70% этанолом, затем дистиллированной водой в течение 2 минут и сушили на стерильной фильтровальной бумаге для анализа MALDI-TOF MS. Остальные части сохраняли при -20°C для молекулярной биологии и дополнительного анализа.
Рассеченные части промывали последовательно 70% этанолом, затем дистиллированной водой в течение 2 минут и сушили на стерильной фильтровальной бумаге для анализа MALDI-TOF MS. Остальные части сохраняли при -20°C для молекулярной биологии и дополнительного анализа.
Мы протестировали пять различных протоколов, используя только две части тела (голову и/или ступню), гомогенизированные в экстракционном растворе, состоящем из смеси (50/50) 70% (об./об.) муравьиной кислоты (Sigma-Aldrich, Lyon, Франция) и 50% (об./об.) ацетонитрила (Fluka, Buchs, Швейцария) в соответствии со стандартизированными автоматическими настройками, описанными ранее [37–39].Разница между этими протоколами заключается не только в используемых частях тела, но и в объеме экстракционного раствора (30 мкл или 40 мкл) и методе гомогенизации: стеклянные шарики ≤ 106 мкм (Sigma Aldrich, Сент-Луис, Миссури, США). или вольфрамовые шарики (Qiagen GmbH, Hilden, Германия) (табл. 1). Все препараты гомогенизировали на приборе Tissue Lyser II (Qiagen, Германия) с оптимизированными параметрами (три 1-минутных цикла при частоте 30 Гц) [37]. Первоначально протоколы оценивались на основе внутривидовой воспроизводимости, интенсивности спектров ≥ 3 .000 условных единиц [а.е.], количество пиков МС и простота протокола. В различных протестированных протоколах было несколько переменных, включая объем экстракционного раствора для выбора оптимального объема для экстракции белка, гранулы для гомогенизации, используемые части улиток и виды улиток. Вся информация о протоколах обобщена в таблице 1. Наконец, мы применили оптимизированный протокол к оставшимся образцам улиток, пытаясь проверить выбранный протокол.
Образцы улиток, хранящихся в этаноле.
Второй протокол был разработан специально для образцов, хранящихся в этаноле. Из 84 образцов, сохраненных в этаноле, 13 были использованы для оптимизации протокола. Каждую отсеченную стопу дважды промывали в дистиллированной воде, затем сушили в течение ночи при 37°C перед гомогенизацией для удаления этанола, как описано ранее [40]. Затем для подготовки образцов улиток сравнивали три протокола, в которых мы варьировали количество экстракционного раствора или измельчающего агента (стеклянные шарики ≤ 106 мкм или вольфрамовые шарики). Все протоколы описаны в таблице 1. Гомогенизацию проводили так же, как и для замороженных образцов, описанных выше.
Все протоколы описаны в таблице 1. Гомогенизацию проводили так же, как и для замороженных образцов, описанных выше.
Загрузка образца на планшет-мишень и настройки MALDI-TOF MS
Все гомогенаты центрифугировали при 2000 g в течение 30 секунд и по 1 мкл каждого супернатанта наносили на стальную пластину-мишень (Bruker Daltonics) в четырех повторах. Один микролитр матричной суспензии CHCA, состоящей из насыщенной альфа-циано-4-гидроксикоричной кислоты (Sigma, Lyon.Франция), 50 % ацетонитрила (об./об.), 2,5 % трифторуксусной кислоты (об./об.) (Aldrich, Дорсет, Великобритания) и воду для ВЭЖХ [38, 40, 41] наносили непосредственно на каждый образец на планшете-мишени для допускают сокристаллизацию, затем сушили на воздухе при комнатной температуре перед помещением в прибор MALDI-TOF MS (Bruker Daltonics, Германия) для анализа. Масс-спектрометрический анализ проводили с использованием масс-спектрометра Microflex LT MALDI-TOF (аппарат Bruker Daltonics) с программным обеспечением Flex Control (Bruker Daltonics). Измерения проводились в линейном режиме положительных ионов [26] в диапазоне масс 2–20 кДа. Каждый спектр соответствовал ионам, полученным в результате 240 лазерных импульсов, выполненных в шести областях одного и того же пятна. Профили спектра визуализировали с помощью анализа Flex версии 3.3, затем экспортировали в программное обеспечение Biotyper версии 3.0 и ClinProTools v.2.2 для анализа.
Измерения проводились в линейном режиме положительных ионов [26] в диапазоне масс 2–20 кДа. Каждый спектр соответствовал ионам, полученным в результате 240 лазерных импульсов, выполненных в шести областях одного и того же пятна. Профили спектра визуализировали с помощью анализа Flex версии 3.3, затем экспортировали в программное обеспечение Biotyper версии 3.0 и ClinProTools v.2.2 для анализа.
Спектральный анализ и создание эталонной базы данных
Инструмент Composite Correlation Index (CCI) (MALDI-Biotyper v3.0., Bruker Daltonics) использовали для оценки вариаций спектров в каждой группе образцов в соответствии с проверенным протоколом, как описано ранее [42]. CCI рассчитывали с использованием стандартных настроек диапазона масс 3000–12000 Да, разрешения 4, 8 интервалов и выключенной автокорреляции. Более высокие значения корреляции (выраженные средним значением ± стандартное отклонение [SD]) отражают более высокую воспроизводимость спектров МС (значение совпадения CCI, равное 1, представляет собой полную корреляцию, тогда как значение совпадения CCI, равное 0, представляет отсутствие корреляции) [42]. Пики МС и расчет интенсивности как головы, так и стопы были проанализированы с использованием программного обеспечения ClinProTools v.2.2.
Пики МС и расчет интенсивности как головы, так и стопы были проанализированы с использованием программного обеспечения ClinProTools v.2.2.
Профили спектра, полученные от видов улиток, были визуализированы с помощью анализа Flex v.3.3, а затем экспортированы в программные пакеты ClinProTools v.2.2 (Bruker Daltonics, Германия) для обработки данных (сглаживание, вычитание базовой линии) [37,43]. Внутривидовая воспроизводимость и межвидовая специфичность оценивались путем сравнения и анализа спектральных профилей, полученных от четырех пятен каждого отдельного экземпляра улитки.Качество спектра подтверждалось путем оценки его интенсивности, сглаженности пиков, плоскостности базовой линии и его воспроизводимости по сравнению с другими спектрами МС той же категории. Спектры МС низкого качества (интенсивность <3000 условных единиц [а.е.], наличие фонового шума) были исключены из анализа. Дендрограмму строили с использованием программного обеспечения MALDI-Biotyper v.3.0 для визуализации уровня неоднородности спектров МС от образцов разных видов (иерархическая кластеризация масс-спектров). Для оценки влияния метода хранения на качество МС-спектров проведено сравнение МС-спектров 4 образцов каждого вида ( Bi, , pfeifferi, , Bu, , truncatus, , Bu, , forskalii). ), консервированных либо в этаноле, либо при -20°C, выполняли с использованием дендрограммы MS (MALDI-Biotyper v.3.0) и анализа главных компонентов (программное обеспечение ClinProTools). Среднее значение интенсивности пиков и количество пиков также рассчитывали для этих МС-спектров.Спектры MS хорошего качества (высокая интенсивность пика и воспроизводимость) от каждого вида, законсервированного либо в этаноле, либо при -20°C, были отобраны и добавлены в базу данных после однозначной молекулярной идентификации. Схема исследования представлена на блок-схеме, представленной на рис. 2.
Для оценки влияния метода хранения на качество МС-спектров проведено сравнение МС-спектров 4 образцов каждого вида ( Bi, , pfeifferi, , Bu, , truncatus, , Bu, , forskalii). ), консервированных либо в этаноле, либо при -20°C, выполняли с использованием дендрограммы MS (MALDI-Biotyper v.3.0) и анализа главных компонентов (программное обеспечение ClinProTools). Среднее значение интенсивности пиков и количество пиков также рассчитывали для этих МС-спектров.Спектры MS хорошего качества (высокая интенсивность пика и воспроизводимость) от каждого вида, законсервированного либо в этаноле, либо при -20°C, были отобраны и добавлены в базу данных после однозначной молекулярной идентификации. Схема исследования представлена на блок-схеме, представленной на рис. 2.
Рис. 2. Блок-схема, показывающая план исследования и все образцы, собранные из первой и второй полевых коллекций [2018–2019 гг.], а также те, которые использовались для каждого этапа исследования.
Дизайн исследования разделен на три части: (A) оптимизация протокола, (B) создание базы данных и (C) проверка с помощью слепого теста.Указаны численность и виды полевых и лабораторных пресноводных улиток.
https://doi.org/10.1371/journal.pntd.0009725.g002
Слепой тест для подтверждения исследования
Исследование было подтверждено слепым тестом (программное обеспечение MALDI-Biotyper v.3.0, Bruker Daltonics) с использованием замороженных и хранившихся в этаноле образцов улиток, за исключением тех, которые использовались в качестве эталонных спектров МС. Результаты представлены в виде значений логарифмической оценки (LSV), которые соответствуют степени гомологии между запросом и эталонными спектрами МС.Это значение может варьироваться от 0 до 3. Спектр с самой высокой LSV среди четырех пятен был выбран в качестве достоверной идентификации [40].
Экстракция ДНК и молекулярные исследования улиток
Каждую оставшуюся половину тела улитки промывали дистиллированной водой и сушили на стерильной фильтровальной бумаге. Геномную ДНК экстрагировали с использованием набора EZ1 DNA Tissue Kit (Qiagen) в соответствии с рекомендациями производителя. Каждый образец улитки инкубировали при 56°С в течение ночи в 180 мкл лизирующего буфера G2 (Qiagen Hilden, Германия) и 20 мкл протеиназы К (Qiagen Hilden, Германия).Затем экстракцию ДНК проводили с помощью устройства для экстракции EZ1 BioRobot (Qiagen Hilden, Германия). Геномную ДНК из каждого образца элюировали 100 мкл буфера Tris-EDTA (Qiagen) и сохраняли при -20°C для использования в молекулярном анализе. Для молекулярной идентификации видов улиток образцы ДНК, полученные из образцов, используемых в качестве эталонных спектров МС, подвергали стандартной ПЦР в автоматическом термоциклере ДНК (Applied Biosystems, 2720, Фостер-Сити, США). Два гена ( COI , 16S ) были частично секвенированы.Область из 710 пар оснований гена субъединицы цитохром с оксидазы I (COI ) была амплифицирована с использованием универсальных праймеров для штрих-кодирования Folmer COI (LCO1490, HCO2198) [44], а для 16S — 16S ar и 16S br-H праймеры, нацеленные на 550 п.
Геномную ДНК экстрагировали с использованием набора EZ1 DNA Tissue Kit (Qiagen) в соответствии с рекомендациями производителя. Каждый образец улитки инкубировали при 56°С в течение ночи в 180 мкл лизирующего буфера G2 (Qiagen Hilden, Германия) и 20 мкл протеиназы К (Qiagen Hilden, Германия).Затем экстракцию ДНК проводили с помощью устройства для экстракции EZ1 BioRobot (Qiagen Hilden, Германия). Геномную ДНК из каждого образца элюировали 100 мкл буфера Tris-EDTA (Qiagen) и сохраняли при -20°C для использования в молекулярном анализе. Для молекулярной идентификации видов улиток образцы ДНК, полученные из образцов, используемых в качестве эталонных спектров МС, подвергали стандартной ПЦР в автоматическом термоциклере ДНК (Applied Biosystems, 2720, Фостер-Сити, США). Два гена ( COI , 16S ) были частично секвенированы.Область из 710 пар оснований гена субъединицы цитохром с оксидазы I (COI ) была амплифицирована с использованием универсальных праймеров для штрих-кодирования Folmer COI (LCO1490, HCO2198) [44], а для 16S — 16S ar и 16S br-H праймеры, нацеленные на 550 п. н. гена 16S [45]. Амплифицированные продукты визуализировали на 1,5% агарозном геле, окрашенном SYBR Safe, затем очищали с использованием планшета Macherey Nagel (NucleoFast 96 PCR, Düren, Germany). Секвенирование проводили на приборе BigDye Terminator v1.1, v3.1 5x Sequencing Buffer (Applied Biosystems, Уоррингтон, Великобритания) и запустить на автоматическом секвенаторе. Хроматограммы последовательностей собирали и редактировали с помощью Chromas Pro1.77 (Technelyium Pty. Ltd, Тевантин, Австралия). Полученные последовательности использовали для поиска BLAST [46] в базе данных GenBank Национального центра биотехнологической информации (NCBI), а затем сравнивали с помощью (MEGA7) [47]. Филогенетическое дерево было построено и отредактировано с использованием метода максимального правдоподобия с выбором модели, определяемой MEGA7 и FigTree 1.4.2 соответственно [48,49]. Статистическая поддержка внутренних ветвей деревьев оценивалась путем начальной загрузки с 1000 итераций.
н. гена 16S [45]. Амплифицированные продукты визуализировали на 1,5% агарозном геле, окрашенном SYBR Safe, затем очищали с использованием планшета Macherey Nagel (NucleoFast 96 PCR, Düren, Germany). Секвенирование проводили на приборе BigDye Terminator v1.1, v3.1 5x Sequencing Buffer (Applied Biosystems, Уоррингтон, Великобритания) и запустить на автоматическом секвенаторе. Хроматограммы последовательностей собирали и редактировали с помощью Chromas Pro1.77 (Technelyium Pty. Ltd, Тевантин, Австралия). Полученные последовательности использовали для поиска BLAST [46] в базе данных GenBank Национального центра биотехнологической информации (NCBI), а затем сравнивали с помощью (MEGA7) [47]. Филогенетическое дерево было построено и отредактировано с использованием метода максимального правдоподобия с выбором модели, определяемой MEGA7 и FigTree 1.4.2 соответственно [48,49]. Статистическая поддержка внутренних ветвей деревьев оценивалась путем начальной загрузки с 1000 итераций.
Молекулярный скрининг инфекции
Schistosoma сохраненных в этаноле образцов были проверены на наличие паразитов с использованием праймеров (Smcyt748F-Smcyt847R) и зонда (Smcyt785T FAM), нацеленных на последовательность COI из S . мансони [50]. Повторяющаяся последовательность DRA1 из S . haematobium (ШПЦР) амплифицировали с использованием праймеров (Sh-FW и Sh-RV) [51] и зонда Cnops [52]. Количественную ПЦР проводили на выделенной ДНК с использованием системы обнаружения CFX96 Touch (Bio-Rad, Marnes-la-Coquette, Франция) с Light Cycler Probes Master (Индианаполис, США). Наша реакционная смесь для количественной ПЦР включала 5 мкл ДНК, 10 мкл мастер-микса, 3,5 мкл стерильной дистиллированной воды и по 0,5 мкл каждого из праймеров и зондов. Для каждого планшета для количественной ПЦР использовали отрицательный и положительный контроли. Schistosoma haematobium и S . mansoni , ранее полученные от улиток, инфицированных этими видами, использовали в качестве положительного контроля, в то время как отрицательный контроль состоял из 20 мкл реакционной смеси для количественной ПЦР без какой-либо ДНК.
мансони [50]. Повторяющаяся последовательность DRA1 из S . haematobium (ШПЦР) амплифицировали с использованием праймеров (Sh-FW и Sh-RV) [51] и зонда Cnops [52]. Количественную ПЦР проводили на выделенной ДНК с использованием системы обнаружения CFX96 Touch (Bio-Rad, Marnes-la-Coquette, Франция) с Light Cycler Probes Master (Индианаполис, США). Наша реакционная смесь для количественной ПЦР включала 5 мкл ДНК, 10 мкл мастер-микса, 3,5 мкл стерильной дистиллированной воды и по 0,5 мкл каждого из праймеров и зондов. Для каждого планшета для количественной ПЦР использовали отрицательный и положительный контроли. Schistosoma haematobium и S . mansoni , ранее полученные от улиток, инфицированных этими видами, использовали в качестве положительного контроля, в то время как отрицательный контроль состоял из 20 мкл реакционной смеси для количественной ПЦР без какой-либо ДНК.
Результаты
Морфологическая идентификация улиток
В Сенегале было собрано в общей сложности 530 экземпляров пресноводных улиток (с 2018 по 2019 год), которые морфологически идентифицированы как Bi . pfeifferi (n = 239), Bu . truncatus (n = 127), Bu . senegalensis (n = 68), L . natalensis (n = 38), М . tuberculata (n = 37), Be . одноцветный (n = 20) и Cleopatra bulimoides (n = 1). Кроме того, 89 выращенных в лаборатории образцов, в том числе Bi . pfeifferi (n = 31), Bu . truncatus (n = 30) и Bu . senegalensis (n = 28) также использовались для исследования.Фотографии каждого вида представлены на рис. 1.
pfeifferi (n = 239), Bu . truncatus (n = 127), Bu . senegalensis (n = 68), L . natalensis (n = 38), М . tuberculata (n = 37), Be . одноцветный (n = 20) и Cleopatra bulimoides (n = 1). Кроме того, 89 выращенных в лаборатории образцов, в том числе Bi . pfeifferi (n = 31), Bu . truncatus (n = 30) и Bu . senegalensis (n = 28) также использовались для исследования.Фотографии каждого вида представлены на рис. 1.
Стандартизация протокола MALDI-TOF MS для замороженных образцов
Профили МС улитки из трех образцов Bi . pfeifferi на протокол сравнивались с использованием Flex Analysis на основе спектрального качества. При визуальном осмотре спектры МС, полученные по протоколу h3 (голова, стеклянные шарики и 40 мкл смеси), протоколу FH (нога-голова, стеклянные шарики и 30 мкл смеси) и протоколу F (нога, стеклянные шарики и 30 мкл смеси), имели более высокие значения. качества по сравнению с протоколом h4 (головка, стеклянные шарики и 30 мкл смеси) и протоколом h2 (головка, вольфрамовые шарики и 40 мкл смеси) (рис. 3А).Визуальное сравнение профилей МС с использованием неконтролируемого статистического теста (PCA, программное обеспечение ClinProtools) показало, что точки, соответствующие спектрам МС от h3, FH, F, отделены от точек h2, h4 (рис. 3B). Используя ClinProtools, вклады PC1, PC2 и PC3 в создание профиля в процентах, на графике объясненной дисперсии, составили приблизительно 38,18%, 16,81% и 11,36% соответственно, как показано на следующем рисунке S1. устойчивость к анализам, воспроизводимость спектров МС для каждого протокола была объективизирована с использованием матрицы CCI.Самый высокий CCI (рис. 3C) был получен для протокола h3 (среднее ± SD: 0,88 ± 0,08) и протокола F (среднее ± SD: 0,84 ± 0,13), чем для других протоколов. Сравнение количества пиков МС и интенсивности образцов, соответствующих головке (h3) и (F), показало, что средняя интенсивность и количество пиков МС генерируются Bi .
качества по сравнению с протоколом h4 (головка, стеклянные шарики и 30 мкл смеси) и протоколом h2 (головка, вольфрамовые шарики и 40 мкл смеси) (рис. 3А).Визуальное сравнение профилей МС с использованием неконтролируемого статистического теста (PCA, программное обеспечение ClinProtools) показало, что точки, соответствующие спектрам МС от h3, FH, F, отделены от точек h2, h4 (рис. 3B). Используя ClinProtools, вклады PC1, PC2 и PC3 в создание профиля в процентах, на графике объясненной дисперсии, составили приблизительно 38,18%, 16,81% и 11,36% соответственно, как показано на следующем рисунке S1. устойчивость к анализам, воспроизводимость спектров МС для каждого протокола была объективизирована с использованием матрицы CCI.Самый высокий CCI (рис. 3C) был получен для протокола h3 (среднее ± SD: 0,88 ± 0,08) и протокола F (среднее ± SD: 0,84 ± 0,13), чем для других протоколов. Сравнение количества пиков МС и интенсивности образцов, соответствующих головке (h3) и (F), показало, что средняя интенсивность и количество пиков МС генерируются Bi . pfeifferi головы (средняя интенсивность: 224,0342, количество МС-пиков: 87) выше, чем у ступни (средняя интенсивность: 173,0325, количество МС-пиков: 74) (таблица S1).Для дальнейшего анализа MALDI-TOF MS мы выбрали протокол F, поскольку стопа обычно содержит паразитов и потенциально может использоваться для обнаружения Schistosoma .
pfeifferi головы (средняя интенсивность: 224,0342, количество МС-пиков: 87) выше, чем у ступни (средняя интенсивность: 173,0325, количество МС-пиков: 74) (таблица S1).Для дальнейшего анализа MALDI-TOF MS мы выбрали протокол F, поскольку стопа обычно содержит паразитов и потенциально может использоваться для обнаружения Schistosoma .
Рис. 3. Сравнение спектров MALDI-TOF MS Bi . pfeifferi с использованием разных протоколов (H: голова, FH: нога-голова, F: нога).
(A) Типичные спектры МС от Bi . pfeifferi головка (h2, h3, h4), ступня-головка (FH) и ступня (F). (B) Отличие спектров MALDI-TOF MS от Bi . pfeifferi между протоколами по сравнению с анализом основных компонентов с использованием ClinProTools v.2.2; протокол h2 (40 мкл Mix+ вольфрамовые шарики), протокол h3 (40 мкл Mix+ стеклянные шарики), протокол h4 (30 мкл Mix+ стеклянные шарики), протокол FH (30 мкл Mix+ стеклянные шарики) и протокол F (30 мкл Mix+ стеклянные шарики). (C) Оценка воспроизводимости спектров МС, созданных пятью протоколами с использованием составного индекса корреляции (CCI). Параметры МС: интенсивность ≥ 3,000 [а.е.], отсутствие фонового шума и воспроизводимость спектров МС.а.е.: условные единицы; m / z : отношение массы к заряду. Протокол F был выбран для создания эталонной базы данных MS и проведения анализа.
(C) Оценка воспроизводимости спектров МС, созданных пятью протоколами с использованием составного индекса корреляции (CCI). Параметры МС: интенсивность ≥ 3,000 [а.е.], отсутствие фонового шума и воспроизводимость спектров МС.а.е.: условные единицы; m / z : отношение массы к заряду. Протокол F был выбран для создания эталонной базы данных MS и проведения анализа.
https://doi.org/10.1371/journal.pntd.0009725.g003
MS-идентификация замороженных видов улиток
Для оценки внутривидовой воспроизводимости и межвидовой специфичности были случайным образом отобраны 127 из 186 замороженных образцов улиток, в том числе Bi . pfeifferi (n = 40), Bu . truncatus (n = 30), M . tuberculata (n = 23), L . natalensis (n = 20), Be . одноцветные (n = 13) и C . bulimoides (n = 1) (рис. 2). 74/89 выращенных в лаборатории образцов, принадлежащих к Bi . pfeifferi (n = 31), Bu . truncatus (n = 30) и Bu . senegalensis (n = 13) также использовали для анализа MALDI-TOF MS с использованием выбранного протокола F (рис. 2).Было показано, что в диапазоне масс от 2 до 20 кДа спектры МС для каждого вида улиток являются специфическими с высокой интенсивностью сигнала (рис. 4А). Профили белка MS от одного до пяти образцов каждого вида улиток были выбраны случайным образом и использованы для создания дендрограммы (рис. 4B). Кластерный анализ показал, что профили МС каждого вида (с подтвержденными последовательностями ДНК) имеют специфический спектральный отпечаток, поскольку образцы одного и того же вида были сгруппированы в одних и тех же ветвях. Затем была создана база данных с использованием MALDI-Biotyper 3.0 и обновлены спектрами МС высокого качества. Чтобы определить, является ли MALDI-TOF MS эффективным способом различения видов по профилям MS, 166 образцов, включая выращенные в лаборатории и полевые образцы, были опрошены в базе данных, которая включает семь видов, идентифицированных на молекулярном уровне: Bu .
pfeifferi (n = 31), Bu . truncatus (n = 30) и Bu . senegalensis (n = 13) также использовали для анализа MALDI-TOF MS с использованием выбранного протокола F (рис. 2).Было показано, что в диапазоне масс от 2 до 20 кДа спектры МС для каждого вида улиток являются специфическими с высокой интенсивностью сигнала (рис. 4А). Профили белка MS от одного до пяти образцов каждого вида улиток были выбраны случайным образом и использованы для создания дендрограммы (рис. 4B). Кластерный анализ показал, что профили МС каждого вида (с подтвержденными последовательностями ДНК) имеют специфический спектральный отпечаток, поскольку образцы одного и того же вида были сгруппированы в одних и тех же ветвях. Затем была создана база данных с использованием MALDI-Biotyper 3.0 и обновлены спектрами МС высокого качества. Чтобы определить, является ли MALDI-TOF MS эффективным способом различения видов по профилям MS, 166 образцов, включая выращенные в лаборатории и полевые образцы, были опрошены в базе данных, которая включает семь видов, идентифицированных на молекулярном уровне: Bu . усеченный (9), Би . pfeifferi (6), Bu . форскалия (4), Be . одноцветный (2), L . natalensis (3), М . tuberculata (2) и C . булимоиды (1). Слепой тест по базе данных показал правильную идентификацию для всех образцов (100%) на уровне видов с баллами LSV между 1,746 и 2,748, которые представлены на рис. 4C и в таблице 2. Медиана значений логарифмических баллов составляет 2,362, а среднее LSV составляет 2,313 ± 0,238. База данных Snail MALDI-TOF MS общедоступна и может быть загружена со следующим номером DOI: https://doi.орг/10.35088/f605-3922.
усеченный (9), Би . pfeifferi (6), Bu . форскалия (4), Be . одноцветный (2), L . natalensis (3), М . tuberculata (2) и C . булимоиды (1). Слепой тест по базе данных показал правильную идентификацию для всех образцов (100%) на уровне видов с баллами LSV между 1,746 и 2,748, которые представлены на рис. 4C и в таблице 2. Медиана значений логарифмических баллов составляет 2,362, а среднее LSV составляет 2,313 ± 0,238. База данных Snail MALDI-TOF MS общедоступна и может быть загружена со следующим номером DOI: https://doi.орг/10.35088/f605-3922.
Рис. 4. Спектры MALDI-TOF MS, полученные от различных видов улиток для создания базы данных.
(A) Спектральное выравнивание семи видов улиток, показывающее отличительные пики с использованием программного обеспечения Flex Analysis; сглаженные спектры с вычтенной базовой линией. (B) Дендрограмма спектров MALDI-TOF MS видов улиток, собранных в Сенегале. Кластерный анализ проводили с помощью программного обеспечения Biotyper v.3.0. (C) Графическое представление, показывающее классификацию значений логарифмической оценки в соответствии со следующими видами: Bu . форскалий , Бу . усеченный , М . tuberculata , Be . одноцветный , L . natalensis и Bi . пфайфери .
Кластерный анализ проводили с помощью программного обеспечения Biotyper v.3.0. (C) Графическое представление, показывающее классификацию значений логарифмической оценки в соответствии со следующими видами: Bu . форскалий , Бу . усеченный , М . tuberculata , Be . одноцветный , L . natalensis и Bi . пфайфери .
https://doi.org/10.1371/journal.pntd.0009725.g004
Стандартизация протокола MALDI-TOF MS для образцов, хранящихся в этаноле
Biomphalaria pfeifferi стопы использовались для каждого протокола и подвергались анализу MALDI-TOF MS.Оба протокола F1 и F2 давали спектры МС низкого качества (интенсивность и воспроизводимость) по сравнению с протоколом F3. Анализ основных компонентов PCA (рис. 5А) выявил четкое различие между протоколом F3 и протоколами F2 и F1; показывая, что спектры МС по протоколу F3 заметно лучше (высокая интенсивность пиков), чем спектры МС, полученные по протоколам F1 и F2. При использовании ClinProtools вклады PC1, PC2 и PC3 в формирование профиля на процентном графике объясненной дисперсии составили примерно 35.65 %, 26 % и 17,39 % соответственно, как показано на следующем рисунке S2, рис.
При использовании ClinProtools вклады PC1, PC2 и PC3 в формирование профиля на процентном графике объясненной дисперсии составили примерно 35.65 %, 26 % и 17,39 % соответственно, как показано на следующем рисунке S2, рис.
Рис. 5. Сравнение спектров MALDI-TOF MS от основания образцов, хранившихся в этаноле.
(A) Сравнение спектров MALDI-TOF MS трех различных протоколов анализа основных компонентов с использованием ClinProTools v.2.2; протокол F1 (30 мкл Mix+ стеклянные шарики), протокол F2 (30 мкл Mix+ вольфрамовые шарики) и протокол F3 (15 мкл Mix+ стеклянные шарики). (B) Репрезентативные спектры МС Bi . pfeifferi , полученные для каждого протокола, проанализированы с помощью анализа Flex.(C) Дендрограмма иерархической кластеризации Bi . пфайффери , бу . усеченный , бу . шаровидный , Bu . форскалия и Bu . senegalensis в программе Biotyper v. 3.0. (D) Репрезентативные профили MALDI-TOF MS Bi . пфайффери , бу . усеченный , бу . шаровидный , Bu . форскалия и Бу . senegalensis с использованием протокола F3, выполненного с использованием программного обеспечения Flex Analysis. а.е.: условные единицы; m / z : отношение массы к заряду. Ось X представляет PC1, а ось Y представляет PC2.
3.0. (D) Репрезентативные профили MALDI-TOF MS Bi . пфайффери , бу . усеченный , бу . шаровидный , Bu . форскалия и Бу . senegalensis с использованием протокола F3, выполненного с использованием программного обеспечения Flex Analysis. а.е.: условные единицы; m / z : отношение массы к заряду. Ось X представляет PC1, а ось Y представляет PC2.
https://doi.org/10.1371/journal.pntd.0009725.g005
Анализ профиля спектра с использованием Flex Analysis показал, что спектры МС по протоколу F3 были хорошего качества, но некоторые образцы показали слегка расходящиеся профили (рис. 5B). Для проверки протокола F3 было использовано 80 образцов из 160 (рис. 2).Из 80 МС-спектров, проанализированных с помощью Flex-анализа, 57 МС-спектров были хорошего качества. Кластерный анализ (рис. 5C) показал, что случайно выбранные образцы вида Bi . pfeifferi (n = 4), Bu . truncatus (n = 3), Bu . шаровидный (n = 3), Bu . форскалия (n = 3) и Bu . senegalensis (n = 1) были сгруппированы вместе. Профили MS Bi . пфайффери , бу . усеченный , бу . шаровидный , Bu . форскалия и Бу . senegalensis представлены на рис. 5D. Поэтому была создана специальная база данных, включающая семнадцать спектров МС: Bi . pfeifferi (n = 9), Bu . truncatus (n = 4), Bu . форскалии (n = 2), Бу . globosus (n = 1) и Bu . senegalensis (n = 1), а остальные 40 спектров МС использовали для слепого теста (табл. 3).Из 40 экз. 22/22 Bi . pfeifferi , 3/10 Bu . усеченный , 4/6 Бу . форскалия и 2/2 Бу .
 globosus были правильно идентифицированы на видовом уровне (77,50%). Их LSV колебались от 1,705 до 2,529 (таблица 3). Анализ основных компонентов (рис. S3) выявил четкое различие между спектрами МС образцов одного и того же вида, хранившихся либо при -20°С, либо в этаноле. Сравнение спектров МС при обоих условиях хранения с использованием дендрограммы также показало, что спектры МС замороженных образцов каждого вида ( Bi . пфайффери , бу . truncatus и Bu . forskalii ) сгруппированы отдельно от сохраненных в этаноле МС-спектров того же вида (рис. S4). Соответственно, для каждого условия хранения необходима специальная база данных, чтобы обеспечить правильную идентификацию замороженных и хранившихся в этаноле образцов каждого вида. Средние интенсивности спектров и число пиков МС Bi . пфайффери , бу . truncatus и Bu . forskalii были выше для замороженных образцов, чем для образцов того же вида, хранившихся в этаноле.
globosus были правильно идентифицированы на видовом уровне (77,50%). Их LSV колебались от 1,705 до 2,529 (таблица 3). Анализ основных компонентов (рис. S3) выявил четкое различие между спектрами МС образцов одного и того же вида, хранившихся либо при -20°С, либо в этаноле. Сравнение спектров МС при обоих условиях хранения с использованием дендрограммы также показало, что спектры МС замороженных образцов каждого вида ( Bi . пфайффери , бу . truncatus и Bu . forskalii ) сгруппированы отдельно от сохраненных в этаноле МС-спектров того же вида (рис. S4). Соответственно, для каждого условия хранения необходима специальная база данных, чтобы обеспечить правильную идентификацию замороженных и хранившихся в этаноле образцов каждого вида. Средние интенсивности спектров и число пиков МС Bi . пфайффери , бу . truncatus и Bu . forskalii были выше для замороженных образцов, чем для образцов того же вида, хранившихся в этаноле.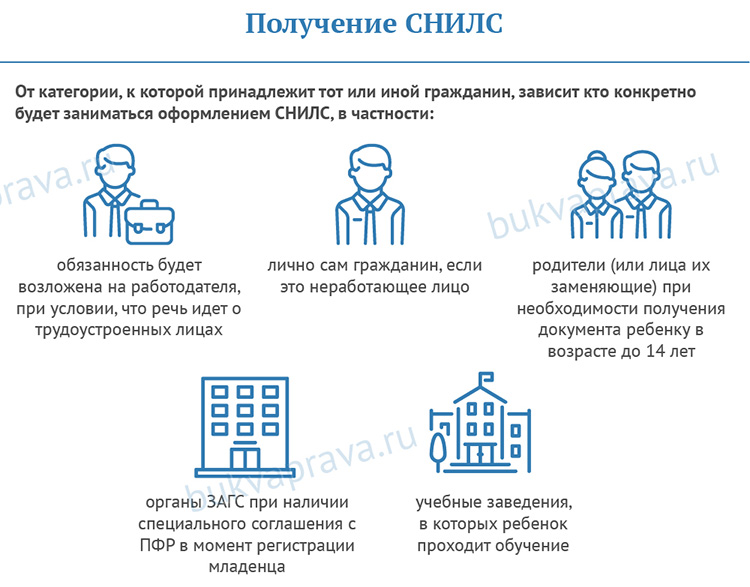 Все полученные значения интенсивностей спектров МС и количество пиков МС представлены в таблице S3. На полученной дендрограмме (рис. S4) мы заметили, что спектры МС замороженных образцов настолько отличались от спектров в спирте того же вида, что располагались на другой ветви, совершенно отличной от замороженных, а в некоторых случаях настолько отличались, что были ближе к другому виду.В частности, в данном случае заморожено Bu . Спектры МС truncatus были ближе к спектрам МС Bu . форскалия . Следовательно, это отражает глубокую разницу между этими двумя условиями хранения.
Все полученные значения интенсивностей спектров МС и количество пиков МС представлены в таблице S3. На полученной дендрограмме (рис. S4) мы заметили, что спектры МС замороженных образцов настолько отличались от спектров в спирте того же вида, что располагались на другой ветви, совершенно отличной от замороженных, а в некоторых случаях настолько отличались, что были ближе к другому виду.В частности, в данном случае заморожено Bu . Спектры МС truncatus были ближе к спектрам МС Bu . форскалия . Следовательно, это отражает глубокую разницу между этими двумя условиями хранения.
Молекулярная идентификация улиток
Двадцать семь образцов были отобраны для создания базы данных. Мы успешно получили 27 последовательностей высокого качества разных видов с использованием COI гена: 9 Bu . усеченный , 6 Би . пфайффери , 4 бу . сенегальский , 3 L . natalensis , 2 Be . одноцветный , 2 М . tuberculata и 1 C . булимоиды . Анализ NCBI BLAST показал, что улитки морфологически идентифицированы как Bi . pfeifferi (оценка ID 100%: AF199099.1), Bu . truncatus (показатель ID 100%: MT272328.1), L . natalensis (оценка ID 99.32%: HG977206.1), M . tuberculata (оценка ID 96,13%: MK879274.1) соответствовали их соответствующим гомологичным последовательностям, доступным в GenBank. Однако последовательности, полученные от улиток, которые были морфологически идентифицированы как Bu . senegalensis были более тесно связаны с последовательностями, депонированными в GenBank как Bu . форскалия последовательности (показатель ID 99,09%: AM286310,4). Следует также отметить, что последовательности, полученные от улиток, морфологически идентифицированных как Be . unicolor соответствует последовательностям, доступным в GenBank как Bellamya capillata (оценка ID 97,04%: JX489247.
одноцветный , 2 М . tuberculata и 1 C . булимоиды . Анализ NCBI BLAST показал, что улитки морфологически идентифицированы как Bi . pfeifferi (оценка ID 100%: AF199099.1), Bu . truncatus (показатель ID 100%: MT272328.1), L . natalensis (оценка ID 99.32%: HG977206.1), M . tuberculata (оценка ID 96,13%: MK879274.1) соответствовали их соответствующим гомологичным последовательностям, доступным в GenBank. Однако последовательности, полученные от улиток, которые были морфологически идентифицированы как Bu . senegalensis были более тесно связаны с последовательностями, депонированными в GenBank как Bu . форскалия последовательности (показатель ID 99,09%: AM286310,4). Следует также отметить, что последовательности, полученные от улиток, морфологически идентифицированных как Be . unicolor соответствует последовательностям, доступным в GenBank как Bellamya capillata (оценка ID 97,04%: JX489247. 1). Получена последовательность C . bulimoides (Morelet, 1860) совпадал с идентичностью 89,63% с эталонной последовательностью GenBank для C . bulimoides происходит из Египта (KF412769.1) (табл. 2).
Для образцов, хранившихся в этаноле, мы получили последовательности COI для 24 образцов, принадлежащих к видам рода Biomphalaria и Bulinus : 17 были использованы для создания базы данных, а остальные образцы (n = 7) были использованы для проверки морфологической идентификации.Все девять Би . pfeifferi были правильно идентифицированы (показатель ID 100%: AF199099.1). Из девяти экземпляров морфологически идентифицированы как Bu . усеченный ; восемь последовательностей соответствуют Bu . последовательности truncatus депонированы в GenBank (оценка ID 100%: MT272328.1), и одна последовательность была идентифицирована как Bu . globosus (показатель ID 100%: AM
8. Филогенетическое дерево, построенное на основе последовательностей фрагментов COI (рис. 6), показало, что последовательности COI семи видов ( Bi . pfeifferi , Bu . усеченный , бу . шаровидный , Bu . форскалий , Бу . сенегальский , L . natalensis и М . tuberculata ), сгруппированные с их гомологичными последовательностями, доступными в GenBank, с высокими значениями начальной загрузки. Bellamya unicolor последовательности сгруппированы с Be . capillata последовательностей, а C . bulimoides сгруппировались отдельно и образовали отдельную ветвь.Чтобы подтвердить молекулярную идентификацию обоих образцов, которые были морфологически идентифицированы как Be . одноцветный и C . bulimoides был секвенирован фрагмент гена 16S . Результаты BLAST показали, что последовательности Be . одноцветный (n = 2) совпал с последовательностями Bellamya jeffreysi (оценка диапазона ID 96,85–97,03%: FJ405702.1) и последовательностью C . bulimoides (n = 1) был обозначен как Cleopatra johnstoni (оценка ID 95.71%: KF412769). Эти результаты (таблица S2) показывают, что идентификация на уровне вида со вторым геном (1 6рРНК ) все еще не ясна. Все последовательности ( COI и 1 6рРНК ) были депонированы в GenBank, и все последовательности FASTA доступны в данных S1.
capillata последовательностей, а C . bulimoides сгруппировались отдельно и образовали отдельную ветвь.Чтобы подтвердить молекулярную идентификацию обоих образцов, которые были морфологически идентифицированы как Be . одноцветный и C . bulimoides был секвенирован фрагмент гена 16S . Результаты BLAST показали, что последовательности Be . одноцветный (n = 2) совпал с последовательностями Bellamya jeffreysi (оценка диапазона ID 96,85–97,03%: FJ405702.1) и последовательностью C . bulimoides (n = 1) был обозначен как Cleopatra johnstoni (оценка ID 95.71%: KF412769). Эти результаты (таблица S2) показывают, что идентификация на уровне вида со вторым геном (1 6рРНК ) все еще не ясна. Все последовательности ( COI и 1 6рРНК ) были депонированы в GenBank, и все последовательности FASTA доступны в данных S1.
Рис. 6. Филогенетическое дерево, показывающее положение девяти видов улиток ( Bi . pfeifferi , Bu . truncatus , Bu . forskalii , , , . сенегальский , Bu . шаровидный , Be . одноцветный , М . tuberculata , L . natalensis и C . bulimoides ), использованных в этом исследовании.
6. Филогенетическое дерево, показывающее положение девяти видов улиток ( Bi . pfeifferi , Bu . truncatus , Bu . forskalii , , , . сенегальский , Bu . шаровидный , Be . одноцветный , М . tuberculata , L . natalensis и C . bulimoides ), использованных в этом исследовании.
Дерево построено методом максимального правдоподобия на основе двухпараметрического расстояния Кимуры (MEGA7). Значения в ветвях — это значения поддержки начальной загрузки, основанные на 1000 репликациях. Ветки имеют цветовую кодировку в соответствии со значениями начальной загрузки.Идентичность каждого таксона имеет цветовую кодировку в соответствии с видом.
https://doi.org/10.1371/journal.pntd.0009725.g006
Обнаружение шистосом у улиток, хранящихся в этаноле
Мы провели количественную ПЦР для обнаружения S . мансони и S . Комплекс видов haematobium . Восемьдесят экземпляров улиток, принадлежащих к Bi . pfeifferi (n = 41), Bu . truncatus (n = 26) и Bu . senegalensis (n = 13). Из протестированных улиток, хранящихся в этаноле, 4/39 (10,25%) Bulinus (1 Bu . senegalensis и 3 Bu . truncatus ) были положительными с помощью количественной ПЦР для S. haematobium и 1/41 (2,43%) Bi . pfeifferi были положительными на S . mansoni (табл. 3). Определение инфекционного статуса основано на сравнении спектров МС инфицированных и неинфицированных образцов, принадлежащих к Bi . пфайффери , бу . truncatus и Bu . senegalensis не проводили из-за небольшого числа инфицированных образцов.
мансони и S . Комплекс видов haematobium . Восемьдесят экземпляров улиток, принадлежащих к Bi . pfeifferi (n = 41), Bu . truncatus (n = 26) и Bu . senegalensis (n = 13). Из протестированных улиток, хранящихся в этаноле, 4/39 (10,25%) Bulinus (1 Bu . senegalensis и 3 Bu . truncatus ) были положительными с помощью количественной ПЦР для S. haematobium и 1/41 (2,43%) Bi . pfeifferi были положительными на S . mansoni (табл. 3). Определение инфекционного статуса основано на сравнении спектров МС инфицированных и неинфицированных образцов, принадлежащих к Bi . пфайффери , бу . truncatus и Bu . senegalensis не проводили из-за небольшого числа инфицированных образцов.
Обсуждение
В этом исследовании представлен быстрый, недорогой и надежный подход к рутинной идентификации образцов пресноводных улиток, включая промежуточных хозяев шистосом, путем оптимизации протокола подготовки образцов MALDI-TOF MS как для замороженных, так и для консервированных в этаноле образцов. Недавно в медицинской энтомологии появился метод MALDI-TOF MS, который доказал свою эффективность в контексте идентификации различных видов членистоногих, таких как блохи [29], клещи [27,53–56], москиты [57,58]. , комаров [28, 59–63], culicoides [43], мух цеце [64], триатоминов [65] и постельных клопов [66] с использованием белков, выделенных из различных частей тела, которые генерируют спектры МС высокого качества.Кроме того, этот протеомный подход также применялся к малакологии как Stephan et al . были первыми, кто сообщил об использовании MALDI-TOF MS для идентификации морских двустворчатых моллюсков, особенно морских гребешков [30].
Недавно в медицинской энтомологии появился метод MALDI-TOF MS, который доказал свою эффективность в контексте идентификации различных видов членистоногих, таких как блохи [29], клещи [27,53–56], москиты [57,58]. , комаров [28, 59–63], culicoides [43], мух цеце [64], триатоминов [65] и постельных клопов [66] с использованием белков, выделенных из различных частей тела, которые генерируют спектры МС высокого качества.Кроме того, этот протеомный подход также применялся к малакологии как Stephan et al . были первыми, кто сообщил об использовании MALDI-TOF MS для идентификации морских двустворчатых моллюсков, особенно морских гребешков [30].
На качество спектров МС влияет несколько параметров, таких как условия хранения, регулировка объема экстракционного раствора, используемого для экстракции белка, метод измельчения и выбранная часть тела [38]. На первом этапе нашего исследования мы протестировали два типа разрушителей: как вольфрамовые, так и стеклянные шарики оказались полезными и эффективными методами измельчения в предыдущих исследованиях MALDI-TOF MS [38,40,66,67]. Тем не менее, стеклянные шарики, как сообщается, были наиболее часто используемым разрушителем, поскольку они использовались для идентификации различных членистоногих [39,40,66], для идентификации микобактерий, для разрушения клеточной стенки микобактерий [68,69] и для идентификации грибов, поскольку они были наиболее эффективны, чем стальные шарики для экстракции белков грибов [70]. Стеклянные шарики также оказались наиболее подходящими для гомогенизации образцов улиток, поскольку они обеспечивали воспроизводимые и интенсивные спектры МС для видов улиток. Что касается подготовки матрицы, мы использовали альфа-циано-4-гидроксикоричную кислоту, которая была успешно использована для идентификации нескольких членистоногих [27,40,42,66].Кроме того, он показал свою эффективность в клинической микробиологии. В частности, идентификация многих микроорганизмов, таких как микобактерии, бактерии, дрожжи и грибы [71–74]. Кроме того, использование этой матрицы было достаточным для получения спектров МС высокого качества различных видов улиток.
Тем не менее, стеклянные шарики, как сообщается, были наиболее часто используемым разрушителем, поскольку они использовались для идентификации различных членистоногих [39,40,66], для идентификации микобактерий, для разрушения клеточной стенки микобактерий [68,69] и для идентификации грибов, поскольку они были наиболее эффективны, чем стальные шарики для экстракции белков грибов [70]. Стеклянные шарики также оказались наиболее подходящими для гомогенизации образцов улиток, поскольку они обеспечивали воспроизводимые и интенсивные спектры МС для видов улиток. Что касается подготовки матрицы, мы использовали альфа-циано-4-гидроксикоричную кислоту, которая была успешно использована для идентификации нескольких членистоногих [27,40,42,66].Кроме того, он показал свою эффективность в клинической микробиологии. В частности, идентификация многих микроорганизмов, таких как микобактерии, бактерии, дрожжи и грибы [71–74]. Кроме того, использование этой матрицы было достаточным для получения спектров МС высокого качества различных видов улиток. Таким образом, мы утвердили использование альфа-циано-4-гидроксикоричной кислоты для приготовления матрицы. В противном случае мы бы протестировали различные кислоты в качестве синапиновой кислоты, если бы нам не удалось получить хорошие сигналы с лучшим разрешением.Использование такой подготовки матрицы и стеклянных шариков ранее показало их эффективность и надежность в различных условиях [39, 40, 68–71]. Следовательно, в настоящей работе комбинация стеклянных шариков и матрицы на основе альфа-циано-4-гидроксикоричной кислоты показала многообещающие результаты для идентификации пресноводных улиток. Кроме того, мы стандартизировали протокол для замороженных образцов. Две части тела, голова (H) и ступня (F), а также комбинация ступни и головы (FH) были представлены для анализа MALDI-TOF MS, чтобы получить конкретную спектральную характеристику для каждого вида.Полученные данные показали, что спектры MALDI-TOF MS, полученные из белковых экстрактов стопы (F), головы (H) и головы стопы (FH) улитки, адекватны для точной идентификации пресноводных улиток, участвующих в передаче шистосомоза.
Таким образом, мы утвердили использование альфа-циано-4-гидроксикоричной кислоты для приготовления матрицы. В противном случае мы бы протестировали различные кислоты в качестве синапиновой кислоты, если бы нам не удалось получить хорошие сигналы с лучшим разрешением.Использование такой подготовки матрицы и стеклянных шариков ранее показало их эффективность и надежность в различных условиях [39, 40, 68–71]. Следовательно, в настоящей работе комбинация стеклянных шариков и матрицы на основе альфа-циано-4-гидроксикоричной кислоты показала многообещающие результаты для идентификации пресноводных улиток. Кроме того, мы стандартизировали протокол для замороженных образцов. Две части тела, голова (H) и ступня (F), а также комбинация ступни и головы (FH) были представлены для анализа MALDI-TOF MS, чтобы получить конкретную спектральную характеристику для каждого вида.Полученные данные показали, что спектры MALDI-TOF MS, полученные из белковых экстрактов стопы (F), головы (H) и головы стопы (FH) улитки, адекватны для точной идентификации пресноводных улиток, участвующих в передаче шистосомоза. Валидация протокола была подтверждена с использованием только стопы. Мы выбрали стопу для пробоподготовки именно по двум причинам: во-первых, первичные спороцисты Schistosoma обычно встречаются в стопе, а во-вторых, сообщалось, что эта часть тела улитки является хорошим источником белка по сравнению с другими тканями улитки [36]. ,75].Интенсивность и количество пиков, генерируемых Bi . пфайфери фута (таблица S1), использованные для оптимизации протокола, были немного ниже, чем те, которые использовались для проверки протокола (таблица S3). Это можно объяснить тем, что образцы, с которыми манипулировали впервые, приходилось многократно замораживать и размораживать, чтобы подтвердить морфологическую идентификацию и MALDI-TOF MS эссе. Частое оттаивание может быть причиной деградации белка. Такие же наблюдения были сделаны Ouarti и др. .(2020) [76]. Объем экстракционного раствора является важным параметром для получения спектров МС хорошего качества, и, как ранее сообщалось об членистоногих [39,77], объем экстракционного раствора отличается от одного членистоногого к другому и от одной части одного и того же членистоногого к другому.
Валидация протокола была подтверждена с использованием только стопы. Мы выбрали стопу для пробоподготовки именно по двум причинам: во-первых, первичные спороцисты Schistosoma обычно встречаются в стопе, а во-вторых, сообщалось, что эта часть тела улитки является хорошим источником белка по сравнению с другими тканями улитки [36]. ,75].Интенсивность и количество пиков, генерируемых Bi . пфайфери фута (таблица S1), использованные для оптимизации протокола, были немного ниже, чем те, которые использовались для проверки протокола (таблица S3). Это можно объяснить тем, что образцы, с которыми манипулировали впервые, приходилось многократно замораживать и размораживать, чтобы подтвердить морфологическую идентификацию и MALDI-TOF MS эссе. Частое оттаивание может быть причиной деградации белка. Такие же наблюдения были сделаны Ouarti и др. .(2020) [76]. Объем экстракционного раствора является важным параметром для получения спектров МС хорошего качества, и, как ранее сообщалось об членистоногих [39,77], объем экстракционного раствора отличается от одного членистоногого к другому и от одной части одного и того же членистоногого к другому. По этой причине мы варьировали объем экстракционного раствора, чтобы выбрать объем, позволяющий получить хорошее качество и воспроизводимость спектров МС. В нашей работе оптимизация объема экстракционного раствора не основывалась на весе ткани ноги и головы улитки.Однако для большей точности в будущих проектах по обнаружению шистосом в промежуточных хозяевах с помощью MALDI-TOF MS будет важно уточнить протокол, принимая во внимание вес ткани стопы улитки. В целом, в нашем исследовании мы показали, что MALDI-TOF MS анализ ткани стопы улитки позволяет провести правильную идентификацию до видового уровня, не требуя малакологических навыков.
По этой причине мы варьировали объем экстракционного раствора, чтобы выбрать объем, позволяющий получить хорошее качество и воспроизводимость спектров МС. В нашей работе оптимизация объема экстракционного раствора не основывалась на весе ткани ноги и головы улитки.Однако для большей точности в будущих проектах по обнаружению шистосом в промежуточных хозяевах с помощью MALDI-TOF MS будет важно уточнить протокол, принимая во внимание вес ткани стопы улитки. В целом, в нашем исследовании мы показали, что MALDI-TOF MS анализ ткани стопы улитки позволяет провести правильную идентификацию до видового уровня, не требуя малакологических навыков.
(рис. 4B) выявил различия между видами улиток, а визуальное сравнение профилей МС (рис. 4A) выявило отличительные пики между видами.Для создания базы данных мы использовали лабораторные образцы первого поколения, чтобы гарантировать, что спектры МС, включенные в нашу базу данных, принадлежат неинфицированным образцам улиток [78,79]. Кроме того, валидность базы данных оценивалась с помощью слепого теста, в ходе которого были правильно идентифицированы 100 % экземпляров шести видов (табл. 2). Однако C не хватило. bulimoides экземпляра доступны для слепого теста. Идентификация этого вида была подтверждена только морфологически как C . bulimoides , поскольку в GenBank не существовало эталонной последовательности для C . bulimoides (Morelet, 1860) происходит из Сенегала. Судя по морфологии раковины, C . Сообщается, что bulimoides является политипным и очень разнообразным видом, включая несколько синонимов [33].
Кроме того, валидность базы данных оценивалась с помощью слепого теста, в ходе которого были правильно идентифицированы 100 % экземпляров шести видов (табл. 2). Однако C не хватило. bulimoides экземпляра доступны для слепого теста. Идентификация этого вида была подтверждена только морфологически как C . bulimoides , поскольку в GenBank не существовало эталонной последовательности для C . bulimoides (Morelet, 1860) происходит из Сенегала. Судя по морфологии раковины, C . Сообщается, что bulimoides является политипным и очень разнообразным видом, включая несколько синонимов [33].
В нашем исследовании пороговое значение LSV, равное 1,7, было предложено для точной идентификации нескольких пресноводных улиток на уровне видов. Сопоставимое пороговое значение использовалось в исследовании по идентификации церкарий с помощью MALDI-TOF MS [25].Во многих других энтомологических исследованиях использовался близко сопоставимый порог (1. 8), который, как было показано, связан с правильной идентификацией комаров, блох и клещей [28, 29, 41].
8), который, как было показано, связан с правильной идентификацией комаров, блох и клещей [28, 29, 41].
Мы получили некоторые расхождения между молекулярной идентификацией и морфологической идентификацией, проведенной в Сенегале. Фактически четыре последовательности образцов морфологически идентифицированы как Bu . senegalensis были более тесно связаны с последовательностями, депонированными в GenBank как Bu . форскалии последовательности (оценка ID 99,09%). Это можно объяснить ограниченной морфологической самобытностью внутри группы forskalii ( Bu . senegalensis и Bu . forskalii ) [80]. На основании конхологического анализа было сообщено, что разделить виды ( Bu . senegalensis и Bu . forskalii ) только по характеристикам раковины может быть непросто, несмотря на их близкое сходство [80].Действительно, Бу . senegalensis можно отличить от Bu . forskalii отсутствием какого-либо окаймления, образующего плечо на верхних оборотах [32], тогда как Мандал-Барт указал, что этот характерный угол плеча не всегда обнаруживался у Bu forskalii ; он либо отсутствовал, либо был слабым, что затрудняло его наблюдение [81].
forskalii отсутствием какого-либо окаймления, образующего плечо на верхних оборотах [32], тогда как Мандал-Барт указал, что этот характерный угол плеча не всегда обнаруживался у Bu forskalii ; он либо отсутствовал, либо был слабым, что затрудняло его наблюдение [81].
Чтобы обновить базу данных с помощью МС-спектров однозначно идентифицированных образцов, мы использовали ген субъединицы I митохондриальной цитохромоксидазы, основываясь на предыдущих молекулярных исследованиях, в которых сообщалось, что ген COI представляет значительные расходящиеся последовательности, что делает его надежным для распознавания Bulinus . виды [82,83].Предыдущее исследование показало, что эти морфологически сходные виды дифференцируются молекулярными методами, что указывает на преимущество нацеливания на частичный ген COI для точной идентификации видов в пределах одной группы [18]. Последовательности COI также доступны для обоих видов ( Bu . forskalii и Bu . senegalensis ) в базе данных GenBank. На основании фрагмента гена COI мы подтвердили, что вид морфологически идентифицирован как Bu . senegalensis на самом деле были Bu . форскалия .
forskalii и Bu . senegalensis ) в базе данных GenBank. На основании фрагмента гена COI мы подтвердили, что вид морфологически идентифицирован как Bu . senegalensis на самом деле были Bu . форскалия .
Дополнительно для морфологически идентифицированных образцов Be . unicolor мы обнаружили несоответствие с молекулярной идентификацией. Два Be . одноцветных последовательностей соответствуют Be . Последовательность capillata депонирована в GenBank (показатель ID 97,04%). Ранее сообщалось, что разделить Be сложно. капиллата из Be . unicolor морфологически [33]. Неверная идентификация может быть связана с перекрывающимися характеристиками раковины, которые могут быть довольно изменчивыми у видов Bellamya [84]. Основываясь на морфологии, мы подтвердили, что наши экземпляра Bellamya представляют собой Be . одноцветный на основе официально идентифицированных характеристик оболочки. Насколько нам известно, Be . capillata до сих пор не обнаружен в Сенегале, но присутствует в странах Восточной (Танзания) и Центральной Африки [85, 86].Чтобы решить проблему несоответствия между морфологической и молекулярной идентификацией, мы использовали ген рРНК 16S в качестве второго эталона для подтверждения вида. Результаты BLAST показали, что последовательность образца, морфологически обозначенного как C . bulimoides соответствовали C. johnstoni с идентичностью 95,71%. Это можно объяснить тем, что C . bulimoides — очень разнообразный вид [33], а C . bulimoides (происходит из Сенегала), использованный в нашем исследовании, не был доступен в GenBank. Конспецифичность этого весьма разнообразного вида нуждается в генетическом анализе в дальнейших исследованиях [33]. Напротив, последовательности образцов морфологически идентифицированы как Be .
одноцветный на основе официально идентифицированных характеристик оболочки. Насколько нам известно, Be . capillata до сих пор не обнаружен в Сенегале, но присутствует в странах Восточной (Танзания) и Центральной Африки [85, 86].Чтобы решить проблему несоответствия между морфологической и молекулярной идентификацией, мы использовали ген рРНК 16S в качестве второго эталона для подтверждения вида. Результаты BLAST показали, что последовательность образца, морфологически обозначенного как C . bulimoides соответствовали C. johnstoni с идентичностью 95,71%. Это можно объяснить тем, что C . bulimoides — очень разнообразный вид [33], а C . bulimoides (происходит из Сенегала), использованный в нашем исследовании, не был доступен в GenBank. Конспецифичность этого весьма разнообразного вида нуждается в генетическом анализе в дальнейших исследованиях [33]. Напротив, последовательности образцов морфологически идентифицированы как Be . одноцветный сочетается с Be . jeffreysi (оценка диапазона ID 96,85–97,03%: FJ405702.1). Как сообщалось ранее, таксономия видов живородящих была нарушена из-за отсутствия данных об их эволюционной таксономии, что приводит к пробелам в идентификации на уровне видов [86,87].Более того, предварительное исследование генетического разнообразия и филогении видов Bellamya , собранных в разных озерах Африки, показало, что генетическое разнообразие как 16S , так и COI было очень низким в пределах кладовой вариации. В этом исследовании также сообщалось, что характеристика видов Bellamya , обитающих в африканских озерах, с использованием штрих-кодирования ДНК может быть недостаточной, поскольку молекулярная дивергенция меньше, чем морфологическая [86].Следовательно, мы поддерживаем вывод, сделанный Sengupta et al . и Mandahl-Barth [32] на основе морфологии и подтвердили идентификацию вида Bellamya unicolor с использованием конхологических критериев.
одноцветный сочетается с Be . jeffreysi (оценка диапазона ID 96,85–97,03%: FJ405702.1). Как сообщалось ранее, таксономия видов живородящих была нарушена из-за отсутствия данных об их эволюционной таксономии, что приводит к пробелам в идентификации на уровне видов [86,87].Более того, предварительное исследование генетического разнообразия и филогении видов Bellamya , собранных в разных озерах Африки, показало, что генетическое разнообразие как 16S , так и COI было очень низким в пределах кладовой вариации. В этом исследовании также сообщалось, что характеристика видов Bellamya , обитающих в африканских озерах, с использованием штрих-кодирования ДНК может быть недостаточной, поскольку молекулярная дивергенция меньше, чем морфологическая [86].Следовательно, мы поддерживаем вывод, сделанный Sengupta et al . и Mandahl-Barth [32] на основе морфологии и подтвердили идентификацию вида Bellamya unicolor с использованием конхологических критериев. Здесь мы также подняли вопрос о надежности молекулярных инструментов для идентификации видов Bellamya . В этом первом разделе исследования мы показали, что MALDI-TOF MS является надежным инструментом для идентификации различных видов замороженных улиток.Его можно использовать для обхода молекулярных ограничений, таких как длительное время, необходимое для пробоподготовки, дорогостоящие реагенты и даже отсутствие справочных данных.
Здесь мы также подняли вопрос о надежности молекулярных инструментов для идентификации видов Bellamya . В этом первом разделе исследования мы показали, что MALDI-TOF MS является надежным инструментом для идентификации различных видов замороженных улиток.Его можно использовать для обхода молекулярных ограничений, таких как длительное время, необходимое для пробоподготовки, дорогостоящие реагенты и даже отсутствие справочных данных.
На втором этапе исследования мы оценили эффективность MALDI-TOF MS при идентификации трех видов улиток: Bi . пфайффери , бу . senegalensis и Bu . truncatus собирают в полевых условиях и хранят в этаноле. Использование этанола имеет решающее значение, поскольку большинство аналитических лабораторий находятся далеко от мест сбора, и известно, что это идеальный метод хранения, особенно в странах с низким или средним уровнем дохода.Кроме того, это дешевле, чем замороженные методы, и сохраняет образцы гибкими, что позволяет проводить морфологическое исследование позже. Однако предыдущие исследования показали, что использование замороженных и свежих образцов членистоногих обеспечивает воспроизводимые и лучшие спектры МС по сравнению с образцами, хранящимися в спирте [41,88], вероятно, из-за того, что этанол вызывает изменения в структуре белка [89]. Тем не менее, недавно было показано, что эти ограничения можно обойти у клещей, применяя протокол деалкоголизации, который теперь является нашим эталонным лабораторным протоколом [40].В этом исследовании мы использовали ту же часть тела (ступню), которая использовалась для идентификации замороженных образцов, и следовали этапам деалкоголизации, предложенным Diarra et al . [40] в качестве средства перфузии любого остаточного алкоголя из ткани стопы, который может помешать последующей подготовке проб MALDI-TOF MS. Важно отметить, что профили МС были лучшего качества, когда мы использовали стеклянные шарики в качестве разрушителя агента, в то время как вольфрамовые шарики приводили к МС-спектрам низкого качества.
Однако предыдущие исследования показали, что использование замороженных и свежих образцов членистоногих обеспечивает воспроизводимые и лучшие спектры МС по сравнению с образцами, хранящимися в спирте [41,88], вероятно, из-за того, что этанол вызывает изменения в структуре белка [89]. Тем не менее, недавно было показано, что эти ограничения можно обойти у клещей, применяя протокол деалкоголизации, который теперь является нашим эталонным лабораторным протоколом [40].В этом исследовании мы использовали ту же часть тела (ступню), которая использовалась для идентификации замороженных образцов, и следовали этапам деалкоголизации, предложенным Diarra et al . [40] в качестве средства перфузии любого остаточного алкоголя из ткани стопы, который может помешать последующей подготовке проб MALDI-TOF MS. Важно отметить, что профили МС были лучшего качества, когда мы использовали стеклянные шарики в качестве разрушителя агента, в то время как вольфрамовые шарики приводили к МС-спектрам низкого качества. По этой причине мы подтвердили, что стеклянные шарики являются наиболее подходящим средством для разрушения образцов, хранящихся в этаноле (рис. 5А).Результаты слепых испытаний спиртовых консервантов (табл. 3) показали, что 22/22 из Bi . pfeifferi , 4/6 Bu . форскалии , 2/2 Бу . globosus и только 3/10 Bu . truncatus были правильно идентифицированы с надежными LSV (LSV ≥ 1,7). Это может быть связано с ограниченным количеством образцов, протестированных в слепом тесте и использованных для создания базы данных. Мы согласны с предыдущими исследованиями, в которых сообщается о влиянии 70% этанола на воспроизводимость спектров MALDI-TOF MS [90, 91] и различиях, существующих между спектрами MS замороженных и хранящихся в этаноле образцов для каждого вида [88].В этой части исследования мы пришли к выводу, что MALDI-TOF MS может использоваться для идентификации улиток, хранящихся в этаноле, но для этого требуется создание специальной базы данных с большим количеством образцов, хранящихся в этаноле, чтобы обойти предвзятость гетерогенности.
По этой причине мы подтвердили, что стеклянные шарики являются наиболее подходящим средством для разрушения образцов, хранящихся в этаноле (рис. 5А).Результаты слепых испытаний спиртовых консервантов (табл. 3) показали, что 22/22 из Bi . pfeifferi , 4/6 Bu . форскалии , 2/2 Бу . globosus и только 3/10 Bu . truncatus были правильно идентифицированы с надежными LSV (LSV ≥ 1,7). Это может быть связано с ограниченным количеством образцов, протестированных в слепом тесте и использованных для создания базы данных. Мы согласны с предыдущими исследованиями, в которых сообщается о влиянии 70% этанола на воспроизводимость спектров MALDI-TOF MS [90, 91] и различиях, существующих между спектрами MS замороженных и хранящихся в этаноле образцов для каждого вида [88].В этой части исследования мы пришли к выводу, что MALDI-TOF MS может использоваться для идентификации улиток, хранящихся в этаноле, но для этого требуется создание специальной базы данных с большим количеством образцов, хранящихся в этаноле, чтобы обойти предвзятость гетерогенности. . С другой стороны, мы заметили различия на уровне профилей МС как у замороженных, так и у хранившихся в этаноле образцов одного и того же вида. В частности, средние интенсивности спектров и количество пиков МС замороженных образцов Bi . пфайффери , бу . truncatus и Bu . forskalii были выше, чем у образцов того же вида, хранившихся в этаноле (таблица S3). Это различие может быть связано с влиянием этанола на качество спектров МС, как сообщалось ранее для хранящихся в этаноле вшей, клещей, блох и церкарий [25,40,53,67,77,88].
. С другой стороны, мы заметили различия на уровне профилей МС как у замороженных, так и у хранившихся в этаноле образцов одного и того же вида. В частности, средние интенсивности спектров и количество пиков МС замороженных образцов Bi . пфайффери , бу . truncatus и Bu . forskalii были выше, чем у образцов того же вида, хранившихся в этаноле (таблица S3). Это различие может быть связано с влиянием этанола на качество спектров МС, как сообщалось ранее для хранящихся в этаноле вшей, клещей, блох и церкарий [25,40,53,67,77,88].
Чтобы оценить, была ли гетерогенность профилей МС каждого вида вызвана инфекцией шистосом, был проведен скрининг патогенов.К сожалению, мы не смогли сравнить спектры MALDI-TOF MS улиток, инфицированных Schistosoma , с неинфицированными, поскольку количество инфицированных образцов было недостаточным для создания конкретной базы данных для инфицированных Schistosoma улиток, а также для проведения слепого теста в для подтверждения результатов. Кроме того, мы не смогли провести надежный анализ с использованием анализа основных компонентов (PCA), чтобы различить инфицированные и неинфицированные образцы из-за небольшого количества спектров MS хорошего качества от инфицированных образцов; Би . pfeifferi (n = 1), Bu . truncatus (n = 2) и Bu . senegalensis (n = 1). Ввиду того, что было инфицировано так мало образцов, маловероятно, что инфекция была источником общей неоднородности. Поэтому мы предполагаем, что органический консервирующий раствор (этанол) может быть ответственным за модификацию профиля МС образцов, как ранее обсуждалось в других исследованиях [67,88]. Эхиностомы и шистосомы — два рода трематод, которые используют пресноводных улиток [92] в качестве промежуточных хозяев.Как установлено в недавнем исследовании, иглобрюхи могут инфицировать некоторых промежуточных хозяев шистосом, а именно Bulinus и Biomphalaria , в качестве своего первого промежуточного хозяина [93].
Кроме того, мы не смогли провести надежный анализ с использованием анализа основных компонентов (PCA), чтобы различить инфицированные и неинфицированные образцы из-за небольшого количества спектров MS хорошего качества от инфицированных образцов; Би . pfeifferi (n = 1), Bu . truncatus (n = 2) и Bu . senegalensis (n = 1). Ввиду того, что было инфицировано так мало образцов, маловероятно, что инфекция была источником общей неоднородности. Поэтому мы предполагаем, что органический консервирующий раствор (этанол) может быть ответственным за модификацию профиля МС образцов, как ранее обсуждалось в других исследованиях [67,88]. Эхиностомы и шистосомы — два рода трематод, которые используют пресноводных улиток [92] в качестве промежуточных хозяев.Как установлено в недавнем исследовании, иглобрюхи могут инфицировать некоторых промежуточных хозяев шистосом, а именно Bulinus и Biomphalaria , в качестве своего первого промежуточного хозяина [93]. Однако было показано, что эхиностомы являются активными конкурентами шистосом, ограничивая способность последних селиться в улитке [94,95]. Специально сообщалось, что E . caproni ограничивает инфекцию Bi . глабрата по S . мансони [96].В нашем исследовании образцы улиток, принадлежащие к Biomphalaria и Bulinus , были проверены на наличие инфекции Schistosoma , но эти другие паразиты, такие как Echinostoma или Paramphistomidae [93, 97], могли заразить те же виды и потенциально повлиять на спектры МС. В будущих исследованиях, направленных на разработку MALDI-TOF MS для обнаружения шистосом у улиток, было бы интересно лучше охарактеризовать образцы и обеспечить тщательное исследование паразитов, обычно связанных с тестируемыми улитками.Однако это текущее исследование сосредоточено на применении метода MALDI-TOF MS для выявления популяций улиток, включая виды, которые играют незаменимую роль в передаче шистосомоза.
Однако было показано, что эхиностомы являются активными конкурентами шистосом, ограничивая способность последних селиться в улитке [94,95]. Специально сообщалось, что E . caproni ограничивает инфекцию Bi . глабрата по S . мансони [96].В нашем исследовании образцы улиток, принадлежащие к Biomphalaria и Bulinus , были проверены на наличие инфекции Schistosoma , но эти другие паразиты, такие как Echinostoma или Paramphistomidae [93, 97], могли заразить те же виды и потенциально повлиять на спектры МС. В будущих исследованиях, направленных на разработку MALDI-TOF MS для обнаружения шистосом у улиток, было бы интересно лучше охарактеризовать образцы и обеспечить тщательное исследование паразитов, обычно связанных с тестируемыми улитками.Однако это текущее исследование сосредоточено на применении метода MALDI-TOF MS для выявления популяций улиток, включая виды, которые играют незаменимую роль в передаче шистосомоза. При условии, что протокол MALDI-TOF MS стандартизирован, необходимо оценить способность MALDI-TOF MS выявлять инфекцию среди промежуточных хозяев либо путем искусственного заражения пресноводных улиток ( Biomphalaria или Bulinus ), либо путем сбора улиток в Schistosoma — эндемичных районах в попытке помочь картировать риск передачи болезни или разработать долгосрочные стратегии контроля.
При условии, что протокол MALDI-TOF MS стандартизирован, необходимо оценить способность MALDI-TOF MS выявлять инфекцию среди промежуточных хозяев либо путем искусственного заражения пресноводных улиток ( Biomphalaria или Bulinus ), либо путем сбора улиток в Schistosoma — эндемичных районах в попытке помочь картировать риск передачи болезни или разработать долгосрочные стратегии контроля.
В целом, этот высокопроизводительный метод позволил идентифицировать как замороженные, так и консервированные в этаноле образцы улиток с минимальными требованиями к образцам и быстрой доступностью результатов по сравнению с текущей идентификацией на основе ДНК.
Заключение
Наше исследование впервые показывает, что можно использовать экстракты белка стопы для идентификации видов улиток, а также близкородственных видов с помощью MALDI-TOF MS. Наши данные показывают, что MALDI-TOF MS является надежным и подходящим альтернативным инструментом для идентификации нескольких видов улиток, хранящихся при температуре -20°C или хранящихся в этаноле, хотя последний метод имеет некоторые ограничения. Этот высокопроизводительный подход является быстрым, недорогим и может использоваться для близкородственных видов, принадлежащих к роду Bulinus , таких как Bu . senegalensis и Bu . forskalii , которые морфологически практически не дифференцируются. Его преимущества делают его удобным подходом для эпидемиологических исследований в районах, эндемичных по Schistosoma . Кроме того, быстрая идентификация популяций улиток может дать ценное преимущество в борьбе с шистосомозом.Поскольку в нашей исследовательской лаборатории имеется прибор MALDI-TOF MS для микробиологических и энтомологических целей, он также будет использоваться для будущих малакологических исследований. Следовательно, мы продолжим обновлять нашу базу данных РС в сотрудничестве с нашей исследовательской группой и лабораторией паразитологии в Дакаре, Сенегал. Недавнее исследование выявило потенциал MALDI-TOF MS для быстрой идентификации церкарий [25], поэтому в ближайшем будущем было бы интересно оценить, сможет ли этот инновационный инструмент успешно дифференцировать инфицированных Schistosoma образцов от неинфицированных.
Этот высокопроизводительный подход является быстрым, недорогим и может использоваться для близкородственных видов, принадлежащих к роду Bulinus , таких как Bu . senegalensis и Bu . forskalii , которые морфологически практически не дифференцируются. Его преимущества делают его удобным подходом для эпидемиологических исследований в районах, эндемичных по Schistosoma . Кроме того, быстрая идентификация популяций улиток может дать ценное преимущество в борьбе с шистосомозом.Поскольку в нашей исследовательской лаборатории имеется прибор MALDI-TOF MS для микробиологических и энтомологических целей, он также будет использоваться для будущих малакологических исследований. Следовательно, мы продолжим обновлять нашу базу данных РС в сотрудничестве с нашей исследовательской группой и лабораторией паразитологии в Дакаре, Сенегал. Недавнее исследование выявило потенциал MALDI-TOF MS для быстрой идентификации церкарий [25], поэтому в ближайшем будущем было бы интересно оценить, сможет ли этот инновационный инструмент успешно дифференцировать инфицированных Schistosoma образцов от неинфицированных. образцов, чтобы использовать этот подход для эпиднадзора за эндемичностью.
образцов, чтобы использовать этот подход для эпиднадзора за эндемичностью.
Сокращения
Общепринятое сокращение для Bellamya , Bulinus и Biomphalaria — « B ». Для большей ясности мы решили сократить Bulinus , Bellamya и Biomphalaria : Bu ., Be ., Bi . соответственно, чтобы их было легче различить в этой рукописи.
Вспомогательная информация
S1 Рис. Размерное изображение из PCA, показывающее сравнение спектров MALDI-TOF MS по пяти различным протоколам (h2, h3, h4, FH, F) с использованием замороженного
Bi . пфайфери .На рисунке показан вклад десяти основных компонентов в классификацию профилирования на графике процентной объясненной дисперсии PC. Красные точки: протокол h2, зеленые точки: протокол h3, синие точки: протокол h4, желтые точки: FH и фиолетовые точки: F.
https://doi.org/10.1371/journal.pntd. 0009725.s001
0009725.s001
(TIF)
S2 Рис. Размерное изображение из PCA, показывающее сравнение спектров MALDI-TOF MS от основания
Bi , хранящегося в этаноле. pfeifferi образца, принадлежащие трем разным протоколам.На рисунке показан вклад восьми основных компонентов в классификацию профилирования на графике процентной объясненной дисперсии PC. Красные точки: протокол F1, зеленые точки: протокол F2, синие точки: протокол F3.
https://doi.org/10.1371/journal.pntd.0009725.s002
(TIF)
S3 Рис. Отличие спектров MALDI-TOF MS от замороженного и хранящегося в этаноле
Bi . пфайффери , бу . форскалий , Бу . truncatus с помощью анализа основных компонентов с использованием ClinProTools 2.2.(А) Би . pfeifferi , (B) Bu . форскалии , (С) Bu . усеченный .
https://doi.org/10.1371/journal.pntd.0009725. s003
s003
(TIF)
S4 Рис. Сравнение спектров MALDI-TOF MS замороженных и хранившихся в этаноле четырех образцов трех видов:
Bi . пфайффери , бу . truncatus и Bu . форскалия с использованием дендрограммы (программное обеспечение Biotyper v.3.0).Замороженные образцы выделены жирным шрифтом, а образцы, хранившиеся в этаноле, жирным шрифтом не выделены.
https://doi.org/10.1371/journal.pntd.0009725.s004
(TIF)
Данные S1.
16S последовательности Be . одноцветный и C . булимоиды . COI последовательности девяти видов, включая Bi . пфайффери , бу . усеченный , бу . форскалий , Бу . сенегальский , Bu . шаровидный , Be . одноцветный , М . tuberculata , L . natalensis и C . булимоиды .
natalensis и C . булимоиды .
https://doi.org/10.1371/journal.pntd.0009725.s005
(TXT)
Благодарности
Мы благодарим Лайонела Альмераса, Жана-Мишеля Беранже, Юнеса Лайдуди и Асен Медкур за их советы.
Каталожные номера
- 1. Colley DG, Bustinduy AL, Secor WE, King CH. Шистосомоз человека. Ланцет. Издательская группа «Ланцет»; 2014. стр. 2253–2264. https://doi.org/10.1016/S0140-6736(13)61949-2 pmid:24698483
- 2. Организация ВХ. Поддержание стремления преодолеть глобальное воздействие забытых тропических болезней. Всемирный орган исцеления. 2013;3.9: 153.
- 3. Хотес П.Дж., Альварадо М., Басаньес М.Г., Боллигер И., Борн Р., Буссинеск М. и др.Исследование глобального бремени болезней, 2010 г.: интерпретация и последствия для забытых тропических болезней. PLoS Negl Trop Dis. 2014;8. пмид:25058013
- 4.
Steinmann P, Keizer J, Bos R, Tanner M, Utzinger J.
 Шистосомоз и освоение водных ресурсов: систематический обзор, метаанализ и оценки людей, подверженных риску. Ланцет Инфекционные заболевания. 2006. стр. 411–425. пмид:167
Шистосомоз и освоение водных ресурсов: систематический обзор, метаанализ и оценки людей, подверженных риску. Ланцет Инфекционные заболевания. 2006. стр. 411–425. пмид:167 - 5. Читсуло Л., Ловерде П., Энгельс Д. Шистосомоз. Природа Обзоры микробиологии.2004. С. 12–13. пмид:15035004
- 6. Мари Л., Гатто М., Сиддио М., Д.И.А., Соколов С.Х., Де Лео Г.А. и соавт. Моделирование на основе больших данных раскрывает факторы, вызывающие эндемический шистосомоз по всей стране. Научный доклад 2017;7: 489. pmid:28352101
- 7. Van Der Werf MJ, De Vlas SJ, Brooker S, Looman CWN, Nagelkerke NJD, Habbema JDF и др. Количественная оценка клинической заболеваемости, связанной с шистосомной инфекцией в странах Африки к югу от Сахары. Акта Тропика. Эльзевир; 2003. стр. 125–139.пмид:12745133
- 8.
Colley DG, Fleming FM, Matendechero SH, Knopp S, Rollinson D, Utzinger J, et al. Вклад консорциума по шистосомозу по оперативным исследованиям и оценке (SCORE) в борьбу с шистосомозом и его ликвидацию: основные выводы и сообщения для будущих целей, пороговые значения и оперативные исследования.
 Am J Trop Med Hyg. 2020; 103: 125–134. пмид:32400345
Am J Trop Med Hyg. 2020; 103: 125–134. пмид:32400345 - 9. CDC—Шистосомоз—Биология. https://www.cdc.gov/parasites/шистосомоз/биология.HTML
- 10. Абэ Э.М., Гуань В., Го Ю.-Х., Кассен К., Цинь З.-К., Сюй Дж. и др. Дифференциация промежуточных хозяев улиток Schistosoma spp. использование молекулярных подходов: основа успешного интегрированного механизма контроля в Африке.
- 11. Пике М., Эрноулд Дж. К., Веркруйсс Дж., Саутгейт В. Р., Мбайе А., Самбоу Б. и др. Встреча Королевского общества тропической медицины и гигиены в Мэнсон-Хаусе, Лондон, 18 мая 1995 г. Эпидемиология шистосомоза человека в бассейне реки Сенегал.Труды Королевского общества тропической медицины и гигиены. Издательство Оксфордского университета; 1996. С. 340–346.
- 12.
Сен М., Саутгейт В.Р., Веркруйсс Дж. [Bulinus truncatus, промежуточный хозяин Schistosoma haematobium в бассейне реки Сенегал (SRB)]. Бык Сок Патол Экзот. 2004; 97: 29–32. Доступно: http://www.
 ncbi.nlm.nih.gov/pubmed/15104154 pmid:15104154
ncbi.nlm.nih.gov/pubmed/15104154 pmid:15104154 - 13. Ндионе Р.А., Диоп Д., Риво Г., Ба К.Т., Жуанар Н. Роль параметров окружающей среды в плотности улиток-промежуточных хозяев шистосомы человека в течение года в коммуне Ричард-Толл, Сенегал.Мед Санте Троп. 2018; 28: 158–164.
- 14. Леже Э., Вебстер Дж. П. Гибридизации внутри рода Schistosoma: значение для эволюции, эпидемиологии и контроля. Паразитология. Издательство Кембриджского университета; 2017. С. 65–80. https://doi.org/10.1017/S0031182016001190 pmid:27572906
- 15. Райт КА. Таксономические проблемы моллюсков рода Bulinus. 1961 год; 225–231.
- 16. Раахауге П., Кристенсен Т.К. Сравнение видов группы Bulinus africanus (Planorbidae; Gastropoda) с использованием внутренней транскрибируемой области спейсера 1, объединенной по морфологическим и анатомическим признакам.Acta Trop. 2000;75: 85–94. пмид:10708010
- 17.
Стохард Дж. Р., Хьюз С.
 , Роллинсон Д. Вариация во внутреннем транскрибируемом спейсере (ITS) генов рибосомной ДНК промежуточных хозяев улиток в пределах рода Bulinus (Gastropoda: Planorbidae). Acta Trop. 1996; 61: 19–29. пмид:61
, Роллинсон Д. Вариация во внутреннем транскрибируемом спейсере (ITS) генов рибосомной ДНК промежуточных хозяев улиток в пределах рода Bulinus (Gastropoda: Planorbidae). Acta Trop. 1996; 61: 19–29. пмид:61 - 18. Кейн Р.А., Стотард Дж.Р., Эмери А.М., Роллинсон Д. Молекулярная характеристика пресноводных улиток рода Bulinus: роль штрих-кодов? Паразиты и переносчики. 2008; 1: 1–15.
- 19. Фрайвальд А., Зауэр С. Филогенетическая классификация и идентификация бактерий с помощью масс-спектрометрии. Нат Проток. 2009;4: 732–742. пмид:193
- 20. Seng P, Rolain JM, Fournier PE, La Scola B, Drancourt M, Raoult D. Применение MALDI-TOF-масс-спектрометрии в клинической микробиологии. Будущая микробиология. 2010. стр. 1733–1754. пмид:21133692
- 21. Меллманн А., Клауд Дж., Майер Т., Кеккевоет Ю., Раммингер И., Ивен П. и др. Оценка матричной лазерной десорбционной ионизации-времяпролетной масс-спектрометрии по сравнению с секвенированием гена 16S рРНК для видовой идентификации неферментирующих бактерий.J Clin Microbiol. 2008; 46: 1946–1954. пмид:18400920
- 22. Уэлхэм К.Дж., Домин М.А., Джонсон К., Джонс Л., Эштон Д.С. Характеристика грибковых спор методом времяпролетной масс-спектрометрии с лазерной десорбцией/ионизацией. Быстрый общественный масс-спектр. 2000; 14: 307–10.
- 23. Ли TY, Лю BH, Чен YC. Характеристика спор Aspergillus с помощью времяпролетной масс-спектрометрии с лазерной десорбцией/ионизацией на матрице. Быстрый общественный масс-спектр. 2000; 14: 2393–400. пмид:11114056
- 24.Van Veen SQ, Claas ECJ, Kuijper EJ. Высокопроизводительная идентификация бактерий и дрожжей с помощью матричной лазерной десорбции, ионизации и времяпролетной масс-спектрометрии в обычных медицинских микробиологических лабораториях. J Clin Microbiol. 2010; 48: 900–907. пмид:20053859
- 25. Huguenin A, Depaquit J, Villena I, Ferté H. Масс-спектрометрия MALDI-TOF: новый инструмент для быстрой идентификации церкарий (Trematoda, Digenea). Паразит. 2019;26:11. pmid:30838972
- 26.Fournier PE, Couderc C, Buffet S, Flaudrops C, Raoult D. Быстрая и экономичная идентификация видов Bartonella с помощью масс-спектрометрии. J Med Microbiol. 2009; 58: 1154–1159. пмид:19528172
- 27. Yssouf A, Almeras L, Berenger JM, Laroche M, Raoult D, Parola P. Идентификация видов клещей и распространение возбудителя с использованием гемолимфы с помощью MALDI-TOF MS. Клещи Tick Borne Dis. 2015;6: 579–586. пмид:26051210
- 28. Yssouf A, Socolovschi C, Flaudrops C, Ndiath MO, Sougoufara S, Dehecq JS, et al.Матричная лазерная десорбционная ионизация — времяпролетная масс-спектрометрия: новый инструмент для быстрой идентификации комаров-переносчиков. ПЛОС Один. 2013;8: 1–10. пмид:23977292
- 29. Иссуф А., Соколовски С., Леулми Х., Керниф Т., Битам И., Аудоли Г. и др. Идентификация видов блох с помощью MALDI-TOF/MS. Comp Immunol Microbiol Infect Dis. 2014; 37: 153–157. пмид: 24878069
- 30. Stephan R, Johler S, Oesterle N, Näumann G, Vogel G, Pflüger V. Быстрая и надежная идентификация видов морских гребешков с помощью масс-спектрометрии MALDI-TOF.Пищевой контроль. 2014; 46: 6–9.
- 31. Сенгор Б., Диау О.Т., Дукур С., Сей М., Талла И., Диалло А. и др. Изучение промежуточных хозяев улиток урогенитального шистосомоза в Ниакхаре, регион Фатик, западно-центральный Сенегал. Паразиты и переносчики. 2015;8: 1–8.
- 32. Мандал-Барт Г. Ключ к идентификации пресноводных улиток восточной и центральной Африки, имеющих медицинское и ветеринарное значение. Bull World Health Organ. 1962; 27: 135–150. пмид:14469160
- 33.Чапелл Л. Пресноводные улитки Африки и их медицинское значение (второе издание). Trans R Soc Trop Med Hyg. 1994; 88: 717.
- 34. Льюис Ф.А., Стируолт М.А., Соуза К.П., Газзинелли Г. Крупномасштабное лабораторное обслуживание Schistosoma mansoni с наблюдениями за тремя комбинациями шистосомы/улитки-хозяина. Журнал паразитологии. 1986. стр. 813–829. пмид:3546654
- 35. Льюис Ф. Шистосомоз. Текущие протоколы в иммунологии. Хобокен, Нью-Джерси, США: John Wiley & Sons, Inc.; 2001. С. 19.1.1–19.1.28. https://doi.org/10.1002/0471142735.im1901s28 pmid:18432750
- 36. Экин И., Шешен Р., Алкан Х., Акбал Э., Башхан М. Содержание белка в пяти тканях некоторых съедобных и несъедобных улиток и двустворчатых моллюсков, распространенных на территории Турции. науч. нац. 2016;6: 435–438.
- 37. Неббак А., Уиллкокс А.С., Битам И., Рауль Д., Парола П., Альмерас Л. Стандартизация гомогенизации образцов для идентификации комаров с использованием инновационного протеомного инструмента, основанного на профилировании белков.Протеомика. 2016; 16: 3148–3160. пмид:27862981
- 38. Иссуф А., Альмерас Л., Рауль Д., Парола П. Новые инструменты для идентификации переносчиков членистоногих. Будущая микробиология. Медицина будущего ООО; 2016. С. 549–566. пмид:27070074
- 39. Севестр Дж., Диарра А.З., Ларош М., Альмерас Л., Парола П. Времяпролетная масс-спектрометрия с лазерной десорбцией/ионизацией с использованием матрицы: новый инструмент для изучения переносчиков инфекционных заболеваний человека. Будущая микробиология.2021; 16: 323–340. пмид:33733821
- 40. Диарра А.З., Альмерас Л., Ларош М., Беренджер Дж.М., Коне А.К., Бокум З. и др. Молекулярная и MALDI-TOF идентификация клещей и клещевых бактерий в Мали. PLoS Negl Trop Dis. 2017;11. пмид:28742123
- 41. Иссуф А., Флодропс С., Драли Р., Керниф Т., Соколовски С., Беренгер Дж. М. и соавт. Лазерная десорбционная ионизация-времяпролетная масс-спектрометрия с использованием матрицы для быстрой идентификации клещей-переносчиков. J Clin Microbiol.2013; 51: 522–528. пмид:23224087
- 42. Неббак А., Кумаре С., Уиллкокс А.С., Беренгер Дж.М., Рауль Д., Альмерас Л. и др. Полевое применение MALDI-TOF MS для идентификации личинок комаров. Паразитология. 2018; 145: 677–687. пмид:28768561
- 43. Dieme C, Yssouf A, Vega-Rúa A, Berenger JM, Failloux AB, Raoult D, et al. Точная идентификация Culicidae на водных стадиях развития с помощью профилирования MALDI-TOF MS. Паразиты и переносчики. 2014;7: 544. pmid:25442218
- 44.Фолмер О., Блэк М., Хоэ В., Лутц Р., Вриенхук Р. ДНК-праймеры для амплификации субъединицы I митохондриальной цитохром-с-оксидазы из различных многоклеточных беспозвоночных. Мол Мар Биол Биотехнолог. 1994;3: 294–299.
- 45. Палумби С.Р., Мартин А., Романо С., Макмиллан В.О., Стайс Л., Грабовски Г. Руководство для простых дураков по ПЦР. Гавайская пресса Гонолулуского университета. 1991.
- 46. Альтшул С.Ф., Гиш В., Миллер В., Майерс Э.В., Липман Д.Дж. Базовый инструмент локального поиска выравнивания.J Mol Biol. 1990; 215: 403–410. пмид:2231712
- 47. Томас РХ. Молекулярная эволюция и филогенетика. Наследственность (Эдинб). 2001; 86: 385–385.
- 48. Кумар С., Стечер Г., Тамура К. MEGA7: Молекулярно-эволюционный генетический анализ версии 7.0 для больших наборов данных. Мол Биол Эвол. 2016; 33: 1870–1874 гг. пмид:27004904
- 49. Рамбо А. Инструмент для рисования фигур дерева, версия 1.4.2.2006–2014. http://tree.bio.ed.ac.uk/; 2014.
- 50. Тен Хоув Р.Дж., Вервей Дж.Дж., Верекен К., Полман К., Дией Л., ван Лисхаут Л.Мультиплексная ПЦР в реальном времени для обнаружения и количественного определения инфекции Schistosoma mansoni и S. haematobium в образцах стула, собранных в северном Сенегале. Trans R Soc Trop Med Hyg. 2008; 102: 179–185. пмид:18177680
- 51. Гамбургер Дж., Хе-На, Аббаси И., Рамзи Р.М., Журдан Дж., Руппель А. Анализ полимеразной цепной реакции, основанный на повторяющейся последовательности Schistosoma haematobium: потенциальный инструмент для мониторинга воды, зараженной шистосомами. Am J Trop Med Hyg. 2001; 65: 907–911.пмид:117
- 52. Cnops L, Soentjens P, Clerinx J, van Esbroeck M. ПЦР в реальном времени, специфичная для Schistosoma haematobium, для диагностики урогенитального шистосомоза в образцах сыворотки международных путешественников и мигрантов. PLoS Negl Trop Dis. 2013;7. пмид:24009791
- 53. Кумса Б., Ларош М., Альмерас Л., Медианников О., Рауль Д., Парола П. Морфологическая, молекулярная и MALDI-TOF масс-спектрометрическая идентификация видов иксодовых клещей, собранных в Оромии, Эфиопия.Паразитол рез. 2016; 115: 4199–4210. пмид:27469536
- 54. Бушейхчух М., Ларош М., Ауади А., Диб Л., Бенахла А., Рауль Д. и др. MALDI-TOF MS идентификация клещей домашних и диких животных в Алжире и молекулярное обнаружение ассоциированных микроорганизмов. Comp Immunol Microbiol Infect Dis. 2018; 57: 39–49. пмид:30017077
- 55. Каргер А., Беттин Б., Гетманн Дж. М., Клаус С. Времяпролетная масс-спектрометрия клещей с лазерной десорбцией / ионизацией на матрице всего животного (MALDI-TOF): спектры нимф Ixodes ricinus под влиянием окружающей среды, пространства и времени. факторы? ПЛОС Один.2019;14. пмид:30645604
- 56. Каргер А., Кампен Х., Беттин Б., Даутель Х., Циллер М., Хоффманн Б. и др. Определение видов и характеристика стадий развития клещей с помощью масс-спектрометрии с лазерной десорбцией/ионизацией на матрице целых животных. Клещи Tick Borne Dis. 2012;3: 78–89. пмид:22487425
- 57. Матис А., Депакит Дж., Дворжак В., Тутен Х., Банульс А.Л., Халада П. и др. Идентификация москитов-флеботоминов с использованием одной справочной базы данных MALDI-TOF MS и двух масс-спектрометрических систем.Паразиты и переносчики. 2015;8: 266. pmid:25957576
- 58. Лафри И., Альмерас Л., Битам И., Капуто А., Иссуф А., Форестье К.Л. и др. Идентификация алжирских переносчиков флеботоминовых москитов, пойманных в полевых условиях, с помощью MALDI-TOF MS. PLoS Negl Trop Dis. 2016;10: e0004351. пмид:26771833
- 59. Мюллер П., Пфлюгер В., Виттвер М., Циглер Д., Чандре Ф., Симард Ф. и др. Идентификация загадочных видов комаров Anopheles с помощью анализа молекулярного белка. ПЛОС Один. 2013;8: e57486.пмид:23469000
- 60. Yssouf A, Parola P, Lindström A, Lilja T, L’ambert G, Bondesson U, et al. Идентификация европейских видов комаров методом MALDI-TOF MS. пмид:24737398
- 61. Рахарималала Ф.Н., Андрианинаривоманана Т.М., Ракотондрасоа А., Коллард Дж.М., Бойер С. Полезность и точность масс-спектрометрии MALDI-TOF в качестве дополнительного инструмента для идентификации видов комаров-переносчиков и инвестирования в развитие международной базы данных. Мед Вет Энтомол. 2017; 31: 289–298.пмид:28426182
- 62. Тандина Ф., Ниаре С., Ларош М., Коне А.К., Диарра А.З., Онгойба А. и др. Использование MALDI-TOF MS для идентификации комаров, собранных в Мали, и их крови. Вик Лит Культ. 2018; 145: 1170–1182. пмид:29409547
- 63. Мевара А., Шарма М., Каура Т., Заман К., Ядав Р., Сегал Р. Быстрая идентификация важных с медицинской точки зрения комаров с помощью времяпролетной масс-спектрометрии с лазерной десорбцией/ионизацией с использованием матрицы. Паразиты и переносчики. 2018;11.
- 64. Хоппенхейт А., Муругайян Дж., Бауэр Б., Штойбер С., Клаузен П.Х., Реслер У. Идентификация цеце (Glossina spp.) с использованием времяпролетной масс-спектрометрии лазерной десорбции/ионизации с матрицей. PLoS Negl Trop Dis. 2013;7. пмид:23875040
- 65. Laroche M, Bérenger JM, Gazelle G, Blanchet D, Raoult D, Parola P. Профилирование белка MALDI-TOF MS для быстрой идентификации триатомовых переносчиков болезни Шагаса и применения к триатомовой фауне Французской Гвианы.Паразитология. 2018; 145: 665–675. пмид:28768559
- 66. Benkacimi L, Gazelle G, El Hamzaoui B, poBérenger JM, Parola P, Laroche M. MALDI-TOF MS идентификация клопов Cimex lectularius и Cimex hemipterus. Заразить Генет Эвол. 2020;85. пмид:32927120
- 67. Зурита А., Джегар Р., Кальехон Р., Кутильяс С., Парола П., Ларош М. Времяпролетная масс-спектрометрия с лазерной десорбцией/ионизацией с использованием матрицы как полезный инструмент для быстрой идентификации диких переносчиков блох, консервированных в спирте.Мед Вет Энтомол. 2019; 33: 185–194. пмид:30516832
- 68. Сингхал Н., Кумар М., Канауджиа П.К., Вирди Дж.С. Масс-спектрометрия MALDI-TOF: новая технология идентификации и диагностики микробов. Границы микробиологии. Фонд исследований границ; 2015. pmid:26300860
- 69. Робинн С., Саад Дж., Морсли М., Зелика Харуна Х., Тазерарт Ф., Дранкур М. и др. Название: Видообразование комплекса микобактерий туберкулеза с помощью масс-спектрометрии: 1 проверка концепции.2 Текущее название: Видообразование микобактерий по MALDI-TOF Принадлежность: 6 1. Количество слов в тексте: 2367. bioRxiv. 2021; 2021.02.04.429756. 10.1101/2021.02.04.429756
- 70. Thuillier J, Py JS, Gassilloud B, Ioos R. Проспективное исследование технологии MALDI-TOF для идентификации и характеристики фитопатогенных грибов. 2016.
- 71. El Khéchine A, Couderc C, Flaudrops C, Raoult D, Drancourt M. Матричная лазерная десорбция / ионизация Времяпролетная масс-спектрометрия идентификация микобактерий в обычной клинической практике.ПЛОС Один. 2011; 6. пмид:21935444
- 72. Лусиф Л., Бенджама Э., Гаджеми-Киран Д., Ролен Дж.М. Быстрая идентификация изолятов Streptomyces с помощью MALDI-TOF MS. Микробиолог Рез. 2014; 169: 940–947. пмид:24862894
- 73. Биттар Ф., Оушенан З., Смати Ф., Рауль Д., Ролен Дж.М. MALDI-TOF-MS для быстрого обнаружения стафилококкового лейкоцидина Пантона-Валентайна. Противомикробные агенты Int J. 2009; 34: 467–470. пмид:19409760
- 74. Дриснер Д., Фреймозер FM.MALDI-TOF масс-спектроскопия дрожжей и мицелиальных грибов для исследований и диагностики в цепочке добавленной стоимости в сельском хозяйстве. Химические и биологические технологии в сельском хозяйстве. Международное издательство Спрингер; 2017. с. 13.
- 75. Эпплтон С., Миранда Н. Обнаружение очагов передачи бильгарзии в Южной Африке: руководство для персонала общественного здравоохранения. Южноафриканский J Infect Dis. 2015; 30: 95–102.
- 76. Уарти Б., Ларош М., Риги С., Мегуини М.Н., Бенахла А., Рауль Д. и др.Разработка масс-спектрометрии MALDI-TOF для идентификации вшей, выделенных от сельскохозяйственных животных. Паразит. 2020;27. пмид:32351208
- 77. Benyahia H, Ouarti B, Diarra AZ, Boucheikhchoukh M, Meguini MN, Behidji M, et al. Идентификация вшей, хранящихся в спирте, с помощью MALDI-TOF MS. J Med Entomol. 2021; 58: 1126–1133. пмид:33346344
- 78. Пан КТ. Исследования взаимоотношений хозяев и паразитов между Schistosoma mansoni и улиткой Australorbis glabratus.Am J Trop Med Hyg. 1965; 14: 931–976. пмид:5840648
- 79. Мейер М., Мейер-Брук С. Schistosoma mansoni: Влияние на рост, фертильность и развитие дистальных мужских органов у Biomphalaria glabrata, подвергшихся воздействию мирацидий в разном возрасте. Zeitschrift für Parasitenkd Parasitol Res. 1981; 66: 121–131. пмид:7324545
- 80. Беттертон С., Фрайер С.Э., Райт К.А. Bulinus senegalensis (Mollusca: Planorbidae) в северной Нигерии. Энн Троп Мед Паразитол. 1983; 77: 143–149.пмид:6882063
- 81. Мандал-Барт Г. Виды рода Bulinus, промежуточные хозяева Schistosoma *. Bull World Heal Org. 1965; 33: 33–44.
- 82. Стохард Дж. Р., Бремон П., Андриамаро Л., Селлин Б., Селлин Э., Роллинсон Д. Виды Bulinus на Мадагаскаре: молекулярная эволюция, генетические маркеры и совместимость с Schistosoma haematobium. Паразитология. 2001; 123 Приложение: S261–75. пмид:11769288
- 83. Ван Фаассен ЭЭХ, Ванин АФ. Молекулярная эволюция промежуточных хозяев пресноводных улиток в группе Bulinus forskalii.Паразитология. паразитология; 2001. стр. 122–130.
- 84. Мандал-Барт Г. Пресноводные моллюски Уганды и сопредельных территорий. Тервюрен: [Музей Бельгиш-Конго]; 1954.
- 85. Браун Д.С., Кертис Б.А., Бетьюн С., Эпплтон К.С. Пресноводные улитки Восточного Каприви и нижнего бассейна реки Окаванго в Намибии и Ботсване. Гидробиология. 1992; 246: 9–40.
- 86. Сенгупта М.Е., Кристенсен Т.К., Мэдсен Х., Йоргенсен А. Молекулярно-филогенетические исследования Viviparidae (Gastropoda: Caenogastropoda) в озерах рифтовой долины Африки.Мол Филогенет Эвол. 2009; 52: 797–805. пмид:19435609
- 87. Стронг Э.Э., Гаргомини О., Пондер В.Ф., Буше П. Глобальное разнообразие брюхоногих моллюсков (Gastropoda; Mollusca) в пресной воде. Гидробиология. Springer; 2008. С. 149–166. https://doi.org/10.1007/s10750-007-9012-6
- 88. Неббак А., Эль Хамзауи Б., Беренгер Дж. М., Битам И., Рауль Д., Альмерас Л. и др. Сравнительный анализ условий хранения и методов гомогенизации видов клещей и блох для идентификации методом MALDI-TOF MS.Мед Вет Энтомол. 2017; 31: 438–448. пмид: 28722283
- 89. Стоддарт РВ. Фиксаторы и консерванты, их действие на ткани. Манчестерский музей; Департамент экологической биологии; 1989.
- 90. Кауфманн С., Зиглер Д., Шаффнер Ф., Карпентер С., Пфлюгер В., Матис А. Оценка времяпролетной масс-спектрометрии с матричной лазерной десорбцией/ионизацией для характеристики мокрецов Culicoides nubeculosus. Мед Вет Энтомол. 2011; 25: 32–38. пмид:21118284
- 91.Кауфманн С., Шаффнер Ф., Циглер Д., Пфлюгер В., Матис А. Идентификация выловленных в полевых условиях мокрецов Culicoides с помощью времяпролетной масс-спектрометрии с лазерной десорбцией / ионизацией с использованием матрицы. Паразитология. 2012; 139: 248–258. пмид:22008297
- 92. Моравец Ф., Барус В., Рысави Б. Ю. Ф. Антагонизм Echinoparyphium recurvatum против Schistosoma haematobium у улитки Bulinus truncatus. Folia Parasitol (Прага). 1974; 21: 127–41.
- 93. Лайдемит М.Р., Брант С.В., Мутуку М.В., Мкодзи Г.М., Локер Э.С. Разнообразные эхиностомы из Восточной Африки: особое внимание уделяется видам, которые используют Biomphalaria и Bulinus в качестве промежуточных хозяев. Acta Trop. 2019; 193: 38–49. пмид:30710531
- 94. Толедо Р., Муньос-Антоли С., Фрид Б. Использование иглобрюхих для изучения отношений хозяин-паразит между личиночными трематодами и беспозвоночными и хладнокровными позвоночными хозяевами. Паразитологические исследования. 2007. стр. 1177–1185. пмид:17279393
- 95. Лим Х.К., Хейнеман Д.Интрамоллюсканный антагонизм между трематодами: обзор факторов, влияющих на систему паразит-хозяин, и ее возможная роль в биологическом контроле. Ад Паразитол. 1972; 10: 191–268. пмид:4559144
- 96. Sandland GJ, Роджерс JK, Минчелла DJ. Межвидовой антагонизм и вирулентность у хозяев, подвергшихся воздействию двух видов паразитов. J Инвертебр Патол. 2007; 96: 43–47. пмид:17400242
- 97. Динник Я.А. Paramphistomum phillerouxi sp. ноя (Trematoda: Paramphistomatidae) и его развитие у Bulinus forskalii.Дж. Гельминтол. 1961; 35: 69–90. пмид:13723003
Идентификация происхождения влияет на оценки эволюционного режима у морских улиток
. 2020 1 ноября; 69 (6): 1106-1121. дои: 10.1093/sysbio/syaa018.Принадлежности Расширять
Принадлежности
- 1 Группа дикой природы и экологии, Школа сельского хозяйства и окружающей среды, Университет Мэсси, Private Bag 11-222, Palmerston North 4410, Новая Зеландия.
- 2 Департамент рыболовства и дикой природы, Прибрежная морская экспериментальная станция Орегона, Морской научный центр Хэтфилда, Университет штата Орегон, 2030 SE Marine Science Dr, Newport, OR 97365, USA.
- 3 Кафедра зоологии Университета Отаго, 340 Great King Street, Данидин 9016, Отаго, Новая Зеландия.
- 4 Музей Новой Зеландии Те Папа Тонгарева, Веллингтон, Новая Зеландия.
- 5 GNS Science, PO Box 30-368, Lower Hutt 5011, Новая Зеландия.
- 6 Школа географии, окружающей среды и наук о Земле, Веллингтонский университет Виктории, а/я 600, Веллингтон 6012, Новая Зеландия.
Элемент в буфере обмена
Феликс Во и соавт.Сист биол. .
Показать детали Показать вариантыПоказать варианты
Формат АннотацияPubMedPMID
.2020 1 ноября; 69 (6): 1106-1121. дои: 10.1093/sysbio/syaa018.Принадлежности
- 1 Группа дикой природы и экологии, Школа сельского хозяйства и окружающей среды, Университет Мэсси, Private Bag 11-222, Palmerston North 4410, Новая Зеландия.
- 2 Департамент рыболовства и дикой природы, Прибрежная морская экспериментальная станция Орегона, Морской научный центр Хэтфилда, Университет штата Орегон, 2030 SE Marine Science Dr, Newport, OR 97365, USA.
- 3 Кафедра зоологии Университета Отаго, 340 Great King Street, Данидин 9016, Отаго, Новая Зеландия.
- 4 Музей Новой Зеландии Те Папа Тонгарева, Веллингтон, Новая Зеландия.
- 5 GNS Science, PO Box 30-368, Lower Hutt 5011, Новая Зеландия.
- 6 Школа географии, окружающей среды и наук о Земле, Веллингтонский университет Виктории, а/я 600, Веллингтон 6012, Новая Зеландия.
Элемент в буфере обмена
Полнотекстовые ссылки Параметры отображения цитированияПоказать варианты
Формат АннотацияPubMedPMID
Абстрактный
Для изучения эволюционных моделей и процессов нам необходимо иметь возможность точно идентифицировать виды и эволюционные линии, от которых они произошли.Определение соответствия между генетическими и морфологическими вариациями живых популяций, а затем прямое сравнение существующих и ископаемых морфологических данных обеспечивает надежный подход для улучшения нашей идентификации родословных во времени. Мы исследуем генетическую и морфологическую изменчивость раковин у существующих видов морских улиток Penion из Новой Зеландии и расширяем этот анализ до глубокого времени, используя окаменелости. Мы находим, что генетическая и морфологическая изменчивость определяет сходные модели и поддерживает большинство признанных в настоящее время существующих видов.Однако выявлено некоторое таксономическое чрезмерное разбиение из-за того, что размер раковины является плохим признаком для разграничения видов, и мы выявили неправильную принадлежность некоторых ископаемых образцов. Мы делаем вывод, что единая эволюционная линия (Penion sulcatus) существовала в течение 22 млн лет, при этом большинство аспектов формы и размера раковины развивались случайным образом. Однако, удаляя образцы, ранее классифицированные как вымерший вид P. marwicki, мы вместо этого обнаруживаем морфологический застой для одной оси изменения формы раковины.Этот результат демонстрирует, как идентификация родословной может изменить наше восприятие эволюционного паттерна и процесса. [Генотипирование путем секвенирования; геометрическая морфометрия; морфологическая эволюция; неогастроподы; фенотип; видообразование; стаз.].
© Автор(ы), 2020. Опубликовано Oxford University Press от имени Общества систематических биологов. Все права защищены.Чтобы получить разрешения, отправьте электронное письмо по адресу: [email protected].
Похожие статьи
- Эволюционные линии морских улиток выявлены с помощью молекулярной филогенетики и геометрического морфометрического анализа раковин.
Во Ф., Тревик С.А., Крэмптон Дж.С., Маршалл Б.А., Беу А.Г., Хиллз С.Ф.К., Морган-Ричардс М. Во Ф. и др. Мол Филогенет Эвол. 2018 Октябрь; 127: 626-637.doi: 10.1016/j.ympev.2018.06.009. Epub 2018 15 июня. Мол Филогенет Эвол. 2018. PMID: 290
- Окаменелости янтаря мелового периода подчеркивают эволюционную историю и морфологический консерватизм наземных улиток.
Хирано Т., Асато К., Ямамото С., Такахаши Ю., Тиба С. Хирано Т. и др. Научный представитель 4 ноября 2019 г .; 9 (1): 15886. doi: 10.1038/s41598-019-51840-3. Научный представитель2019. PMID: 31685840 Бесплатная статья ЧВК.
- Адаптивная дивергенция в морфологии раковины продолжающейся радиации брюхоногих моллюсков из озера Малави.
Ван Бокслаер Б., Ортис-Сепульведа К.М., Гурдебеке П.Р., Векеманс Х. Ван Бокслаер Б. и др. БМС Эвол Биол. 2020 9 января; 20 (1): 5. doi: 10.1186/s12862-019-1570-5. БМС Эвол Биол. 2020. PMID: 319 Бесплатная статья ЧВК.
- Перспективы изучения морфологической изменчивости наземных легочных улиток.
Суворов АН. Суворов АН. Изв Акад Наук Сер Биол. 2002 г., сентябрь-октябрь; (5): 561-75. Изв Акад Наук Сер Биол. 2002 г. PMID: 12400379 Обзор. Русский.
- Нахождение неизвестных видов в геномах существующих видов.
Ли Ю, Ву ДД. Ли Ю и др. Джей Дженет Геномикс. 2021 20 октября; 48 (10): 867-871. doi: 10.1016/j.jgg.2021.05.013. Epub 2021 3 июля. Джей Дженет Геномикс. 2021. PMID: 34509382 Обзор.
Типы публикаций
- Поддержка исследований, за пределами США Правительство
Условия MeSH
- Панцири животных / анатомия и гистология
- Улитки / анатомия и гистология
Укажите
КопироватьФормат: ААД APA ГНД NLM
Все, что вам нужно знать о слизнях и улитках
Слизни и улитки досаждают садоводам по всему миру.Как только появляются долгожданные листья и нежные съедобные плоды, эти бродящие по ночам вредители проникают внутрь. Поврежденные саженцы, изрешеченные дырками растения и слизистые следы предательской слизи — верные признаки того, что на вашем газоне и в саду побывали слизни или улитки. Понимая, с чем вы сталкиваетесь, вы можете защитить свои растения от этих разрушительных вредителей.
Хотя слизни и улитки являются обычными садовыми вредителями, они мало связаны с садовыми насекомыми. В животном мире эти существа принадлежат к категории, известной как моллюски, к той же группе, в которую входят осьминоги и устрицы.Слизни и улитки классифицируются как брюхоногие, где «гастро» означает желудок, а «стручок» означает ногу. Название хорошо отражает их анатомию. Прожорливые едоки, они скользят на мускулистой ноге, поедая растения и выделяя на ходу слизистую слизь.
Одно видимое различие между этими близкородственными вредителями заключается в том, что у улиток есть твердые защитные внешние раковины. У некоторых слизней есть мягкие внутренние раковины или выступающие мантии, а у других вообще ничего нет. И у слизней, и у улиток есть два верхних щупальца, которые выступают изо лба.Используемые для зрения и обоняния, они несут глаза на кончиках. Более короткие нижние щупальца, отходящие от головы, используются для осязания и вкуса.
Слизни быстро уничтожают урожай и оставляют после себя слизистую массу.
Популяции слизняков и улиток наиболее высоки в теплом, влажном и влажном климате. В Соединенных Штатах прибрежные районы Тихого и Атлантического океанов являются основными регионами для слизней и улиток, особенно сильно пострадали северо-запад Тихого океана, тропические и субтропические Гавайи и Флорида.Но даже садоводам в более прохладном северном климате эти вредители угрожают. От Мэна до Миннесоты слизни и улитки просто пережидают зиму в укрытиях, защищающих их от замерзания.
Защитные раковины улиток также влияют на их местонахождение. Чтобы правильно формировать раковины, улиткам нужен кальций, который дикие улитки получают в основном из почвы. Эта потребность ограничивает их ареал областями, где естественные почвенные и погодные условия сочетаются, чтобы почвенный кальций был легко доступен. Их панцири также помогают им переносить этот часто более сухой климат.Безпанцирным, незащищенным слизням не нужен кальций, как улиткам; им нужна влага. Они процветают там, где их много.
Многие вредители-слизни и улитки, наносящие ущерб садам США, не являются местными жителями районов, в которых они обитают. Неместные виды были завезены в страну на протяжении многих лет — преднамеренно и непреднамеренно — прекрасно адаптируясь и находя прибрежный климат США, растения и сельскохозяйственные культуры по своему вкусу. Такие штаты, как Калифорния и Флорида, ежегодно тратят десятки миллионов долларов на борьбу с этими инвазивными вредителями. 3
Сады и газоны особенно привлекательны для слизней и улиток, потому что они обычно регулярно орошаются или поливаются. В садах достаточно места для укрытия от солнца и ветров, которые могут высушить этих вредителей. Они также обеспечивают шведский стол из нежных листьев и побегов, которые предпочитают слизни и улитки. Даже когда на территорию обрушивается мало осадков, эти злоумышленники могут рассчитывать на ухоженные сады и газоны для получения влаги и пищи, в которых они нуждаются.
В солнечные дни и в жаркие летние месяцы слизни и улитки укрываются там, где они могут оставаться прохладными и влажными.Они появляются ночью или когда накатывают облака или туман. В вашем саду и вокруг него вы обнаружите, что они чувствуют себя комфортно и влажно под густым почвопокровным покровом, нетронутыми сорняками, остатками листьев, выброшенными досками и подобными предметами. Удаление этих укрытий, использование капельного орошения вместо полива водой и посадка засухоустойчивых растений, которым требуется меньше воды, может помочь сделать ваш сад менее привлекательным для этих вредителей.
Улитки и слизни часто охотятся на нежные травы и жадно питаются.
Слизни и улитки питаются живым и разлагающимся растительным материалом, но предпочитают молодые, нежные растения. Первыми мишенями часто становятся только что проросшие саженцы и мягкий рост укоренившихся растений. Также предпочтительны салаты и нежные травы, такие как базилик, а также лиственные растения, такие как хосты. Когда слизни и улитки питаются, они создают большие отверстия неправильной формы. В отличие от грубых, неровных краев, оставляемых многими грызущими насекомыми, слизни и улитки оставляют очень ровные края.
Вред от слизней и улиток не ограничивается листвой и нежными стеблями.Эти вредители питаются сочными фруктами, такими как клубника и помидоры, и даже цитрусовыми. Они, как правило, избегают растений с грубыми ароматными листьями, таких как розмарин. Не обремененные раковинами, слизни также проводят время под землей в поисках влаги. Они угрожают корнеплодам, только что посаженным семенам и луковицам.
Поскольку слизни и улитки питаются в основном ночью, отверстия и следы слизи могут быть вашими единственными доказательствами. Последней подсказкой является степень повреждения. Эти прожорливые существа ежедневно съедают растительный материал, в несколько раз превышающий их собственный вес, преодолевая расстояние до 40 футов, чтобы поесть. 4 Влажная, умеренная погода весной и поздней осенью сигнализирует о наилучшем времени для поражения слизнями и улитками.
В отличие от улиток, у слизней вместо защитных внешних панцирей мягкие мантии.
Хотя один или два слизняка или улитки могут показаться немногочисленными, популяция может быстро увеличиваться. Слизни и улитки спариваются, но у них есть как мужские, так и женские репродуктивные органы. Это означает, что каждый слизень или улитка может откладывать яйца. Обыкновенные улитки могут откладывать до шести кладок яиц в год, до 80 яиц в кладке. 2 Некоторые слизни откладывают до 500 яиц в год, которые созревают через три-шесть месяцев и сами начинают откладывать яйца. 4,2 Если не остановить, это сотни новых вредителей каждый год, умноженные на каждого слизняка или улитку в вашем саду.
Кроме того, несколько видов инвазивных слизней и улиток переносят паразитов и болезни, которые могут передаваться животным и людям при контакте с мясом или слизью улиток и слизней. 3 К ним относятся потенциально смертельные заболевания человека, такие как эозинофильный менингит.Это подчеркивает необходимость всегда надевать перчатки при работе с этими вредителями и учить детей вообще не обращаться со слизнями и улитками.
Если в ваш сад забредут слизни или улитки, вы сможете защитить растения от вреда, который они могут причинить. Торговые марки Corry’s и Deadline предлагают высокоэффективные, простые в использовании и понятные продукты для борьбы со слизнями и улитками, разработанные специально для этих разрушительных моллюсков. Corry’s здесь, чтобы помочь вам защитить ваши растения, как они это делают уже более 70 лет.
Всегда внимательно читайте этикетки продуктов и строго следуйте инструкциям.
Corry’s с дизайном и Deadline являются зарегистрированными товарными знаками Matson, LLC.
Источники:
1. Древес, А.Дж. и Миллер, Дж. К., «Запчасти для слизней», Университет штата Орегон,
.2. Флинт, М.Л. и Вилен, К.А., «Улитки и слизни», Комплексная программа борьбы с вредителями штата Калифорнийский университет, ноябрь 2009 г.
3. Розетта Р.Л., «История улитки», Университет штата Орегон, август 2004 г.
.4. Розетта, Р.Л., «Слизни», Университет штата Орегон, июнь 2005 г.
Яйцевидная янтарная улитка Читтенанго — Департамент охраны окружающей среды штата Нью-Йорк
Научное название: Novisuccinea chittenangoensis
Нью-Йорк Статус: Исчезающий
Федеральный статус: Под угрозой исчезновения
Описание
Яйцевидная янтарная улитка Читтенанго имеет полупрозрачную раковину с 3 1/2 оборотами на удлиненном шпиле.Максимальный размер составляет около 0,9 дюйма (23 мм). Скорлупа глянцевая, от не совсем белого до бледного или розовато-желтого цвета, с морщинами и линиями роста. Мягкое тело улитки бледно-желтого цвета. Внешнее покрытие мягких частей, называемое мантией, бледно-желтовато-оливкового цвета, часто с черными полосами и пятнами. На верхней стороне стопы можно обнаружить заметное темное пятно.
История жизни
Этот вид представляет собой наземную улитку с продолжительностью жизни около двух с половиной лет.Это гермафродиты (особи, имеющие как мужские, так и женские репродуктивные органы) и спариваются с апреля по июнь. Примерно через месяц после спаривания откладывается от четырех до пятнадцати прозрачных желеобразных яиц. Молодые улитки вылупляются через 2-3 недели, размером 0,04 дюйма (1 мм).
Улитки Читтенанго, по-видимому, питаются микроскопическими водорослями и другими видами микрофлоры, которые растут на камнях и растительности, встречающейся в зоне брызг водопада, вокруг которого они живут. Они потребляют много карбоната кальция для развития раковины.Приспособленная к относительно постоянным экологическим и климатическим условиям, в том числе к чистой воде, улитка нетерпима к резким переменам.
Распространение и среда обитания
Улитка Читтенанго, по-видимому, эволюционировала в эпоху плейстоцена. Подобные улитки встречались в изолированных карманах от Теннесси до Онтарио и на западе до Айовы и Миннесоты. Хотя ископаемые раковины, внешне похожие на улитку Читтенанго, были обнаружены и в других местах, живые экземпляры можно найти только в одном месте во всем мире: в водопаде высотой 100 футов в центре Нью-Йорка.Водопад находится в государственном парке Читтенанго, который находится в ведении Управления парков, отдыха и сохранения исторического наследия штата Нью-Йорк.
Предпочтительная среда обитания – поросшие растительностью склоны, прилегающие к водопаду, с их умеренным климатом и высокой влажностью. Улитки читтенанго водятся среди участков недотроги, мхов и печеночников.
Статус
Яйцевидная янтарная улитка Читтенанго была описана как «многочисленная», когда она была впервые обнаружена у водопада Читтенанго в округе Мэдисон в 1905 году.Общая численность населения в 1982 г. оценивалась менее чем в 500 человек; однако к 1990 году их число сократилось до менее 25.
Улитка Читтенанго занесена в список находящихся под угрозой исчезновения из-за чрезвычайно ограниченного ареала обитания и, по-видимому, уменьшения численности с момента открытия. Его существование только в одном месте делает его чрезвычайно уязвимым для катастрофического события, которое может уничтожить всю популяцию. Факторы, которые, как считается, отрицательно влияют на улиток, включают загрязнение воды, непреднамеренное нарушение среды обитания людьми, чувствительность к окружающей среде и внедрение близкородственных видов вредителей.Большая часть водораздела ручья Читтенанго используется для сельского хозяйства, в дренаж попадают удобрения, гербициды и пестициды. В зимние месяцы дорожная соль вызывает сильное засоление. Хотя качество воды, как представляется, в целом высокое, воздействие кратковременных пульсаций загрязненного стока от этих агентов может быть пагубным для населения.
В 1984 году у водопада Читтенанго была обнаружена близкородственная улитка, похожая на Succinea putris из Европы. Эта улитка, вероятно, попала в водопад случайно, очевидно, превосходит улитку Читтенанго.Недавняя перепись улиток показала, что виды вредителей численно превосходят яйцевидных янтарных улиток Читтенанго как минимум в 50 к 1.
Потребности в управлении и исследованиях
Департамент охраны окружающей среды штата Нью-Йорк взял на себя ведущую роль в разработке и завершении плана восстановления этого вида. В марте 1983 года Служба охраны рыбных ресурсов и дикой природы США окончательно утвердила План восстановления янтарных улиток овата Читтенанго. Этот план содержит подробный план действий, необходимых для защиты и сохранения самодостаточной колонии.
Восстановление этого вида отчасти требует строгой защиты его среды обитания и сокращения попадания загрязняющих веществ в ручей. Государственный парк Читтенанго ежегодно принимает более 100 000 посетителей. Менеджеры парка направляют посетителей подальше от критической зоны обитания, а непосредственная территория водопада относительно недоступна. Несмотря на эти меры предосторожности, были замечены случаи вытаптывания и опрокидывания камней. Любое нарушение может серьезно повлиять на репродуктивный успех.
Для обеспечения дальнейшего существования этого уникального вида и увеличения его популяции требуется колония улиток в неволе.Усилия по созданию колонии улиток Читтенанго в неволе начались в 1992 году. Коллекция из четырех взрослых улиток произвела около 40 детенышей. Как и ожидалось, первоначальные результаты показывают, что улитки Читтенанго не размножаются и не растут так быстро, как виды улиток-вредителей, но они, по крайней мере, обнадеживают тем, что этот вид можно поддерживать и разводить в неволе.
Необходимы дополнительные детальные исследования экологии и истории жизни овальной янтарной улитки Читтенанго.
Молекулярная идентификация Bulinus spp.улитки-промежуточные хозяева Schistosoma spp. в кратерных озерах западной Уганды с последствиями для передачи паразитов группы Schistosoma haematobium | Parasites & Vectors
Bergquist R, Zhou XN, Rollinson D, Reinhard-Rupp J, Klohe K. Ликвидация шистосомоза: необходимые инструменты. Заразить дис бедностью. 2017;6:158.
ПабМед ПабМед Центральный Статья Google Scholar
Хотез П.Дж., Камат А.Забытые тропические болезни в странах Африки к югу от Сахары: обзор их распространенности, распространения и бремени болезней. PLoS Negl Trop Dis. 2009;3:e412.
Центральный пабмед Статья Google Scholar
van der Werf MJ, de Vlas SJ, Brooker S, Looman CW, Nagelkerke NJ, Habbema JD, Engels D. Количественная оценка клинической заболеваемости, связанной с шистосомной инфекцией в странах Африки к югу от Сахары. Acta Trop. 2003; 86: 125–39.
ПабМед Статья ПабМед Центральный Google Scholar
Кинг Ч. Паразиты и бедность: случай шистосомоза. Acta Trop. 2010; 113:95–104.
ПабМед Статья ПабМед Центральный Google Scholar
Бриндли П.Дж., Хотез П.Дж. Вспышка: урогенитальный шистосомоз и инфекция Schistosoma haematobium в постгеномную эру. PLoS Negl Trop Dis. 2013;7:e1961.
ПабМед ПабМед Центральный Статья Google Scholar
Colley DG, Bustinduy AL, Secor WE, King CH. Шистосомоз человека. Ланцет. 2014; 383:2253–64.
ПабМед ПабМед Центральный Статья Google Scholar
Rinaldi G, Okatcha TI, Popratiloff A, Ayuk MA, Suttirapa S, Mann VH, et al. Генетическая манипуляция Schistosoma haematobium , запущенной шистосомы. PLoS Negl Trop Dis. 2011;5:e1348.
CAS PubMed ПабМед Центральный Статья Google Scholar
Роллинсон Д., Вебстер Дж. П., Вебстер Б., Ньякаана С., Йоргенсен А., Стотхард Дж. Р. Генетическое разнообразие шистосом и улиток: последствия для контроля. Паразитология. 2009; 136:1801–11.
CAS PubMed Статья ПабМед Центральный Google Scholar
Левенберг С. Борьба Уганды с шистосомозом. Ланцет. 2014; 383:1707–8.
ПабМед Статья ПабМед Центральный Google Scholar
Адрико М., Тинкитина Б., Тукахебв Э.М., Стэндли С.Дж., Стотард Дж.Р., Кабатерейн Н.Б. Эпидемиология шистосомоза в регионе Ланго, Уганда, через 60 лет после Schwetz 1951: можно ли ликвидировать шистосомоз путем массового введения лекарств без других поддерживающих мер контроля? Acta Trop. 2018;185:412–8.
CAS PubMed Статья ПабМед Центральный Google Scholar
Кабатерейн Н.Б., Брукер С., Тукахебва Э.М., Казибве Ф., Онапа А.В.Эпидемиология и география Schistosoma mansoni в Уганде: последствия для планирования контроля. Троп Мед Int Health. 2004; 9: 372–80.
ПабМед Статья ПабМед Центральный Google Scholar
Kazibwe F, Makanga B, Rubaire-Akiiki C, Ouma J, Kariuki C, Kabatereine NB, et al. Исследования передачи кишечного шистосомоза в озере Альберт, Уганда, и экспериментальная совместимость местных видов Biomphalaria spp.Паразитол Интерн. 2010;59:49–53.
CAS PubMed Статья ПабМед Центральный Google Scholar
Онгом В.Л., Брэдли Д.Дж. Эпидемиология и последствия инфекции Schistosoma mansoni в Западном Ниле, Уганда. I. Полевые исследования общины Паньягоро. Trans R Soc Trop Med Hyg. 1972; 66: 835–51.
CAS PubMed Статья ПабМед Центральный Google Scholar
Стэндли CJ, Goodacre SL, Wade CM, Stothard JR. Генетическая структура популяции Biomphalaria choanomphala в озере Виктория, Восточная Африка: значение для передачи шистосомоза. Векторы паразитов. 2014;7:524.
ПабМед ПабМед Центральный Статья Google Scholar
John R, Ezekiel M, Philbert C, Andrew A. Передача шистосомоза в высокогорных кратерных озерах на западе Уганды. BMC Infect Dis.2008; 8:110.
ПабМед ПабМед Центральный Статья Google Scholar
Лахиш Т., Тандлич М., Гроссман Т., Шварц Э. Высокий уровень заболеваемости шистосомозом у путешественников после кратковременного пребывания в высокогорном кратерном озере Ньинамбуга, Уганда. Clin Infect Dis. 2013;57:1461–4.
ПабМед Статья ПабМед Центральный Google Scholar
Мелак Дж.М.Морфометрические, физические и химические особенности озер вулканических кратеров западной Уганды. Арка Гидробиол. 1978; 84: 430–53.
CAS Google Scholar
Миллс К. Кратерные озера Уганды: лимнология, палеолимнология и палеоэкологическая история. Кандидатская диссертация, Университет Лафборо, Лондон; 2009.
Rumes B, Eggermont H, Verschuren D. Распространение и богатство фауны Cladocera в кратерных озерах западной Уганды.Гидробиология. 2011;676:39.
CAS Статья Google Scholar
Hartter J, Stampone MD, Ryan SJ, Kirner K, Chapman CA, Goldman A. Модели и восприятие изменения климата в горячих точках сохранения биоразнообразия. PloS Один. 2012;7:e32408.
CAS PubMed ПабМед Центральный Статья Google Scholar
Madinga J, Linsuke S, Mpabanzi L, Meurs L, Kanobana K, Speybroeck N, et al.Шистосомоз в Демократической Республике Конго: обзор литературы. Векторы паразитов. 2015; 8:601.
ПабМед ПабМед Центральный Статья Google Scholar
Brooker S, Hay SI, Issae W, Hall A, Kihamia CM, Lwambo NJ, et al. Прогнозирование распространения мочевого шистосомоза в Танзании с использованием данных спутниковых датчиков. Троп Мед Int Health. 2001; 6: 998–1007.
CAS PubMed ПабМед Центральный Статья Google Scholar
Deganello R, Cruciani M, Beltramello C, Duncan O, Oyugi V, Montresor A. Schistosoma hematobium и S. mansoni среди детей, южный Судан. Emerg Infect Dis. 2007; 13:1504–1506.
ПабМед ПабМед Центральный Google Scholar
Sokolow SH, Wood CL, Jones IJ, Swartz SJ, Lopez M, Hsieh MH, et al. Глобальная оценка борьбы с шистосомозом за последнее столетие показывает, что нацеливание на промежуточного хозяина улитки работает лучше всего.PLoS Negl Trop Dis. 2016;7:e0004794.
Артикул Google Scholar
Абэ Э., Го Ю. Х., Шен Х., Муцака-Макуваза М., Хабиб М., Сюэ Дж. Б. и др. Филогеография Bulinus truncatus (Audouin, 1827) (Gastropoda: Planorbidae) в отдельных африканских странах. Trop Med Infect Dis. 2018;3:127.
Центральный пабмед Статья Google Scholar
Коричневый DS.Пресноводные улитки Африки и их медицинское значение. 2-е изд. Лондон: Тейлор и Фрэнсис; 1994.
Google Scholar
Madsen H. Schistosoma улитки промежуточного хозяина. В: Джеймисон БГМ, редактор. Шистосома. Биология, патология и контроль. Бока-Ратон: CRC Press; 2017. с. 46–63.
Google Scholar
Jørgensen A, Madsen H, Nalugwa A, Nyakaana S, Rollinson D, Stothard JR, et al.Молекулярно-филогенетический анализ Bulinus (Gastropoda: Planorbidae) с консервативными ядерными генами. Зоол Скр. 2011;40:126–36.
Артикул Google Scholar
Йоргенсен А., Йоргенсен Л.В., Кристенсен Т.К., Мэдсен Х., Стотард Дж.Р. Молекулярно-филогенетические исследования Bulinus (Gastropoda: Planorbidae) в озере Малави с комментариями о топологическом несоответствии между локусами ДНК. Зоол Скр. 2007; 36: 577–85.
Артикул Google Scholar
Кейн Р.А., Стотхард Дж.Р., Эмери А.М., Роллинсон Д. Молекулярная характеристика пресноводных улиток рода Bulinus : роль штрих-кодов? Векторы паразитов. 2008;1:15.
ПабМед ПабМед Центральный Статья CAS Google Scholar
Stothard JR, Lockyer AE, Kabatereine NB, Tukahebwa EM, Kazibwe F, Rollinson D, et al. Schistosoma bovis в западной части Уганды. Дж. Гельминтол. 2004; 3: 281–4.
Артикул Google Scholar
Налугва А., Йоргенсен А., Ньякаана С., Кристенсен Т.К. Молекулярная филогения Bulinus (Gastropoda: Planorbidae) выявляет присутствие трех видовых комплексов в пресноводных водоемах Альбертинского рифта. Int J Genet Mol Biol. 2010;2:130–9.
CAS Google Scholar
Мандал-Барт Г. Пресноводные моллюски Уганды и сопредельных территорий. Тервюрен: Королевский музей Центральной Африки; 1954.
Google Scholar
Шуман А., Муванга А., Лехто Т., Штаудт М., Шлютер Т., Като В., Намбойера А. Геосайты Уганды. Геол Сегодня. 2015;31:59–67.
Артикул Google Scholar
Коквит К., Плиснир П.Д., Гелорини В., Румес Б., Вершурен Д.Наблюдения за лимнологией и фитопланктоном сообщества кратерного озера Кьянинга (Уганда), с особым вниманием к его диатомовой флоре. Завод Экол Эвол. 2010; 143:365–77.
Артикул Google Scholar
Эфитре Дж., Мюри Д.Дж., Чепмен Л.Дж. Проверка возраста, роста и смертности интродуцированной Tilapia zillii в кратерном озере Нкуруба, Уганда. Экологичность управления рыбой. 2016;23:66–75.
Артикул Google Scholar
Альбрехт С., Уилке Т., Кун К., Стрейт Б. Конвергентная эволюция формы раковины пресноводных блюдечек: африканский род Burnupia . Zool J Linn Soc. 2004; 140: 577–86.
Артикул Google Scholar
Folmer O, Black M, Hoeh W, Lutz R, Vrijenhoek R. ДНК-праймеры для амплификации митохондриальной цитохромной субъединицы I цитохрома c из различных многоклеточных беспозвоночных. Мол Мар Биол Биотехнолог. 1994; 5: 294–9.
Google Scholar
Уилке Т., Дэвис Г.М. Разнообразие внутривидовых митохондриальных последовательностей у Hydrobia ulvae и Hydrobia ventrosa (Hydrobiidae: Rissooidea: Gastropoda): влияет ли их различная история жизни на биогеографические модели и поток генов? Биол Дж. Линн Сок Лонд. 2000;70:89–105.
Артикул Google Scholar
Диль Э., Яукер Б., Альбрехт К., Уилке Т., Уолтерс В.ГИССЕН: университетские коллекции: Гиссенский университет Юстуса-Либиха. В: Бек Л.А., редактор. Зоологические коллекции Германии. Коллекции естественной истории. Чам: Спрингер; 2018. с. 373–81.
Глава Google Scholar
Холл Т.А. BioEdit: удобный редактор выравнивания биологических последовательностей и программа анализа для Windows 95/98/NT. Nucleic Acids Symp Ser. 1999;41:95–98.
CAS Google Scholar
Ронквист Ф., Санмартин И. Филогенетические методы в биогеографии. Annu Rev Ecol Evol Syst. 2011;42:441–64.
Артикул Google Scholar
Дарриба Д., Табоада Г.Л., Доалло Р., Посада Д. jModelTest 2: больше моделей, новая эвристика и параллельные вычисления. Нат Методы. 2012;9:772.
CAS PubMed ПабМед Центральный Статья Google Scholar
Драммонд А.Дж., Рамбо А.BEAST: байесовский эволюционный анализ путем выборки деревьев. БМС Эвол Биол. 2007;7:214.
ПабМед ПабМед Центральный Статья CAS Google Scholar
Клемент М., Посада, округ Колумбия, Крэндалл К.А. TCS: компьютерная программа для оценки генеалогий генов. Мол Экол. 2000; 9: 1657–9.
CAS PubMed Статья ПабМед Центральный Google Scholar
Hammer Ø, Harper DA, Ryan PD.ПРОШЛОЕ: пакет программного обеспечения палеонтологической статистики для обучения и анализа данных. Палеонтол Электрон. 2001;4:9.
Google Scholar
Коричневый ДС. Пресноводный брюхоногий моллюск из Эфиопии. Bull Br Mus Nat Hist Zool. 1965; 12:37–94.
Google Scholar
Лаббо Р., Джибрилла А., Заманка Х., Гарба А., Чиппо Дж.П. Bulinus forskalii : новый потенциальный промежуточный хозяин для Schistosoma haematobium в Нигере.Trans R Soc Trop Med Hyg. 2007; 101:847–8.
CAS PubMed Статья ПабМед Центральный Google Scholar
Ryves DB, Mills K, Bennike O, Brodersen KP, Lamb AL, Leng MJ, et al. Изменение окружающей среды за последнее тысячелетие зафиксировано в двух контрастных кратерных озерах на западе Уганды и в восточной Африке (озера Касенда и Вандакара). Quat Sci Rev. 2011; 30: 555–69.
Артикул Google Scholar
Налугва А., Кристенсен Т.К., Ньякаана С., Йоргенсен А. Вариации митохондриальной ДНК у родственных видов комплекса Bulinus truncatus/tropicus в озере Альберт, западная Уганда. Зоол Стад. 2010;49:515–22.
CAS Google Scholar
Plam M, Jørgensen A, Kristensen TK, Madsen H. Sympatric Biomphalaria видов (Gastropoda: Planorbidae) в озере Альберт, Уганда, демонстрируют гомоплазии в морфологии раковины.Афр Зоол. 2008; 43:34–44.
Артикул Google Scholar
Роуэл С., Фред Б., Бетсон М., Соуза-Фигейредо Дж. К., Кабатерейн Н. Б., Стотард Дж. Р. Экологическая эпидемиология кишечного шистосомоза в Уганде: динамика популяции Biomphalaria (Gastropoda: Planorbidae) в озерах Альберт и Виктория с наблюдениями за естественными инфекциями дигенетическими трематодами. Biomed Res Int. 2015;2015:717261.
ПабМед ПабМед Центральный Статья Google Scholar
Стэндли С.Дж., Уэйд С.М., Стотард М.Р. Новый взгляд на передачу шистосомоза: вводящая в заблуждение история о Biomphalaria в озере Виктория. PloS Один. 2011;6:e26563.
CAS PubMed ПабМед Центральный Статья Google Scholar
Zein-Eddine R, Djuikwo-Teukeng FF, Al-Jawhari M, Senghor B, Huyse T, Dreyfuss G. Филогенез семи видов Bulinus , происходящих из эндемичных районов трех африканских стран, по отношению к кровяная двуустка человека Schistosoma haematobium .БМС Эвол Биол. 2014;14:271.
ПабМед ПабМед Центральный Статья Google Scholar
Zein-Eddine R, Djuikwo-Teukeng FF, Dar Y, Dreyfuss G, Van den Broeck F. Популяционная генетика улитки-хозяина Schistosoma Bulinus truncatus в Египте. Acta Trop. 2017; 172:36–43.
ПабМед Статья ПабМед Центральный Google Scholar
Wilke T, Schultheiß R, Albrecht C. Время идет: простой путеводитель по молекулярным часам у беспозвоночных. Я Малаколь Булл. 2009; 27:25–46.
Артикул Google Scholar
Лемуан М., Барлуэнга М., Лучек К., Мвайко С., Хеслер М., Чепмен Л.Дж. и др. Недавнее симпатрическое видообразование, включающее связанный со средой обитания полиморфизм брачной окраски у цихлид кратерного озера. Гидробиология. 2019; 832: 297–315.
Артикул Google Scholar
Machado-Schiaffino G, Kautt AF, Kusche H, Meyer A. Параллельная эволюция в кратерных озерах Уганды: повторяющаяся эволюция лимнетических форм тела у гаплохромных цихлид. БМС Эвол Биол. 2015;15:9.
ПабМед ПабМед Центральный Статья Google Scholar
McCreesh N, Arinaitwe M, Arineitwe W, Tukahebwa EM, Booth M. Влияние температуры воды и плотности популяции на динамику популяции Schistosoma mansoni улиток промежуточных хозяев.Векторы паразитов. 2014;7:503.
ПабМед ПабМед Центральный Статья Google Scholar
Stensgaard AS, Utzinger J, Vounatsou P, Hürlimann E, Schur N, Saarnak CF, et al. Крупномасштабные детерминанты кишечного шистосомоза и распространения улиток-промежуточных хозяев в Африке: имеет ли значение климат? Acta Trop. 2013; 128:378–90.
ПабМед Статья ПабМед Центральный Google Scholar
Saulnier-Talbot É, Chapman L, Efitre J, Simpson K, Gregory-Eaves I. Долгосрочные гидрологические колебания и динамика первичных продуцентов в тропическом кратерном озере. Фронт Экол Эвол. 2018;6:223.
Артикул Google Scholar
Saulnier-Talbot É, Gregory-Eaves I, Simpson KG, Efitre J, Nowlan TE, Taranu ZE, et al. Небольшие изменения климата могут серьезно изменить динамику и экосистемные услуги тропических кратерных озер.PloS Один. 2014;9:e86561.
ПабМед ПабМед Центральный Статья CAS Google Scholar
Киноти Г. Наблюдения за передачей Schistosoma haematobium и Schistosoma bovis в районе озера Танганьика. Bull World Health Organ. 1964; 31: 815–23.
CAS PubMed ПабМед Центральный Google Scholar
Саутгейт В.Р., Ноулз Р.Дж. Наблюдения за Schistosoma bovis Sonsino, 1876. J Nat Hist. 1975; 9: 273–314.
Артикул Google Scholar
Саутгейт В.Р., Браун Д.С., Роллинсон Д., Росс Г.К., Ноулз Р.Дж. Bulinus tropicus из Центральной Кении, являющийся хозяином для Schistosoma bovis . Z Parasitenkd. 1985; 71: 61–9.
CAS PubMed Статья ПабМед Центральный Google Scholar
Мутани А., Кристенсен Н.О., Франдсен Ф. Исследования взаимоотношений между Schistosoma и их промежуточными хозяевами. V. Род Bulinus и Schistosoma bovis из Иринги, Танзания. Z Parasitenkd. 1983; 69: 483–7.
CAS Статья Google Scholar
Мвамбунгу Дж.А. Передача Schistosoma bovis в Мкулве (район Мбози, регион Мбея, южное высокогорье Танзании).Дж. Гельминтол. 1988; 62: 29–32.
CAS PubMed Статья ПабМед Центральный Google Scholar
De Bont J, Vercruysse J. Эпидемиология и борьба с шистосомозом крупного рогатого скота. Паразитол сегодня. 1997; 13: 255–62.
ПабМед Статья ПабМед Центральный Google Scholar
Huyse T, Webster BL, Geldof S, Stothard JR, Diaw OT, Polman K, et al.Двунаправленная интрогрессивная гибридизация шистосом крупного рогатого скота и человека. PLoS Патог. 2009;5:e1000571.
ПабМед ПабМед Центральный Статья CAS Google Scholar
Леже Э., Вебстер Дж. П. Гибридизации внутри рода Schistosoma : последствия для эволюции, эпидемиологии и контроля. Паразитология. 2017; 144:65–80.
Артикул Google Scholar
Минетти С., Лакурс Э.Дж., Реймер Л., Стотард М.Р. Сосредоточение внимания на подходах молекулярной диагностики и ксеномониторинга на основе нуклеиновых кислот для гельминтозов человека, поддающихся профилактической химиотерапии. Паразитол Опен. 2016;2:e16.
Артикул Google Scholar
Саутгейт В.Р., Ховард Г.В., Роллинсон Д., Браун Д.С., Росс Г.К., Ноулз Р.Дж. Bulinus tropicus , естественный промежуточный хозяин для Schistosoma margrebowiei в национальном парке Лохинвар, Замбия.Дж. Гельминтол. 1985; 59: 153–155.
CAS PubMed Статья Google Scholar
Динник Ю.А., Динник Н.Н. Шистосомы домашних жвачных в Восточной Африке. Bull Epizoot Dis Afr. 1965; 13: 341–59.
CAS PubMed ПабМед Центральный Google Scholar
Graber M, Daynès P. Mollusques vecteurs de trématodoses humanes et animales en Ethiopie.Rev Elev Med Vet Pay. 1974; 27: 307–22.
Артикул Google Scholar
Hira PR. Исследования способности улиток, передающих мочевой шистосомоз, в западной Нигерии выживать в засушливых условиях. West Afr Med J Niger Pract. 1968; 17: 153–60.
CAS PubMed ПабМед Центральный Google Scholar
Локер Э.С., Мойо Х.Г., Гарднер С.Л. Ассоциации трематод и брюхоногих моллюсков в девяти не озерных местообитаниях в районе Мванза в Танзании.Паразитология. 1981; 83: 381–99.
Артикул Google Scholar
Роллинсон Д., Стотхард Дж. Р., Саутгейт В. Р. Взаимодействия между промежуточными хозяевами-улитками рода Bulinus и шистосомами группы Schistosoma haematobium . Паразитология. 2001; 123 (Прил.): S245–60.
ПабМед Статья Google Scholar
Стэндли С.Дж., Мугиша Л., Добсон А.П., Стотард Дж.Р.Зоонозный шистосомоз у нечеловеческих приматов: прошлые, настоящие и будущие действия на стыке человека и дикой природы в Африке. Дж. Гельминтол. 2012; 86: 131–40.
CAS PubMed Статья Google Scholar
Stanton MC, Adriko M, Arinaitwe M, Howell A, Davies J, Allison G, et al. Кишечный шистосомоз в Уганде на большой высоте (> 1400 м): малакологические и эпидемиологические исследования на горе Элгон и в кратерных озерах Форт-Портал выявили необходимость в дополнительной профилактической химиотерапии.Заразить дис бедностью. 2017;6:34.
ПабМед ПабМед Центральный Статья Google Scholar
Akinwale OP, Kane RA, Rollinson D, Stothard JR, Ajayi MB, Akande DO, et al. Молекулярные подходы к идентификации видов Bulinus на юго-западе Нигерии и наблюдения за естественными инфекциями улиток шистосомами. Дж. Гельминтол. 2011; 85: 283–93.
CAS Статья Google Scholar
Аллан Ф., Соуза-Фигейредо Х.С., Эмери А.М., Пауло Р., Миранте С., Себастьян А. и др. Картирование пресноводных улиток на северо-западе Анголы: распространение, идентичность и молекулярное разнообразие важных с медицинской точки зрения таксонов. Векторы паразитов.

 Островная яблоня, Pomacea insularum , выглядит почти идентично.Отверстие в раковине, или отверстие, у обоих видов большое, овальное или круглое. Цвет тела яблочных улиток варьируется от желтого до коричневато-черного, с темными спиральными полосами или без них. Их присутствие часто сначала замечается по наблюдению за их ярко-розовыми массами яиц. Эти яичные массы откладываются на твердые поверхности примерно до 20 дюймов над поверхностью воды. Средняя кладка с желобчатыми яблочными ноготками содержит от 200 до 600 яиц, каждое из которых имеет диаметр от 0,9 до 1,4 мм. Средняя кладка островных яблонь обычно содержит более 500 яиц, что немного меньше, чем у родственных видов.По сравнению с яйцами местных яблочных улиток яйца инвазивных яблочных улиток меньше, розовее и многочисленнее. Яйца вылупляются через одну-две недели, выпуская сотни молодых особей в окружающую среду.
Островная яблоня, Pomacea insularum , выглядит почти идентично.Отверстие в раковине, или отверстие, у обоих видов большое, овальное или круглое. Цвет тела яблочных улиток варьируется от желтого до коричневато-черного, с темными спиральными полосами или без них. Их присутствие часто сначала замечается по наблюдению за их ярко-розовыми массами яиц. Эти яичные массы откладываются на твердые поверхности примерно до 20 дюймов над поверхностью воды. Средняя кладка с желобчатыми яблочными ноготками содержит от 200 до 600 яиц, каждое из которых имеет диаметр от 0,9 до 1,4 мм. Средняя кладка островных яблонь обычно содержит более 500 яиц, что немного меньше, чем у родственных видов.По сравнению с яйцами местных яблочных улиток яйца инвазивных яблочных улиток меньше, розовее и многочисленнее. Яйца вылупляются через одну-две недели, выпуская сотни молодых особей в окружающую среду. Благодаря интродукции человека эта яблочная улитка быстро распространилась в Индонезию, Таиланд, Камбоджу, Гонконг, южный Китай, Японию, Филиппины и Гавайи.Есть признаки того, что они вторгаются в Австралию. В 1980-х годах яблочные гвозди с желобками были завезены на Тайвань, чтобы начать производство улиток. Эта улитка изначально была импортирована под названием «золотая улитка» или «золотая яблочная улитка» для употребления в пищу человеком. Однако азиатский рынок улиток так и не появился, и яблочные гвозди, которые сбежали или были выпущены на свободу, в конечном итоге нанесли значительный ущерб рисовым полям. В Соединенных Штатах яблоневый ноготь был введен для использования в торговле аквариумами, в качестве источника пищи и для биологической борьбы с сорняками.Образцы были собраны в Алабаме, Аризоне и Северной Каролине. Установленные популяции существуют во Флориде, Калифорнии и на Гавайях.
Благодаря интродукции человека эта яблочная улитка быстро распространилась в Индонезию, Таиланд, Камбоджу, Гонконг, южный Китай, Японию, Филиппины и Гавайи.Есть признаки того, что они вторгаются в Австралию. В 1980-х годах яблочные гвозди с желобками были завезены на Тайвань, чтобы начать производство улиток. Эта улитка изначально была импортирована под названием «золотая улитка» или «золотая яблочная улитка» для употребления в пищу человеком. Однако азиатский рынок улиток так и не появился, и яблочные гвозди, которые сбежали или были выпущены на свободу, в конечном итоге нанесли значительный ущерб рисовым полям. В Соединенных Штатах яблоневый ноготь был введен для использования в торговле аквариумами, в качестве источника пищи и для биологической борьбы с сорняками.Образцы были собраны в Алабаме, Аризоне и Северной Каролине. Установленные популяции существуют во Флориде, Калифорнии и на Гавайях. canaliculata , в Соединенных Штатах. Эти два вида почти идентичны по внешнему виду. Однако тестирование ДНК может подтвердить идентификацию вида. Инвазивные островные яблочные улитки были зарегистрированы во Флориде, Джорджии, Алабаме, Техасе и Луизиане.
canaliculata , в Соединенных Штатах. Эти два вида почти идентичны по внешнему виду. Однако тестирование ДНК может подтвердить идентификацию вида. Инвазивные островные яблочные улитки были зарегистрированы во Флориде, Джорджии, Алабаме, Техасе и Луизиане.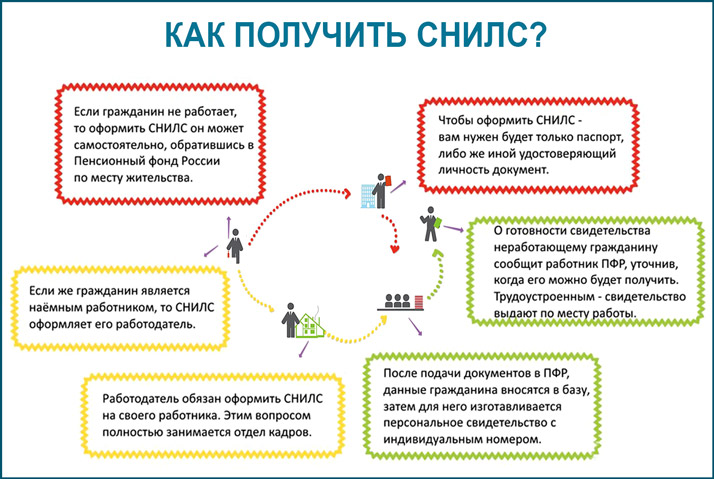 На Филиппинах и в Китае он считается вредителем риса номер один и наносит огромный экономический ущерб. Он был завезен на Гавайи в 1989 году, вероятно, с Филиппин, и по тем же причинам, что и его первоначальный завоз в Юго-Восточную Азию. Опять же, улитки быстро сбежали или были выпущены на свободу и быстро стали основными вредителями. Климатическое моделирование показало, что он может распространяться в незараженных частях мира, например, в огромных рисоводческих районах Индии.Он уже был завезен в США и угрожает основным посевам риса в Техасе и Калифорнии.
На Филиппинах и в Китае он считается вредителем риса номер один и наносит огромный экономический ущерб. Он был завезен на Гавайи в 1989 году, вероятно, с Филиппин, и по тем же причинам, что и его первоначальный завоз в Юго-Восточную Азию. Опять же, улитки быстро сбежали или были выпущены на свободу и быстро стали основными вредителями. Климатическое моделирование показало, что он может распространяться в незараженных частях мира, например, в огромных рисоводческих районах Индии.Он уже был завезен в США и угрожает основным посевам риса в Техасе и Калифорнии. Медный барьер можно использовать для предотвращения вторжения. Этот металл токсичен для улиток, и они не пересекут этот материал. Сообщения о вторжениях должны быть искоренены быстро, пока это еще возможно. После установления эрадикация, вероятно, невозможна. Были опробованы многочисленные меры по борьбе с яблочными гвоздями в сельскохозяйственных условиях. К ним относятся: широкое использование пестицидов с серьезными последствиями для окружающей среды и здоровья человека; биологический контроль, особенно использование рыбы и уток; а также ряд мер культурного и механического контроля.Ни один из них не оказался полностью эффективным, безопасным или экономически жизнеспособным. В районах, где улитки наносят ущерб сельскохозяйственным культурам, агрессивный ручной сбор улиток и использование домашних плотоядных уток сократили популяцию улиток на 95%. Вся растительность и препятствия вокруг полей должны быть максимально удалены, так как это необходимо улиткам для откладывания яиц. Когда нет подходящих мест для откладки яиц, улитки вынуждены откладывать яйца на голую землю, где они уязвимы, и легко падают в воду, которая топит яйца.
Медный барьер можно использовать для предотвращения вторжения. Этот металл токсичен для улиток, и они не пересекут этот материал. Сообщения о вторжениях должны быть искоренены быстро, пока это еще возможно. После установления эрадикация, вероятно, невозможна. Были опробованы многочисленные меры по борьбе с яблочными гвоздями в сельскохозяйственных условиях. К ним относятся: широкое использование пестицидов с серьезными последствиями для окружающей среды и здоровья человека; биологический контроль, особенно использование рыбы и уток; а также ряд мер культурного и механического контроля.Ни один из них не оказался полностью эффективным, безопасным или экономически жизнеспособным. В районах, где улитки наносят ущерб сельскохозяйственным культурам, агрессивный ручной сбор улиток и использование домашних плотоядных уток сократили популяцию улиток на 95%. Вся растительность и препятствия вокруг полей должны быть максимально удалены, так как это необходимо улиткам для откладывания яиц. Когда нет подходящих мест для откладки яиц, улитки вынуждены откладывать яйца на голую землю, где они уязвимы, и легко падают в воду, которая топит яйца.
 Никогда не выбрасывайте живую рыбу, т.е. ведра с наживкой из одного водоема в другой водоем.Всегда сливайте воду из лодки, живите хорошо и слейте воду, прежде чем покинуть любой доступ к воде.
Никогда не выбрасывайте живую рыбу, т.е. ведра с наживкой из одного водоема в другой водоем.Всегда сливайте воду из лодки, живите хорошо и слейте воду, прежде чем покинуть любой доступ к воде.