Сальдо баланса
Сальдо баланса – это понятие, которое обозначает расхождение между зачислением денежных средств и их использованием при установленном промежутке времени. Область применение сальдо довольно распространенная – это бухгалтерский учет, внешнеэкономические отношения с зарубежьем и другие аспекты. Определиться с этим термином можно при помощи бухгалтерского баланса и бухгалтерского счета, а также активности и пассивности (дебета и кредита) счета.
Обозначение сальдо бухгалтерского баланса
В традиционном понимании бухгалтерский баланс есть разницей между начислением на финансовый счет компании и суммой расходов. Он отображает материальные накопления фирмы на тот или другой промежуток времени.
В бухгалтерском учете определяют такие типы баланса:
- Дебетовый. Он формируется в той ситуации, когда дебет перекрывает кредит, и отображается в графе активов;
- Кредитовый. Он имеет смысл тогда, когда кредит перекрывает дебет, и сохраняется в графе пассивов.

Учет требуется вести таким методом, чтобы подсчет сальдового баланса всех накладных на данный момент был равен нулю. Это носит название принципа сохранения, когда конечный результат всего дебета равняется суммарному показателю всего кредита, что разрешает контролировать баланс.
Если учитывать действительную часть оценки учета, то под рассмотрение попадает не вся его хроника, а только лишь промежуток времени, что вызывает интерес. В этом значении выделяются следующие разделы сальдо:
- Исходный баланс;
- Дебет – оборот за период;
- Кредит — оборот на данном этапе времени;
- Сальдо за весь период;
- Конечное сальдо.
Исходное сальдо демонстрирует остающуюся сумму на балансе в минуту начала выполнения операции. Поводом для расчета есть операции, которые проводились раньше.
Основой для расчета дебетового и кредитового дохода является балансовое действие, что проводится в конкретный отрезок времени.
Сальдо за весь период является итогом операций в определенное время.
Исходящее сальдо отображает излишек на счету в конце назначенного времени. В основном конечным результатом есть сложенная сумма первичного баланса и доходов за весь период.
Использование сальдо в счетах бухгалтерского значения
Во время работы производства происходит много разных, связанных с хозяйственной организацией труда, процессов: приходит материал и необходимое сырье, изготавливается и продается продукция, идет начисление и выдача заработной платы. Чтобы верно отобразить в бухучете все эти операции, их определяют в группы по критериях одинакового действия. Для этого применяются бухгалтерские расчеты, что разделяются на: активные, пассивные, а также активно – пассивные.
На активных счетах фиксируется учет средств компании (наличность, оприходование и расход материальных ресурсов).
Активные счета содержат такие показатели:
- Стартовое сальдо всегда является дебетовым и отображает существование средств на начало отчетного периода;
- Дебетовые обороты указывают на приток активов;
- Кредитовые обороты указывают на списание активов;
- Итоговое сальдо всегда есть дебетовым;
- На активных счетах прослеживается наличность и обороты финансового состояния предприятия.

В группу активных основных счетов могут входить: основные средства, финансовые вклады, активы нематериального содержания, валютные счета, материалы, расчетные счета, основное производство, касса и готовая продукция.
На пассивных счетах фиксируется учет происхождение получения материальных накоплений.
Пассивные счета отличаются такими характерными атрибутами: первичное сальдо всегда является кредитовым и указывает величину средств или присутствие гарантий производства на начало отчетного периода, дебетовые обороты отображают списание финансов или гарантий производства, исходное сальдо постоянно является кредитовым и на конец подотчетного периода предоставляет показатели капитала.
К главным пассивным счетам можно отнести такие показатели: прибыли и расходы, калькуляции с подрядчиками и заготовителями, добавочные финансы, расчеты по ссудам и кредитам на короткое время, резервный капитал, расчеты по ссудам и кредитам на длительный срок, уставные финансы, расчеты по начислениях и налогам, выдача заработной платы, а также расчеты по соцобеспечению и страховке.
Итоговая сумма всех статей актива должна быть одинаковой с итоговой суммой всех статей пассива.
Активно-пассивные счета в бухгалтерии
Бухгалтерские счета активно – пассивного признака предназначаются для ведения учета в один и тот же промежуток времени имущества и его истоков пополнения. К основным таким счетам относятся калькуляции с подотчетными работниками, с инвесторами, с разными кредиторами и дебиторами, а также учитываются прибыли и расходы.
Бухгалтерские счета подразделяются на два класса: балансовые и забалансовые счета. Балансовые счета – это счета, на основании которых составляется бухгалтерский баланс, а забалансовые – это остатки.
Сальдо может быть положительным или отрицательным, но оно всегда плюсуется, потому что знак минуса при учете материальных средств не применяется.
При составлении баланса в бухгалтерии как отчета о материальном состоянии организации используется лишь часть информации, которая находится на счетах в виде сальдо, и поэтому баланс носит название «сальдовый».
Сальдо торгового баланса (Trade balance) — Финансовый журнал ForTrader.org
Что такое сальдо торгового баланса?
Сальдо торгового баланса (англ. — trade balance) – торговое сальдо – разница между поступлениями и расходами по внешнеторговым сделкам страны. Положительное сальдо торгового баланса говорит о том, что экспорт из страны превышает импорт. Соответственно, отрицательное сальдо показывает обратное соотношение количества ввозимых и вывозимых товаров.
Простыми словами, сальдо торгового баланса — это разница между экспортом и импортом страны.
Что такое положительное сальдо торгового баланса?
Положительное торговое сальдо характеризуется преобладанием экспорта товаров и услуг над импортом и является показателем высокого уровня спроса на товары страны на мировом рынке, а также иногда о переизбытке производимого товара.
Что такое отрицательное сальдо торгового баланса?
Отрицательный торговый баланс свидетельствует о широком потреблении иностранных товаров.
Принято считать, что положительное сальдо лучше отрицательного, т.к. в этом случае поддерживается местный производитель, а значит и экономика страны. О слаборазвитой и неконкурентоспособной экономике может говорить именно отрицательный баланс внешних торговых операций. Чаще всего эта ситуация приводит к обесцениванию национальной валюты (девальвации), что случается в результате отсутствия способности расплачиваться по импортным сделкам.
Но у этого явления есть и положительная сторона, а именно возможность сдерживания инфляции и поддержка высокого уровня жизни. Таким примером могут служить Соединенные Штаты Америки и Великобритания.
Отрицательное торговое сальдо также называют дефицитом торгового баланса.
Зачем торговый баланс нужен трейдеру на финансовых рынках?
Индикатор торгового баланса является одним из немногих показателей, который способен оказывать не косвенное, а непосредственное, прямое влияние на колебания курса национальной валюты. Это объясняется следующим образом: сальдо торгового баланса отражает постоянное движение финансовых ресурсов между странами-партнерами, связанное с предоставлением определенных товаров и услуг согласно договору.
Это объясняется следующим образом: сальдо торгового баланса отражает постоянное движение финансовых ресурсов между странами-партнерами, связанное с предоставлением определенных товаров и услуг согласно договору.
Стоит отметить существование одного парадокса, который заключается в том, что реакция курса национальной валюты на отчет по торговому балансу является минимальной, а все из-за структурных и технических причин. То есть отчет характеризуется неким запозданием. Причиной этому служит время, необходимое на его подготовку и оформление. Поэтому динамика курса очень редко отражает истинный поток ценностей и материальных ресурсов между торговыми партнерами.
Полезные статьи по теме
Как считать сальдо конечное по дебету и кредиту в 2019 году
Существует специфика его нахождения по показателю пассивности или активности счета. Поэтому мы рассмотрим два варианта.
Счета активного порядка отражают изменение хоз. средств, имеют дебетовое сальдо (начальное и конечное). Их оборот по дебету – обычно отображение входящих сумм, кредитовые – выбывших.
Их оборот по дебету – обычно отображение входящих сумм, кредитовые – выбывших.
Формула расчета сальдо конечное выглядит так.
Сконеч. = Снач. + Деб. Обор. — Кред. Обор.
Запись на счетах начинают с указания начального остатка (сальдо). Затем на счетах отражают все операции, вызывающие изменения начальных остатков. Суммы, увеличивающие начальный остаток записывают на стороне остатка, а суммы, уменьшающие начальный остаток, — па противоположной стороне. Если сложить суммы всех операций, записанных на стороне счета, то получаются обороты счета, Итоговая сумма, записанная по дебету счета, называется дебетовым оборотом, а по кредиту счета — кредитовым. При подсчете оборотов начальный остаток не учитывается. Конечный остаток записывают на той же стороне, где начальный остаток.
На активных бухгалтерских счетах ведется учет движения активов предприятия, т.е. наличия, поступления и выбытия хозяйственных средств. Схема активного счета
Сальдо начальное — остаток (наличие) хозяйственных средств на начало отчетного периода
Оборот по дебету — сумма хозяйственных операций, вызывающих увеличение хозяйственных средств, в течение отчетного периода
Оборот по кредиту — сумма хозяйственных операций, вызывающих уменьшение хозяйственных средств, в течение отчетного периода
Сальдо конечное — остаток хозяйственных средств на конец отчетного периода
На пассивных бухгалтерских счетах ведется учет источников образования хозяйственных средств. По аналогии с активными счетами можно сказать, что на пассивных счетах ведется учет движения пассивов предприятия. К основным пассивам или источникам образования хозяйственных средств относятся все виды капитала, прибыли и обязательств предприятия.
По аналогии с активными счетами можно сказать, что на пассивных счетах ведется учет движения пассивов предприятия. К основным пассивам или источникам образования хозяйственных средств относятся все виды капитала, прибыли и обязательств предприятия.
Схема пассивного счета
Сальдо начальное — остаток источников образования хозяйственных средств на начало отчетного периода
Оборот по дебету — сумма хозяйственных операций, вызывающих уменьшение источников образования хозяйственных средств, в течение отчетного периода
Оборот по кредиту — сумма хозяйственных операций, вызывающих увеличение источников образования хозяйственных средств, в течение отчетного периода
Сальдо конечное — остаток источников образования хозяйственных средств на конец отчетного периода
Активные счета имеют следующие особенности:
на них отражается наличие и движение хозяйственных средств и имущества предприятия;
сальдо начальное всегда дебетовое и показывает наличие средств на начало отчетного периода;
обороты по дебету отражают получение средств;
обороты по кредиту показывают выбытие средств;
сальдо конечное всегда дебетовое и показывает остаток средств на конец отчетного периода.
Сальдо конечное рассчитывается по формуле:
Пассивные счета имеют также особенности:
на пассивных счетах ведется учет источников образования хозяйственных средств предприятия, т.е. капитала и обязательств (задолженности) ;
сальдо начальное всегда кредитовое и показывает величину капитала или наличие обязательств предприятия на начало отчетного периода;
обороты по дебету показывают уменьшение капитала или обязательств;
обороты по кредиту показывают увеличение капитала или обязательств;
сальдо конечное всегда кредитовое и показывает величину капитала или обязательств предприятия на конец отчетного периода.
Сальдо конечное рассчитывается по следующей формуле:
Существуют также активно-пассивные счета, которые в основном предназначены для учета обязательств (расчетов с разными юридическими и физическими лицами), а также для выявления финансовых результатов.
При вычислении конечного сальдо можно вовсе не обращать внимание на то, является ли счет активным, пассивным или активно-пассивным. Для этого достаточно пользоваться универсальной формулой расчета сальдо, применимой к любому счету:
Для этого достаточно пользоваться универсальной формулой расчета сальдо, применимой к любому счету:
Проиллюстрируем это на следующем примере. Допустим, что организация взаимодействует с пятью поставщиками. На начало и конец месяца состояние расчетов с ними представлено в табл. 5.6, которая составляет фрагмент аналитического учета.
Что такое сальдо в бухгалтерии
Содержание статьи:
В бухгалтерии существует такое достаточно распространенное и повсеместно встречающееся понятие, как сальдо (остаток). Им называют всю ту разницу, которая возникает по счету (аккредитиву) между дебетом и кредитом. То есть, зная дебет счета и кредит по нему и рассчитав разницу между ними, можно получить не что иное, как сальдо. Другими словами, этим понятием характеризуется движение средств — их расходование и поступление, но в течение определенного временного интервала.
Другими словами, этим понятием характеризуется движение средств — их расходование и поступление, но в течение определенного временного интервала.
Различия между дебетом и кредитом
Деятельность любого предприятия не представляется осуществимой без текущих доходов и расходов. И обе эти части баланса тесно взаимосвязаны и являются составными элементами любой статьи бюджета. И понимание тонкой грани между ними — первостепенная задача как руководителя организации, так и начальника финансового отдела.
Естественно, выйти в ноль удается достаточно редко, и с определенной вероятностью любая строка бухгалтерского баланса будет содержать значение, отличное от нуля. Иначе говоря, разницу между столбцами дебета и кредита, характеризующих двойную запись любой аналитики.
Учитывая то, что две основные составляющие сальдо — это обороты по дебету и кредиту, его разделяют две формы:
- Дебетовое — это такое сальдо, которое рассчитывается по аккредитивам с дебетовым оборотом, превышающем кредитовый.
 То есть, если организация в прошедшем периоде выступала больше в качестве кредитора, то разница между показаниями столбцов «отдал-получил» будет именно такой.
То есть, если организация в прошедшем периоде выступала больше в качестве кредитора, то разница между показаниями столбцов «отдал-получил» будет именно такой. - Кредитовое — это такое сальдо, которое возникает в том случае, если оборот по кредитовым операциям превышает дебетовые операции. Если предприятие принимало товары (услуги) от сторонних дебиторов, то, естественно, и разница будет кредитовой.
Существует также и развернутое сальдо, которое может возникнуть на определенном типе счетов, подробнее об этом поговорим чуть ниже. Заведомо надо уточнить, что каждое предприятие может проводить не только однотипные операции, но и работать в двухстороннем порядке — и отдавать финансовые средства, и получать их.
Например, различные расчеты с дебиторами могут осуществляться как в пользу предприятия, так и в пользу контрагентов. Поэтому по одной и той же строке сальдовый показатель может быть как отрицательным числом, так и положительным.
Определение остатков
Определение итога — задача не такая уж и сложная. Для максимального понимания процедуры расчета распишем каждый шаг подробно. Потребуются лишь элементарные знания математических операций и калькулятор — составляющие, которые есть в любой бухгалтерии и у любого ее работника.
Для максимального понимания процедуры расчета распишем каждый шаг подробно. Потребуются лишь элементарные знания математических операций и калькулятор — составляющие, которые есть в любой бухгалтерии и у любого ее работника.
В первую очередь от бухгалтера требуется выполнение такой работы, как формирование оборотно-сальдовой ведомости, в которую будут записаны все счетные операции по любой строке баланса. Ее структура напоминает двойную запись с той лишь разницей, что рядом с каждой составляющей добавляется специальный столбец, в котором и будет указываться найденное значение.
Составлять таблицу необходимо в каждом отчетном периоде. Делается это для того, чтобы еще раз проконтролировать работу отдела и получить достоверную информацию о состоянии бухгалтерского баланса.
Определение типа счета
В первую очередь бухгалтер должен определиться с видом счета, разницу по которому нужно рассчитать. Они могут быть трех видов — активные, пассивные и смешанные активно-пассивные.
Активные — это все виды статей бухгалтерского баланса, связанные с имуществом организации (например, «Касса», «Материалы», «Основные средства», «Материалы»). Отличительной особенностью активных счетов является то, что любое поступление финансовых средств на них относится к дебету, а выбытие записывается на кредитовую сторону.
Пассивные — это те виды статей баланса, которые отражают источники формирования имущества организации (например, «Расчеты с персоналом», «Резервный капитал» и другие). Для пассивных счетов характерна запись поступления денежных средств на кредит, а их выбытия — в противоположную сторону.
Активно-пассивные включают в себя как сведения об имуществе, так и информацию о способах его формирования. «Расчеты с дебиторами и кредиторами», «Прибыли и убытки» являются примерами активно-пассивных счетов.
[goo_mid]
Непосредственный расчет
- Активный счет
В этом случае такое сальдо — это не что иное, как дебетовые остатки и обороты по аккредитиву без учета всех кредитовых оборотов (то есть, находится сумма по столбцу «Дебет» и вычитается сумма по столбцу «Кредит»). Остаток по таким счетам в бухгалтерии всегда будет дебетовым, и его записывают в столбец, перечисляющий соответствующие операции.
Остаток по таким счетам в бухгалтерии всегда будет дебетовым, и его записывают в столбец, перечисляющий соответствующие операции.
Расчет осуществляется идентично. Берутся все кредитные обороты и остатки без учета дебетовых оборотов. То есть, сумма кредита уменьшается на сумму дебета, и результатом становится остаток. Такое сальдо всегда кредитовое. Запись его осуществляется именно в столбец, фиксирующий соответствующие операции.
- Активно-пассивный
В этом случае расчет сальдо несколько сложнее, чем в описанных предыдущих случаях. Так как активно-пассивные счета в бухгалтерии могут быть как с односторонним остатком (либо дебетовым, либо кредитовым), так и с двусторонним.
Формула вычисления однотипна и повторяет расчет для актива. То есть из суммы дебета счета вычитается сумма кредита по тому же счету, и разница будет являться искомой. Но в этом случае сальдо может быть как положительной величиной, так и отрицательной.
Если в результате расчета получается положительное значение, то можно говорить о дебетовом сальдо и записать его в соответствующий столбец. Если остаток получается отрицательным, то такое значение надо записать на кредитовую сторону счета.
Если остаток получается отрицательным, то такое значение надо записать на кредитовую сторону счета.
Такой вариант расчета подходит лишь в тех случаях, когда заведомо известно, в какую сторону аккредитив ориентирован больше: в дебетовую или кредитовую. То есть, если организация выступает в роли кредитора, и на счету отражаются в основном операции с кредиторами, то и остаток будет дебетовым, а сам аккредитив активным. Если же наоборот, то такое сальто будет дебетовым, а аккредитив пассивным.
- Активно-пассивный с развернутым остатком
Что делать в том случае, если роль организации двояка, и на одном и том же аккредитиве могут отражаться операции обоих типов? В помощь бухгалтеру придет начальное сальдо, которое перешло с прошлого периода. К этой цифре прибавляется сумма значений того столбца, какого типа была перенесенная разница.
Далее из полученного значения отнимают сумму другого столбца, незатронутого в расчетах (кредитовый оборот или дебетовый). Полученный результат — конечный остаток — записывается в столбец по уже знакомому правилу знака перед цифрой (положительное число — в дебет, отрицательное — в кредит).
Если же начальную разницу дебета-кредита, перешедшую с прошлого периода, определить возможности нет, то конечная записывается в тот столбец, в котором месячный оборот больше.
Важность заполнения ведомости
Ведение оборотно-сальдовой ведомости в бухгалтерии практически также полезно, как и журналов-ордеров, Главной книги и записей в автоматизированных программах. Результаты, которые она отражает, помогают работникам бухгалтерии еще раз оценить качество проведенной работы в отчетном периоде и сравнить найденные значения с показаниями в других бухгалтерских ведомостях. Можно сказать, что расчет остатка по аккредитиву — это еще один важный и обязательный момент в составлении бухгалтерского баланса.
Понимание различия дебета и кредита — это залог правильного формирования ведомости и бухгалтерского баланса в текущем периоде. Без этих сведений невозможно перенести работу прошлого этапа на нынешний и продолжить ее выполнение. Кроме того, осознание величины этих показателей и их принадлежность к дебету или кредиту, позволяет грамотно анализировать эффективность работы организации, внедрение различных планов, осуществление текущих и прошедших задач.
Понравилась статья? Поделитесь ей в соцсетях
Сальдо. Положительное, отрицательное сальдо торгового, внешней торговли
31.03.2021
10397
Автор: Редакция Myfin.byФото: pixabay.com
Для различных экономических сфер сальдо – это разница между общей суммой поступивших и израсходованных за определенный промежуток времени денежных средств. С точки зрения бухгалтерского баланса, сальдо представляет собой разность между записями по дебету и кредиту счетов. В международных же отношениях определяют сальдо торгового баланса – величину превышения экспорта над импортом либо наоборот в стоимостном выражении. Данный показатель является одной из важнейших характеристик внешнеторговой деятельности государства.
Баланс внешней торговли
Выводы о деятельности той или иной страны на международном рынке делаются на основании внешнеторгового баланса, т.е. разницы между поступлениями денежных средств из-за границы благодаря экспорту и перечислением валюты за рубеж в счет оплаты импорта. Таким образом, возникают понятия положительного (экспорт больше импорта) и отрицательного (импорт превышает экспорт) сальдо внешней торговли. Положительное сальдо характеризует активный торговый баланс страны, в то время как отрицательное свидетельствует о возникновении пассивного баланса.
Таким образом, возникают понятия положительного (экспорт больше импорта) и отрицательного (импорт превышает экспорт) сальдо внешней торговли. Положительное сальдо характеризует активный торговый баланс страны, в то время как отрицательное свидетельствует о возникновении пассивного баланса.
Сальдо внешней торговли Республики Беларусь
Стоит отметить, что в Беларуси чаще наблюдается отрицательное сальдо торгового баланса: с 2000 по 2014 годы, активный торговый баланс отмечался лишь два раза (в 2005 – 342 млн. USD, в 2012 – 3,024 млрд. USD). Однако 2015 год также оказался успешным для белорусской внешнеэкономической деятельности – сальдо торговли товарами и услугами оказалось положительным и составило 206 млн. USD. Но данная ситуация сложилась лишь благодаря торговле услугами, т.к. сальдо внешней торговли товарами было отрицательным, как и все последние 15 лет, за исключением 2012 года.
В 2015 году дефицит внешнеторгового баланса по товарам несколько сократился по отношению к 2014 году, однако значительно уменьшились и общие обороты экспорта и импорта товаров. В то же время наблюдается стабильное положительное сальдо в отношении торговли услугами. В частности, в 2015 году импорт услуг сократился на 24,2%, а экспорт – лишь на 15,4%. Это и позволило прийти к положительному сальдо торгового баланса.
В то же время наблюдается стабильное положительное сальдо в отношении торговли услугами. В частности, в 2015 году импорт услуг сократился на 24,2%, а экспорт – лишь на 15,4%. Это и позволило прийти к положительному сальдо торгового баланса.
Отрицательное сальдо внешней торговли товарами и услугами по итогам 2016 года составило $49,8 млн. По внешней торговле товарами отмечается отрицательное сальдо на уровне 2,592 миллиардов долларов США. Сальдо внешнеторгового оборота услугами выросло на 12,5% по итогам года. Положительное сальдо внешней торговли услугами за 2016 год сложилось на уровне $2,543 млрд.
Начиная с 2017 года, сальдо внешней торговли товарами и услугами Беларуси, прогнозируется устойчиво положительным.
По итогам 2018 года объем внешней торговли товарами и услугами (по методологии платежного баланса) составил 83,3 миллиарда долларов и по сравнению с 2017 годом. Рост составил 10,5 миллиардов долларов (на 14,4%).
За 2020 год сальдо внешней торговли товарами и услугами улучшилось по сравнению с 2019 годом на 2,3 млрд. долларов до 1,9 млрд. долларов.
долларов до 1,9 млрд. долларов.
Показатели внешней торговли Республики Беларусь товарами и услугами по итогам 2020 г. (млн. долларов США) по данным Нацбанка:
| Показатели | 2020 год |
| Экспорт товаров и услуг | 37 041,9 |
| к аналогичному периоду предыдущего года, % | 88,2% |
| Импорт товаров и услуг | 35 160,2 |
| к аналогичному периоду предыдущего года, % | 83,0% |
| Сальдо товаров и услуг | 1 881,7 |
| Экспорт товаров (в ценах ФОБ) | 28 256,9 |
| к аналогичному периоду предыдущего года, % | 87,4% |
| Импорт товаров (в ценах ФОБ) | 30 225,7 |
| к аналогичному периоду предыдущего года, % | 82,8% |
| Сальдо товаров | -1 968,8 |
| Экспорт услуг | 8 785,0 |
| к аналогичному периоду предыдущего года, % | 91,1% |
| Импорт услуг | 4 934,5 |
| к аналогичному периоду предыдущего года, % | 84,3% |
| Сальдо услуг | 3 850,5 |
Таким образом, для Республики Беларусь характерно превышение импорта товаров над экспортом и экспорта услуг над импортом.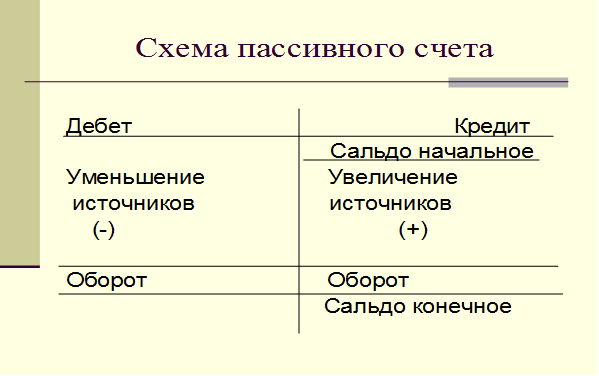 Для изменения первой и поддержания второй тенденций проводятся государственные программы импортозамещения и поддержки экспортоориентированных и наукоемких производств. К тому же, наращивание объема экспорта услуг позволяет стабилизировать внешнеторговый баланс и выходить на положительное сальдо.
Для изменения первой и поддержания второй тенденций проводятся государственные программы импортозамещения и поддержки экспортоориентированных и наукоемких производств. К тому же, наращивание объема экспорта услуг позволяет стабилизировать внешнеторговый баланс и выходить на положительное сальдо.
Внешняя торговля товарами Республики Беларусь за 2016-2020 года (млн. долларов США) по данным Белстат:
| Показатели | 2016 г. | 2017 г. | 2018 г. | 2019 г. | 2020 г. |
| Оборот внешней торговли товарами Республики Беларусь | 51 148 | 63 475 | 72 348 | 72 432 | 61 660 |
| экспорт | 23 538 | 29 240 | 33 907 | 32 955 | 29 041 |
| импорт | 27 610 | 34 235 | 38 441 | 39 477 | 32 619 |
| сальдо | -4 072 | -4 995 | -4 534 | -6 522 | -3 578 |
| со странами СНГ | 31 194 | 38 564 | 43 062 | 43 437 | 36 140 |
| экспорт | 14 648 | 17 493 | 18 762 | 19 376 | 17 843 |
| импорт | 16 546 | 21 071 | 24 300 | 24 061 | 18 297 |
| сальдо | -1 898 | -3 578 | -5 538 | -4 685 | -454 |
| из них с Российской Федерацией | 26 255 | 32 497 | 35 605 | 35 703 | 29 519 |
| экспорт | 10 948 | 12 898 | 12 986 | 13 686 | 13 132 |
| импорт | 15 307 | 19 599 | 22 619 | 22 017 | 16 387 |
| сальдо | -4 359 | -6 701 | -9 633 | -8 331 | -3 255 |
| со странами вне СНГ | 19 954 | 24 911 | 29 286 | 28 995 | 25 520 |
| экспорт | 8 890 | 11 747 | 15 145 | 13 579 | 11 198 |
| импорт | 11 064 | 13 164 | 14 141 | 15 416 | 14 322 |
| сальдо | -2 174 | -1 417 | 1 004 | -1 837 | -3 124 |
Показатели внешней торговли товарами и услугами (млн. долларов США) Республики Беларусь за 2021 год по месяцам:
долларов США) Республики Беларусь за 2021 год по месяцам:
| Показатели | год | январь |
| Экспорт товаров и услуг | 2020 | 2 693,9 |
| 2021 | 3 057,1 | |
| Импорт товаров и услуг | 2020 | 2 432,1 |
| 2021 | 2 631,7 | |
| Сальдо товаров и услуг | 2020 | 261,8 |
| 2021 | 425,4 | |
| Экспорт товаров (в ценах ФОБ) | 2020 | 1 982,4 |
| 2021 | 2 367,2 | |
| Импорт товаров (в ценах ФОБ) | 2020 | 2 043,6 |
| 2021 | 2 267,0 | |
| Сальдо товаров | 2020 | -61,2 |
| 2021 | 100,2 | |
| Экспорт услуг | 2020 | 711,5 |
| 2021 | 689,9 | |
| Импорт услуг | 2020 | 388,5 |
| 2021 | 364,7 | |
| Сальдо услуг | 2020 | 323,0 |
| 2021 | 325,2 |
Если вы заметили ошибку в тексте новости, пожалуйста, выделите её и нажмите Ctrl+Enter
ВНЕШНЕТОРГОВОЕ САЛЬДО — это.
 .. Что такое ВНЕШНЕТОРГОВОЕ САЛЬДО?
.. Что такое ВНЕШНЕТОРГОВОЕ САЛЬДО?- ВНЕШНЕТОРГОВОЕ САЛЬДО
- — разность между экспортом и импортом данной страны в стоимостном выражении. Превышение экспорта над импортом называется положительным сальдо, а импорта над экспортом — отрицательным сальдо.
Экономика и право: словарь-справочник. — М.: Вуз и школа. Л. П. Кураков, В. Л. Кураков, А. Л. Кураков. 2004.
- ВНЕШНЕТОРГОВОЕ ОБЪЕДИНЕНИЕ, ВТО
- ВНЕШНЕТОРГОВОЙ ДЕЯТЕЛЬНОСТИ РОССИЙСКИЕ УЧАСТНИКИ
Смотреть что такое «ВНЕШНЕТОРГОВОЕ САЛЬДО» в других словарях:
ВНЕШНЕТОРГОВОЕ САЛЬДО — разность между экспортом и импортом данной страны в стоимостном выражении. Превышение экспорта над импортом называется положительным сальдо, а импорта над экспортом отрицательным сальдо … Юридическая энциклопедия
ВНЕШНЕТОРГОВОЕ САЛЬДО — См.
 САЛЬДО ВНЕШНЕЙ ТОРГОВЛИ Словарь бизнес терминов. Академик.ру. 2001 … Словарь бизнес-терминов
САЛЬДО ВНЕШНЕЙ ТОРГОВЛИ Словарь бизнес терминов. Академик.ру. 2001 … Словарь бизнес-терминовСальдо внешней торговли — разность между экспортом и импортом страны в стоимостном выражении. По английски: Balance of foreign trade Синонимы: Внешнеторговое сальдо, Сальдо внешнеторгового баланса Синонимы английские: External balance, Export import balance См. также:… … Финансовый словарь
САЛЬДО ВНЕШНЕЙ ТОРГОВЛИ — ВНЕШНЕТОРГОВОЕ САЛЬДО … Юридическая энциклопедия
САЛЬДО ВНЕШНЕЙ ТОРГОВЛИ — (см. ВНЕШНЕТОРГОВОЕ САЛЬДО) … Энциклопедический словарь экономики и права
САЛЬДО — (итал., этим. см. сальдировать). Остаток, подлежащий уплате по заключении счетов; состояние счета. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. САЛЬДО [ит. saldo расчет, остаток] экон. во внешней торговле:… … Словарь иностранных слов русского языка
САЛЬДО, ВНЕШНЕТОРГОВОЕ — см.
 САЛЬДО ВНЕШНЕЙ ТОРГОВЛИ … Большой экономический словарь
САЛЬДО ВНЕШНЕЙ ТОРГОВЛИ … Большой экономический словарьТорговый баланс — (Trade balance) Торговый баланс это экономический показатель, отражающий соотношение между экспортом и импортом страны Торговый баланс страны, активный и пассивный торговый баланс, сальдо торгового баланса, роль торгового баланса в экономике… … Энциклопедия инвестора
Дефицит — (Deficit) Термин, означающий недостачу, недостаточность Превышение объёма импорта над объёмом экспорта; недостаток, нехватка чего либо Содержание Содержание Определение Товарный Дефицит в СССР Внутренние источники Внешние источники Требования к… … Энциклопедия инвестора
Финансовый кризис 2011 года в Беларуси — Финансовый (экономический) кризис 2011 года в Республике Беларусь комплекс явлений в экономике страны, вызванный многолетним отрицательным сальдо торгового баланса и издержками элементов административно командной системы в экономике, и… … Википедия
Сальдо начальное — Энциклопедия по экономике
Все данные синтетических счетов за отчетный период обобщаются в оборотной ведомости по синтетическим счетам, называемой оборотным балансом. В этой ведомости сумма сальдо начального по дебету всех счетов равна сумме начального кредитового сальдо всех счетов. Сумма оборотов счетов по дебету равна сумме кредитовых оборотов по счетам. Конечное дебетовое сальдо равно кредитовому. Три пары равных итогов в оборотном балансе позволяют убедиться в правильности регистрации подсчета оборотов и сальдо по всем счетам.
[c.47]
В этой ведомости сумма сальдо начального по дебету всех счетов равна сумме начального кредитового сальдо всех счетов. Сумма оборотов счетов по дебету равна сумме кредитовых оборотов по счетам. Конечное дебетовое сальдо равно кредитовому. Три пары равных итогов в оборотном балансе позволяют убедиться в правильности регистрации подсчета оборотов и сальдо по всем счетам.
[c.47]Величина объекта учета на конец периода — конечное сальдо (конечный остаток) — определяется путем прибавления к начальному сальдо оборота по той же стороне счета и вычитания из полученной суммы оборота по противоположной стороне счета. Конечный остаток записывается по той же стороне счета, где начальный остаток. Таким образом, для получения конечного сальдо по активным счетам к начальному сальдо прибавляют оборот по дебету и вычитают оборот по кредиту. Итог— конечное сальдо — записывается по дебету счета, или он может отсутствовать. Кредитового сальдо (начального и конечного) по активным счетам быть не может это означало бы, что объект учета меньше нуля. На пассивных счетах для определения конечного сальдо к начальному
[c.468]
На пассивных счетах для определения конечного сальдо к начальному
[c.468]
В последующем будем применять следующие условные обозначения Сн — сальдо начальное Ск — сальдо конечное Од -оборот дебетовый Ок — оборот кредитовый. [c.20]
Все факты хозяйственной жизни организации отражаются на бухгалтерских счетах. По окончании отчетного периода по каждому счету подсчитываются обороты (итоги уменьшения и увеличения средств или источников) за данный период и сальдо на конец отчетного периода. На основании этих сальдо и составляется заключительный баланс. Баланс в бухгалтерском смысле — это свод сальдо счетов (активных счетов — в активе, а пассивных — в пассиве баланса). Конечное сальдо по счету выводится по формуле конечное сальдо = начальное сальдо + увеличение — уменьшение. Следовательно, достоверность конечного сальдо, а значит и балансовых показателей, зависит от точности трех слагаемых вышеуказанной формулы. [c.30]
Сальдо начальное отсутствует [c.305]
Сальдо начальное, явно выраженное
[c. 305]
305]
В разделе 12.1 установлено, что счета активов имеют сальдо (начальное и конечное) по дебету, а на счетах капитала и пассивов сальдо находится по кредиту. На счетах доходов и расходов, [c.310]
Сальдо начальное (СНД) Сальдо начальное (СНК) [c.312]
Сальдо начальное включается в оборот [c.319]
Наименование счета Сальдо начальное Обороты Сальдо конечное [c.503]
По горизонтали и вертикали шахматного баланса записываются номера счетов Главной книги предприятия. Затем из журнала регистрации хозяйственных операций в матрицу в соответствии с корреспонденцией счетов переносятся суммы, которые отражаются на пересечении соответствующих строки и столбца. По строке собираются дебетовые обороты, а в столбце — кредитовые. Подсчитав итоги оборотов, определяют сальдо конечное дебетовое записывают по строке, а кредитовое — по столбцу. В правом нижнем углу матрицы отражаются итоговые суммы оборотов и сальдо начальное и конечное. [c.507]
САЛЬДО НАЧАЛЬНОЕ ДЕБЕТОВОЕ
[c. 174]
174]
САЛЬДО НАЧАЛЬНОЕ КРЕДИТОВОЕ ОБОРОТ ПО ДЕБЕТУ (-) ОБОРОТ ПО КРЕДИТУ (+) [c.174]
Графа 3 На начало отчетного периода = САЛЬДО НАЧАЛЬНОЕ ДЕБЕТОВОЕ (04) — САЛЬДО НАЧАЛЬНОЕ КРЕДИТОВОЕ (05). [c.174]
Графа 3 На начало отчетного периода = САЛЬДО НАЧАЛЬНОЕ ДЕБЕТОВОЕ (07) + САЛЬДО НАЧАЛЬНОЕ ДЕБЕТОВОЕ (08) + САЛЬДО НАЧАЛЬНОЕ ДЕБЕТОВОЕ (16) + САЛЬДО НАЧАЛЬНОЕ ДЕБЕТОВОЕ (61). [c.176]
Графа 3 На начало отчетного периода = САЛЬДО НАЧАЛЬНОЕ ДЕБЕТОВОЕ (06). [c.178]
Графа 3 На начало отчетного периода = САЛЬДО НАЧАЛЬНОЕ ДЕБЕТОВОЕ (20) + САЛЬДО НАЧАЛЬНОЕ ДЕБЕТОВОЕ (21) + САЛЬДО НАЧАЛЬНОЕ ДЕБЕТОВОЕ (23) + САЛЬДО НАЧАЛЬНОЕ ДЕБЕТОВОЕ (29) + САЛЬДО НАЧАЛЬНОЕ ДЕБЕТОВОЕ (30) + САЛЬДО НАЧАЛЬНОЕ ДЕБЕТОВОЕ (36) + + САЛЬДО НАЧАЛЬНОЕ ДЕБЕТОВОЕ (44). [c.181]
7.4: Как написать сбалансированные химические уравнения
- Последнее обновление
- Сохранить как PDF
- Коэффициенты и индексы
- Уравновешивание химического уравнения
- Резюме
- Словарь
- Вклад и авторство
Цели обучения
- Объясните роль индексов и коэффициентов в химических уравнениях.

- Уравновесить химическое уравнение при заданном несбалансированном уравнении.
- Объясните роль Закона сохранения массы в химической реакции.
Несмотря на то, что химические соединения распадаются и в ходе химической реакции образуются новые соединения, атомы в реагентах не исчезают, и новые атомы не образуют продукты. В химических реакциях атомы никогда не создаются и не разрушаются. Те же атомы, которые присутствовали в реагентах, присутствуют в продуктах — они просто реорганизованы в разные структуры.В полном химическом уравнении две стороны уравнения должны присутствовать на сторонах реагента и продукта.
Коэффициенты и индексы
В химических уравнениях встречаются числа двух типов. Есть индексы, которые входят в химические формулы реагентов и продуктов; и есть коэффициенты, которые помещаются перед формулами, чтобы указать, сколько молекул этого вещества используется или производится.
Рисунок \ (\ PageIndex {1} \): Уравнения балансировки. Вы не можете изменить индексы в химической формуле, чтобы сбалансировать химическое уравнение; вы можете изменить только коэффициенты. Изменение индексов изменяет соотношение атомов в молекуле и получаемые в результате химические свойства. Например, вода (H 2 O) и перекись водорода (H 2 O 2 ) являются химически разными веществами. H 2 O 2 разлагается на газ H 2 O и газ O 2 при контакте с металлической платиной, тогда как между водой и платиной такая реакция не происходит.
Вы не можете изменить индексы в химической формуле, чтобы сбалансировать химическое уравнение; вы можете изменить только коэффициенты. Изменение индексов изменяет соотношение атомов в молекуле и получаемые в результате химические свойства. Например, вода (H 2 O) и перекись водорода (H 2 O 2 ) являются химически разными веществами. H 2 O 2 разлагается на газ H 2 O и газ O 2 при контакте с металлической платиной, тогда как между водой и платиной такая реакция не происходит. Нижние индексы являются частью формул, и после определения формул для реагентов и продуктов нижние индексы не могут быть изменены. Коэффициенты указывают количество каждого вещества, участвующего в реакции, и могут быть изменены, чтобы сбалансировать уравнение. Приведенное выше уравнение показывает, что один моль твердой меди реагирует с двумя молями водного нитрата серебра с образованием одного моля водного нитрата меди (II) и двух атомов твердого серебра.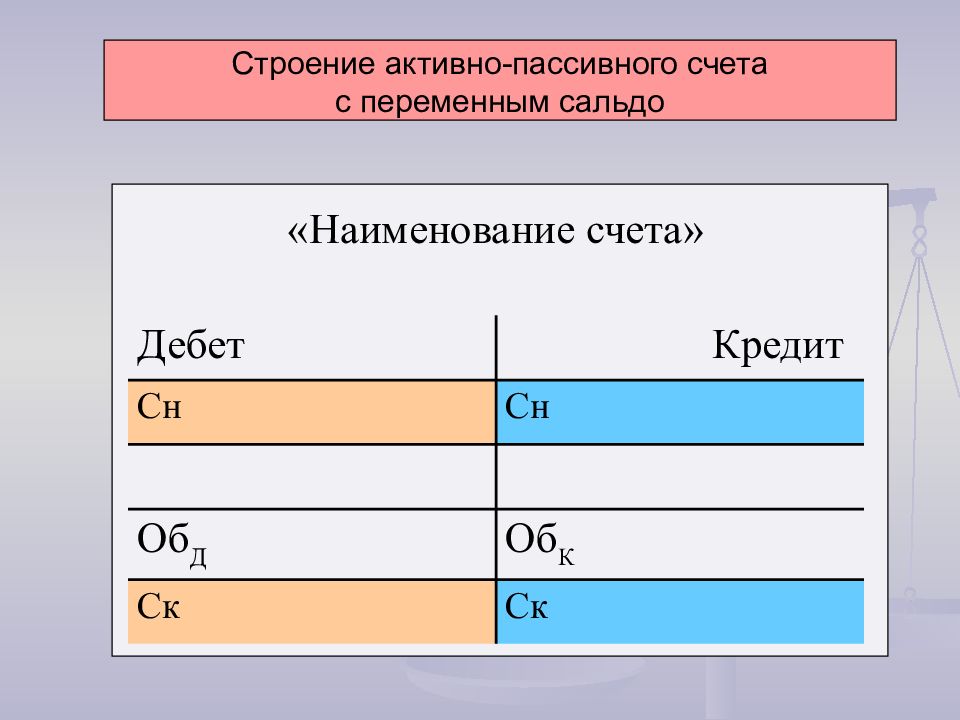
Уравновешивание химического уравнения
Поскольку идентичность реагентов и продуктов фиксирована, уравнение не может быть сбалансировано путем изменения индексов реагентов или продуктов. Это изменит химическую идентичность описываемых видов, как показано на рисунке \ (\ PageIndex {1} \).
Самым простым и наиболее полезным методом уравновешивания химических уравнений является «проверка», более известная как метод проб и ошибок. Ниже приводится эффективный подход к уравновешиванию химического уравнения с использованием этого метода.
Шаги по уравновешиванию химического уравнения
- Определите наиболее сложное вещество.
- Начиная с этого вещества, выберите элемент (ы), который присутствует только в одном реагенте и одном продукте, если это возможно. Отрегулируйте коэффициенты, чтобы получить одинаковое количество атомов этого элемента (ов) с обеих сторон.
- Уравновешивает многоатомные ионы (если они присутствуют в обеих частях химического уравнения) как единое целое.

- Уравновесить оставшиеся атомы, обычно заканчивая наименее сложным веществом и при необходимости используя дробные коэффициенты.Если использовался дробный коэффициент, умножьте обе части уравнения на знаменатель, чтобы получить целые числа для коэффициентов.
- Подсчитайте количество атомов каждого сорта по обе стороны уравнения, чтобы убедиться, что химическое уравнение сбалансировано.
Пример \ (\ PageIndex {1} \): сжигание гептана
Выровняйте химическое уравнение горения гептана (\ (\ ce {C_7H_ {16}} \)).
\ [\ ce {C_7H_ {16} (l) + O_2 (g) → CO_2 (g) + H_2O (g)} \ nonumber \]
Решение
| Ступени | Пример |
|---|---|
| 1. Определите наиболее сложное вещество. | Самым сложным веществом является вещество с наибольшим числом различных атомов, то есть \ (C_7H_ {16} \). Сначала предположим, что окончательное сбалансированное химическое уравнение содержит 1 молекулу или формульную единицу этого вещества. Сначала предположим, что окончательное сбалансированное химическое уравнение содержит 1 молекулу или формульную единицу этого вещества. |
| 2. Настройте коэффициенты. | а. Поскольку одна молекула н-гептана содержит 7 атомов углерода, нам нужно 7 молекул CO 2 молекул, каждая из которых содержит 1 атом углерода, с правой стороны: \ [\ ce {C7h26 (l) + O2 (g) →} \ underline {7} \ ce {CO2 (g) + h3O (g)} \ nonumber \]
г.Поскольку одна молекула н-гептана содержит 16 атомов водорода, нам нужно 8 H 2 молекул O, каждая из которых содержит 2 атома водорода, с правой стороны: \ [\ ce {C7h26 (l) + O2 (g) → 7 CO2 (g) +} \ underline {8} \ ce {h3O (g)} \ nonumber \]
|
3. Уравновесить многоатомные ионы как единое целое. Уравновесить многоатомные ионы как единое целое. | В этой реакции не рассматриваются многоатомные ионы. |
| 4. Сбалансируйте оставшиеся атомы. | Атомы углерода и водорода теперь уравновешены, но у нас есть 22 атома кислорода справа и только 2 атома кислорода слева. Мы можем сбалансировать атомы кислорода, регулируя коэффициент перед наименее сложным веществом, O 2 , на стороне реагента: \ [\ ce {C7h26 (l) +} \ underline {11} \ ce {O2 (g) → 7 CO2 (g) + 8h3O (g)} \ nonumber \]
|
| 5. Проверьте свою работу. | Уравнение теперь сбалансировано, и дробных коэффициентов нет: с каждой стороны по 7 атомов углерода, 16 атомов водорода и 22 атома кислорода. Всегда проверяйте, сбалансировано ли химическое уравнение. Всегда проверяйте, сбалансировано ли химическое уравнение. |
Пример \ (\ PageIndex {2} \): сжигание изооктана
Сжигание изооктана (\ (\ ce {C_8H_ {18}} \))
\ [\ ce {C8h28 (l) + O2 (g) -> CO_2 (g) + H_2O (g)} \ nonumber \]
Решение
Предположение, что окончательное сбалансированное химическое уравнение содержит только одну молекулу или формульную единицу самого сложного вещества, не всегда верно, но это хорошее место для начала.При сжигании любого углеводорода с кислородом образуется углекислый газ и вода.
| Ступени | Пример |
|---|---|
| 1. Определите наиболее сложное вещество. | Самым сложным веществом является вещество с наибольшим числом различных атомов, то есть \ (\ ce {C8h28} \). Сначала предположим, что окончательное сбалансированное химическое уравнение содержит 1 молекулу или формульную единицу этого вещества. |
| 2. Настройте коэффициенты. | а. Первый элемент, который появляется в реагентах только один раз, — это углерод: 8 атомов углерода в изооктане означает, что в продуктах должно быть 8 молекул CO 2 : \ [\ ce {C8h28 (l) + O2 (g) ->} \ underline {8} \ ce {CO2 (g) + h3O (g)} \ nonumber \]
г.18 атомов водорода в изооктане означает, что в продуктах должно быть 9 молекул H 2 O: \ [\ ce {C8h28 (l) + O2 (g) -> 8CO2 (g) +} \ underline {9} \ ce {h3O (g)} \ nonumber \]
|
| 3. Уравновесить многоатомные ионы как единое целое. | В этой реакции не рассматриваются многоатомные ионы. |
| 4. Сбалансируйте оставшиеся атомы. | Атомы углерода и водорода теперь уравновешены, но у нас есть 25 атомов кислорода справа и только 2 атома кислорода слева. Мы можем сбалансировать наименее сложное вещество, O 2 , но поскольку на молекулу O 2 приходится 2 атома кислорода, мы должны использовать дробный коэффициент (\ (\ dfrac {25} {2} \)), чтобы сбалансировать атомы кислорода: \ [\ ce {C8h28 (l) +} \ underline {\ dfrac {25} {2}} \ ce {O2 (g) → 8CO2 (g) + 9h3O (g)} \ nonumber \]
Уравнение теперь сбалансировано, но мы обычно пишем уравнения с целочисленными коэффициентами.Мы можем исключить дробный коэффициент, умножив все коэффициенты с обеих сторон химического уравнения на 2 : \ [\ underline {2} \ ce {C8h28 (l) +} \ underline {25} \ ce {O2 (g) ->} \ underline {16} \ ce {CO2 (g) +} \ underline {18 } \ ce {h3O (g)} \ nonumber \] |
| 5. Проверьте свою работу. | Сбалансированное химическое уравнение содержит 16 атомов углерода, 36 атомов водорода и 50 атомов кислорода с каждой стороны. Уравновешивание уравнений требует от вас некоторой практики, а также некоторого здравого смысла. Если вы обнаружите, что используете очень большие коэффициенты или безуспешно потратили несколько минут, вернитесь и убедитесь, что вы правильно написали формулы реагентов и продуктов. |
Пример \ (\ PageIndex {3} \): Осаждение хлорида свинца (II)
Смешивают водные растворы нитрата свинца (II) и хлорида натрия.Продуктами реакции являются водный раствор нитрата натрия и твердый осадок хлорида свинца (II). Напишите сбалансированное химическое уравнение этой реакции.
Решение
| Ступени | Пример |
|---|---|
| 1. Определите наиболее сложное вещество. | Наиболее сложное вещество — хлорид свинца (II). \ [\ ce {Pb (NO3) 2 (водн.) + NaCl (водн.) → NaNO3 (водн.) + PbCl2 (s)} \ nonumber \] |
| 2. Настройте коэффициенты. | В реагентах содержится вдвое больше ионов хлора, чем в продуктах. Поставьте 2 перед NaCl, чтобы уравновесить ионы хлора. \ [\ ce {Pb (NO3) 2 (водн.) +} \ Underline {2} \ ce {NaCl (водн.) → NaNO3 (водн.) + PbCl2 (s)} \ nonumber \]
|
| 3. Уравновесить многоатомные ионы как единое целое. | Нитрат-ионы все еще не сбалансированы. Поставьте 2 перед NaNO 3 . Результат: \ [\ ce {Pb (NO3) 2 (водн.) + 2NaCl (водн.) →} \ underline {2} \ ce {NaNO3 (водн.) + PbCl2 (s)} \ nonumber \]
|
| 4. Уравновесить оставшиеся атомы. | Нет необходимости балансировать оставшиеся атомы, потому что они уже уравновешены. |
| 5. Проверьте свою работу. | \ [\ ce {Pb (NO3) 2 (водн.) + 2NaCl (водн.) → 2NaNO3 (водн.) + PbCl2 (s)} \ nonumber \]
|
Упражнение \ (\ PageIndex {1} \)
Все ли химические уравнения сбалансированы?
- \ (\ ce {2Hg (ℓ) + O_2 (g) \ rightarrow Hg_2O_2 (s)} \)
- \ (\ ce {C_2H_4 (г) + 2O_2 (г) → 2CO_2 (г) + 2H_2O (г)} \)
- \ (\ ce {Mg (NO_3) _2 (s) + 2Li (s) \ rightarrow Mg (s) + 2LiNO_3 (s)} \)
- Ответить на
- да
- Ответ б
- №
- Ответ c
- да
Упражнение \ (\ PageIndex {2} \)
Уравновесите следующие химические уравнения.
- \ (\ ce {N2 (г) + O2 (г) → NO2 (г)} \)
- \ (\ ce {Pb (NO3) 2 (водн.) + FeCl3 (водн.) → Fe (NO3) 3 (водн.) + PbCl2 (s)} \)
- \ (\ ce {C6h24 (l) + O2 (g) → CO2 (g) + h3O (g)} \)
- Ответить на
- N 2 (г) + 2O 2 (г) → 2NO 2 (г)
- Ответ б
- 3Pb (NO 3 ) 2 (водн.) + 2FeCl 3 (водн.) → 2Fe (NO 3 ) 3 (водн.) + 3PbCl 2 (s)
- Ответ c
- 2C 6 H 14 (л) + 19O 2 (г) → 12CO 2 (г) + 14H 2 O (г)
Сводка
- Чтобы быть полезным, химические уравнения всегда должны быть сбалансированы.Сбалансированные химические уравнения имеют одинаковое количество и тип каждого атома с обеих сторон уравнения.
- Коэффициенты в сбалансированном уравнении должны быть простейшим целочисленным отношением. В химических реакциях масса всегда сохраняется.
Словарь
- Химическая реакция — Процесс, в котором одно или несколько веществ превращаются в одно или несколько новых веществ.
- Реагенты — Исходные вещества в реакции.
- Продукты — Материалы, присутствующие в конце реакции.
- Сбалансированное химическое уравнение — Химическое уравнение, в котором количество атомов каждого типа равно на двух сторонах уравнения.
- Индексы — Часть химических формул реагентов и продуктов, указывающая количество атомов предыдущего элемента.
- Коэффициент — Небольшое целое число, которое появляется перед формулой в сбалансированном химическом уравнении.
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или всесторонне) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
Обзоры формул баланса крови — Nutrition Hacks Проверена добавка для баланса крови
Формула баланса кровибыла специально разработана, чтобы помочь держать гипертонию под контролем. Продукт состоит из лучших ингредиентов, минералов, витаминов и трав, взятых из лучших источников, чтобы обеспечить эффективность его работы.Эта добавка не только обеспечивает здоровый и оптимальный уровень артериального давления, но также помогает поддерживать уровень холестерина и триглицеридов в крови.
Купите формулу баланса крови по эксклюзивной сниженной цене здесь
Добавив добавку в свой распорядок дня, вы защитите свое сердце. Он исходит от компании Nutrition Hacks, о которой вы, возможно, даже слышали раньше.
Обзор формулы баланса крови:
Как и большинство населения, страдаете ли вы гипертонией? Если вы это сделаете, то, вероятно, будете знать, сколько лекарств должен принимать человек с этим заболеванием.Наряду с приемом лекарств и борьбой с множеством связанных с ними негативных побочных эффектов гипертоники также должны заботиться о своей диете и образе жизни.
Если вы человек, у которого артериальное давление часто выходит из-под контроля и боится, что он может заболеть гипертонией, то вы можете добавить одну добавку к рутине, чтобы взять ситуацию под контроль, прежде чем она станет очень проблемной, — это формула баланса крови.
Почему эта формула и что это вообще такое? По сути, это натуральная добавка, состоящая из трав, витаминов и минералов, которые были добавлены в правильных пропорциях для обеспечения здорового уровня артериального давления.Рассматриваемый продукт является высококачественным, который был приготовлен в лаборатории, которая строго соблюдает все лучшие меры здоровья и гигиены. Откуда мы это знаем наверняка? Это потому, что он исходит от надежной компании под названием Nutrition Hacks.
(УДИВИТЕЛЬНОЕ ПРЕДЛОЖЕНИЕ) Получить Nutrition Hacks Формула баланса крови по самой низкой цене сегодня
Premium Features:
Есть несколько качеств, которые делают эту добавку той, которой вы можете доверять. Вот несколько причин, по которым добавка Nutrition Hacks Blood Balance Formula может стать отличным дополнением к вашему распорядку дня, если вы боитесь контролировать уровень артериального давления:
Добавка представляет собой натуральный и безопасный состав
Все ингредиенты, которые были включены в состав формулы — это те, которые были полностью протестированы и взяты из природы.Качество этих ингредиентов также достойно похвалы. Кроме того, в состав не было добавлено никаких повреждающих ингредиентов.
Благодаря натуральному составу формулы, он также безопасен для использования. Это потому, что в основном натуральные ингредиенты, когда они добавлены в правильном количестве, не вызывают каких-либо негативных побочных эффектов.
Тщательно протестирован и тоже хорошего качества.
Качество товара отличное, поэтому на него можно положиться, не сомневаясь.Это потому, что добавка прошла через лучшие производственные практики и была произведена в США.
Перед добавлением в добавку все ингредиенты были тщательно протестированы, а их утверждения были научно оценены, чтобы гарантировать, что они являются правильным дополнением к формуле. Фактически, подход, использованный в продукте, также подтвержден наукой.
Вы можете удобно добавить этот продукт в распорядок дня.
И последнее, но не менее важное: включить его в распорядок дня также не составит труда.Вам не нужно готовить рецепт, который может запутать и отнять много времени. От вас также не требуют следовать каким-либо советам и уловкам, которые кажутся вам странными и неудобными.
В принципе, капсулы нужно только запивать водой. Одна вещь, которую вам нужно соблюдать при употреблении этого продукта, заключается в том, что вы должны принимать его регулярно, чтобы результаты были заметны.
ТАКЖЕ ПРОЧИТАЙТЕ: Отзывы клиентов о формуле баланса крови: узнайте, что говорят другие!
Польза для здоровья:
Давайте посмотрим, как таблетки формулы баланса крови могут помочь вашему здоровью:
Кровяное давление
Вы должны знать о многих опасностях, которые сопровождают высокое кровяное давление.Люди, страдающие гипертонией, подвержены риску сердечно-сосудистых заболеваний. Этот продукт помогает поддерживать оптимальный уровень артериального давления и поддерживает ваше здоровье в хорошей форме.
Холестерин
Когда уровень плохого холестерина в крови повышается больше, чем должен, он может вызвать свертывание крови, что может быть очень опасным. Этот продукт гарантирует, что уровень плохого холестерина в крови не поднимется выше оптимального.
Триглицериды
И последнее, но не менее важное: эта добавка также контролирует уровень триглицеридов.Таким образом, он помогает защитить ваше сердце и укрепить его здоровье. Когда маркеры холестерина и триглицеридов артериального давления в норме, риск сердечно-сосудистых заболеваний существенно снижается.
Нажмите здесь, чтобы купить формулу баланса крови с официального сайта сейчас.
Формула баланса крови Ингредиенты:
Все ингредиенты, входящие в эту формулу, полностью натуральные, поэтому вы можете использовать ее без каких-либо колебаний. Вот основные агенты, включенные в анализ крови:
Лист белой шелковицы способствует более быстрому заживлению и снижает риск диабета
Витамин C контролирует как систолическое, так и диастолическое артериальное давление и защищает сердце
Биотин снижает симптомы невропатии
Хром улучшает инсулин функциональность
Цинк способствует синтезу белка и укрепляет иммунитет.
Ягоды можжевельника — богатый источник витамина Е и антиоксидантов.Он также обладает противовоспалительными свойствами.
Ванадий имитирует инсулин и выполняет свои функции.
Гуггул является богатым источником антиоксидантов и уменьшает боль в суставах, а также способствует поддержанию нормального уровня артериального давления.
Магний защищает ваше здоровье от диабета
Горькая дыня снижает уровень глюкозы. уровни
Альфа-липоевая кислота снижает риск психических расстройств
Берперин увеличивает скорость абсорбции других ингредиентов
Экстракт корня солодки контролирует холестерин, а также глюкозу в крови.Он также останавливает нездоровое воспаление и способствует потере веса.
Порошок листьев Gymnema sylvester. Это последний ингредиент, который помогает при похудании и укрепляет здоровье сердца.
Формула баланса крови Где купить и сколько стоит?
Вы можете приобрести это дополнение только на официальном сайте: вот ссылка. Его нет в Walmart, Walgreens, GNC или Amazon. Для защиты потребителей и во избежание мошенничества всегда покупайте у официального поставщика. Что касается цен, вы получаете:
1 бутылка за 49 долларов.95
3 бутылки по 43,33 доллара за каждую
5 бутылок по 37,99 долларов за каждую
Обзоры формул баланса крови Вердикт:
Формула баланса крови от Nutrition Hacks — это натуральная формула, которая в основном была разработана для поддержания здорового уровня артериального давления. Однако, помимо поддержания оптимального артериального давления, он также может помочь контролировать уровень плохого холестерина и высоких триглицеридов. Добавка получена из научных исследований и имеет натуральный состав, поэтому вы можете легко ей доверять.Самое приятное то, что добавить его в свой распорядок тоже несложно. Получите его сегодня на официальном сайте, пока расходные материалы есть в наличии.
Посетите официальный веб-сайт здесь, чтобы разместить заказ
Как сбалансировать химические уравнения: 11 шагов (с изображениями)
Об этой статье
Соавторы:
Ученый-эколог
Соавтором этой статьи является Bess Ruff, MA.Бесс Рафф — аспирант по географии в Университете штата Флорида. Она получила степень магистра наук в области окружающей среды и менеджмента в Калифорнийском университете в Санта-Барбаре в 2016 году. Она проводила исследования для проектов морского пространственного планирования в Карибском бассейне и оказывала поддержку в исследованиях в качестве аспиранта Группы устойчивого рыболовства. Эта статья была просмотрена 4 185 079 раз (а).Соавторы: 162
Обновлено: 22 июля 2021 г.
Просмотры: 4,185,079
Резюме статьи XЧтобы сбалансировать химическое уравнение, сначала запишите данную формулу с реагентами слева от стрелки и продуктами справа.Например, ваше уравнение должно выглядеть примерно так: «h3 + O2 → h3O». Подсчитайте количество атомов в каждом элементе с каждой стороны уравнения и перечислите их под этой стороной. В уравнении h3 + O2 → h3O 2 атома водорода добавляются к 2 атомам кислорода слева, поэтому вы должны написать «H = 2» и «O = 2» под левой стороной. Справа находятся 2 атома водорода и 1 атом кислорода, поэтому вы должны написать «H = 2» и «O = 1» под правой стороной. Поскольку количество атомов в каждом элементе не одинаково с обеих сторон, уравнение не сбалансировано.Чтобы сбалансировать уравнение, вам нужно добавить коэффициенты, чтобы изменить количество атомов с одной стороны, чтобы оно соответствовало другой. Для уравнения h3 + O2 → h3O вы должны добавить коэффициент 2 перед h3O в правой части, чтобы на каждой стороне уравнения было по 2 атома кислорода, например h3 + O2 → 2h3O. Однако нижние индексы не могут быть изменены и всегда умножаются на коэффициент, что означает, что теперь в правой части уравнения есть 4 атома водорода и только 2 атома водорода в левой части. Чтобы сбалансировать это, добавьте коэффициент 2 перед h3 в левой части уравнения, чтобы с каждой стороны было по 4 атома водорода, например 2h3 + O2 → 2h3O.Теперь количество атомов в каждом элементе одинаково с обеих сторон уравнения, поэтому уравнение сбалансировано. Помните, что если перед элементом нет коэффициента, предполагается, что коэффициент равен 1. Чтобы узнать, как сбалансировать химические уравнения алгебраически, прокрутите вниз!
- Печать
- Отправить письмо от фаната авторам
4.1 Написание и балансировка химических уравнений — химия
Цели обучения
К концу этого раздела вы сможете:
- Получите химические уравнения из повествовательных описаний химических реакций.
- Записывайте и уравновешивайте химические уравнения в молекулярном, общем ионном и чистом ионном форматах.
В предыдущей главе было представлено использование символов элементов для представления отдельных атомов. Когда атомы приобретают или теряют электроны, чтобы образовать ионы, или объединяются с другими атомами для образования молекул, их символы изменяются или объединяются для создания химических формул, которые надлежащим образом представляют эти частицы. Расширение этой символики для представления как идентичностей, так и относительных количеств веществ, подвергающихся химическим (или физическим) изменениям, включает в себя написание и уравновешивание химического уравнения .Рассмотрим в качестве примера реакцию между одной молекулой метана (CH 4 ) и двумя молекулами двухатомного кислорода (O 2 ) с образованием одной молекулы диоксида углерода (CO 2 ) и двух молекул воды (H 2 O). . Химическое уравнение, представляющее этот процесс, представлено в верхней половине рисунка 1, а молекулярные модели, заполняющие пространство, показаны в нижней половине рисунка.
Рисунок 1. Реакция между метаном и кислородом с образованием диоксида углерода и воды (показана внизу) может быть представлена химическим уравнением с использованием формул (вверху).Этот пример иллюстрирует фундаментальные аспекты любого химического уравнения:
- Вещества, вступающие в реакцию, называются реагентами , а их формулы помещаются в левую часть уравнения.
- Вещества, образующиеся в результате реакции, называются продуктами , а их формулы помещаются в правом поле зрения уравнения.
- Знаки плюс (+) разделяют формулы отдельных реагентов и продуктов, а стрелка (⟶) разделяет реагент и продукт (левую и правую) части уравнения.
- Относительные количества реагентов и продуктов представлены коэффициентами (числа расположены непосредственно слева от каждой формулы). Коэффициент 1 обычно не указывается.
Обычно в химическом уравнении используются минимально возможные целочисленные коэффициенты, как это сделано в этом примере. Однако следует понимать, что эти коэффициенты представляют собой относительных количества реагентов и продуктов, и, следовательно, их можно правильно интерпретировать как отношения.Метан и кислород реагируют с образованием диоксида углерода и воды в соотношении 1: 2: 1: 2. Это соотношение выполняется, если количество этих молекул составляет соответственно 1-2-1-2, или 2-4-2-4, или 3-6-3-6 и так далее (Рисунок 2). Аналогичным образом, эти коэффициенты можно интерпретировать относительно любой единицы количества (числа), и поэтому это уравнение можно правильно прочитать многими способами, включая:
- Одна молекула метана и две молекулы кислорода вступают в реакцию с образованием одной молекулы диоксида углерода и двух молекул воды.
- Одна дюжина молекул метана и две дюжины молекул кислорода вступают в реакцию с образованием одной дюжины молекул углекислого газа и двух дюжин молекул воды.
- Один моль молекул метана и 2 моля молекул кислорода реагируют с образованием 1 моль молекул углекислого газа и 2 моля молекул воды.
Химическое уравнение, описанное в разделе 4.1, — это сбалансированный , что означает, что равное количество атомов для каждого элемента, участвующего в реакции, представлено на сторонах реагента и продукта. Это требование, которому уравнение должно удовлетворять, чтобы соответствовать закону сохранения материи. Это можно подтвердить, просто суммируя количество атомов по обе стороны от стрелки и сравнивая эти суммы, чтобы убедиться, что они равны. Обратите внимание, что количество атомов для данного элемента рассчитывается путем умножения коэффициента любой формулы, содержащей этот элемент, на нижний индекс элемента в формуле.Если элемент присутствует более чем в одной формуле на одной стороне уравнения, количество атомов, представленных в каждой, необходимо вычислить, а затем сложить. Например, оба продукта реакции, CO 2 и H 2 O, содержат элемент кислород, поэтому количество атомов кислорода на стороне продукта уравнения составляет
[латекс] (1 \; \ text {CO} _2 \; \ text {молекула} \ times \ frac {2 \; \ text {O atom}} {\ text {CO} _2 \; \ text {молекула} }) + (2 \; \ text {H} _2 \ text {молекула O} \ times \ frac {1 \; \ text {атом O}} {\ text {H} _2 \ text {молекула O}}) = 4 \; \ text {O atom} [/ latex]
Уравнение реакции между метаном и кислородом с образованием диоксида углерода и воды подтверждено как сбалансированное в соответствии с этим подходом, как показано здесь:
[латекс] \ text {CH} _4 + 2 \ text {O} _2 \ longrightarrow \ text {CO} _2 + 2 \ text {H} _2 \ text {O} [/ latex]
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| С | 1 × 1 = 1 | 1 × 1 = 1 | 1 = 1, да |
| H | 4 × 1 = 4 | 2 × 2 = 4 | 4 = 4, да |
| O | 2 × 2 = 4 | (1 × 2) + (2 × 1) = 4 | 4 = 4, да |
| Таблица 1. | |||
Сбалансированное химическое уравнение часто можно получить из качественного описания некоторой химической реакции с помощью довольно простого подхода, известного как балансирование путем проверки. Рассмотрим в качестве примера разложение воды с образованием молекулярного водорода и кислорода. Качественно этот процесс представлен несбалансированным химическим уравнением:
[латекс] \ text {H} _2 \ text {O} \ longrightarrow \ text {H} _2 + \ text {O} _2 \; (\ text {unbalanced}) [/ latex]
Сравнение количества атомов H и O по обе стороны от этого уравнения подтверждает его дисбаланс:
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| H | 1 × 2 = 2 | 1 × 2 = 2 | 2 = 2, да |
| O | 1 × 1 = 1 | 1 × 2 = 2 | 1 ≠ 2, № |
| Таблица 2. | |||
Количество атомов H в реагирующей и продуктивной частях уравнения равно, а количество атомов O — нет. Для достижения баланса коэффициенты уравнения могут быть изменены по мере необходимости. Имейте в виду, конечно, что нижние индексы формулы определяют, отчасти, идентичность вещества, и поэтому их нельзя изменить без изменения качественного смысла уравнения. Например, изменение формулы реагента с H 2 O на H 2 O 2 приведет к сбалансированному количеству атомов, но при этом также изменится идентичность реагента (теперь это перекись водорода, а не вода).Баланс атомов O может быть достигнут путем изменения коэффициента для H 2 O на 2.
[латекс] 2 \ text {H} _2 \ text {O} \ longrightarrow \ text {H} _2 + \ text {O} _2 \; (\ text {unbalanced}) [/ latex]
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| H | 2 × 2 = 4 | 1 × 2 = 2 | 4 ≠ 2, № |
| O | 2 × 1 = 2 | 1 × 2 = 2 | 2 = 2, да |
| Таблица 3. | |||
Баланс атомов H был нарушен этим изменением, но его легко восстановить, изменив коэффициент для произведения H 2 на 2.
[латекс] 2 \ text {H} _2 \ text {O} \ longrightarrow 2 \ text {H} _2 + \ text {O} _2 \; (\ text {сбалансированный}) [/ latex]
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| H | 2 × 2 = 4 | 2 × 2 = 4 | 4 = 4, да |
| O | 2 × 1 = 2 | 1 × 2 = 2 | 2 = 2, да |
| Таблица 4. | |||
Эти коэффициенты дают равное количество атомов H и O на сторонах реагента и продукта, поэтому сбалансированное уравнение имеет вид:
[латекс] 2 \ text {H} _2 \ text {O} \ longrightarrow 2 \ text {H} _2 + \ text {O} _2 [/ latex]
Пример 1
Балансирующие химические уравнения
Напишите сбалансированное уравнение реакции молекулярного азота (N 2 ) и кислорода (O 2 ) с образованием пятиокиси азота.
Решение
Сначала напишите несбалансированное уравнение.
[латекс] \ text {N} _2 + \ text {O} _2 \ longrightarrow \ text {N} _2 \ text {O} _5 \; (\ text {unbalanced}) [/ latex]
Затем подсчитайте количество атомов каждого типа, присутствующих в несбалансированном уравнении.
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| N | 1 × 2 = 2 | 1 × 2 = 2 | 2 = 2, да |
| O | 1 × 2 = 2 | 1 × 5 = 5 | 2 ≠ 5, № |
| Таблица 5. | |||
Хотя азот уравновешен, изменения коэффициентов необходимы, чтобы уравновесить количество атомов кислорода. Чтобы сбалансировать количество атомов кислорода, разумной первой попыткой было бы изменить коэффициенты для O 2 и N 2 O 5 на целые числа, которые дадут 10 атомов O (наименьшее общее кратное для атома O индексы в этих двух формулах).
[латекс] \ text {N} _2 + 5 \ text {O} _2 \ longrightarrow 2 \ text {N} _2 \ text {O} _5 \; (\ text {unbalanced}) [/ latex]
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| N | 1 × × 2 = 2 | 2 × 2 = 4 | 2 ≠ 4, № |
| O | 5 × 2 = 10 | 2 × 5 = 10 | 10 = 10, да |
| Таблица 6. | |||
Баланс атомов азота был нарушен этим изменением; восстанавливается изменением коэффициента для реагента N 2 на 2.
[латекс] 2 \ text {N} _2 + 5 \ text {O} _2 \ longrightarrow 2 \ text {N} _2 \ text {O} _5 [/ latex]
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| N | 2 × 2 = 4 | 2 × 2 = 4 | 4 = 4, да |
| O | 5 × 2 = 10 | 2 × 5 = 10 | 10 = 10, да |
| Таблица 7. | |||
Число атомов N и O по обе стороны уравнения теперь равно, и уравнение сбалансировано.
Проверьте свои знания
Напишите сбалансированное уравнение разложения нитрата аммония с образованием молекулярного азота, молекулярного кислорода и воды. (Подсказка: балансируйте кислород в последнюю очередь, поскольку он присутствует более чем в одной молекуле в правой части уравнения.)
Ответ:
[латекс] 2 \ text {NH} _4 \ text {NO} _3 \ longrightarrow 2 \ text {N} _2 + \ text {O} _2 + 4 \ text {H} _2 \ text {O} [/ latex]
Иногда удобно использовать дроби вместо целых чисел в качестве промежуточных коэффициентов в процессе балансировки химического уравнения.Когда баланс достигнут, все коэффициенты уравнения можно затем умножить на целое число, чтобы преобразовать дробные коэффициенты в целые числа без нарушения атомного баланса. Например, рассмотрим реакцию этана (C 2 H 6 ) с кислородом с образованием H 2 O и CO 2 , представленных несбалансированным уравнением:
[латекс] \ text {C} _2 \ text {H} _6 + \ text {O} _2 \ longrightarrow \ text {H} _2 \ text {O} + \ text {C} \ text {O} _2 \; (\ text {unbalanced}) [/ latex]
Следуя обычному подходу к проверке, можно сначала уравновесить атомы C и H, изменив коэффициенты для двух видов продукта, как показано:
[латекс] \ text {C} _2 \ text {H} _6 + \ text {O} _2 \ longrightarrow 3 \ text {H} _2 \ text {O} + 2 \ text {C} \ text {O} _2 \; (\ text {unbalanced}) [/ latex]
Это приводит к семи атомам O на стороне продукта уравнения, нечетному числу — нельзя использовать целочисленный коэффициент с реагентом O 2 для получения нечетного числа, поэтому дробный коэффициент, [латекс] \ frac {7 } {2} [/ latex] используется вместо этого для получения предварительного сбалансированного уравнения:
[латекс] \ text {C} _2 \ text {H} _6 + \ frac {7} {2} \ text {O} _2 \ longrightarrow 3 \ text {H} _2 \ text {O} + 2 \ text { C} \ text {O} _2 \; [/ латекс]
Обычное сбалансированное уравнение с коэффициентами только для целых чисел получается путем умножения каждого коэффициента на 2:
[латекс] 2 \ text {C} _2 \ text {H} _6 + 7 \ text {O} _2 \ longrightarrow 6 \ text {H} _2 \ text {O} + 4 \ text {C} \ text {O } _2 \; [/ латекс]
Наконец, что касается сбалансированных уравнений, напомним, что соглашение диктует использование наименьших целочисленных коэффициентов .Хотя уравнение реакции между молекулярным азотом и молекулярным водородом с образованием аммиака действительно сбалансировано,
[латекс] 3 \ text {N} _2 + 9 \ text {H} _2 \ longrightarrow 6 \ text {N} \ text {H} _3 [/ latex]
, коэффициенты не являются наименьшими возможными целыми числами, представляющими относительное количество молекул реагента и продукта. Разделив каждый коэффициент на наибольший общий множитель, 3, мы получим предпочтительное уравнение:
[латекс] \ text {N} _2 + 3 \ text {H} _2 \ longrightarrow 2 \ text {N} \ text {H} _3 [/ latex]
Используйте это интерактивное руководство для дополнительной тренировки уравнений балансировки.
Физические состояния реагентов и продуктов в химических уравнениях очень часто указываются с аббревиатурой в скобках после формул. Общие сокращения включают s для твердых веществ, l для жидкостей, г для газов и вод. для веществ, растворенных в воде ( водных растворов, , как было введено в предыдущей главе). Эти обозначения проиллюстрированы здесь в примере уравнения:
[латекс] 2 \ text {Na} (s) + 2 \ text {H} _2 \ text {O} (l) \ longrightarrow 2 \ text {NaOH} (aq) + \ text {H} _2 (g) [/ латекс]
Это уравнение представляет реакцию, которая происходит, когда металлический натрий помещается в воду.Твердый натрий реагирует с жидкой водой с образованием газообразного молекулярного водорода и ионного соединения гидроксида натрия (твердое вещество в чистой форме, но легко растворяется в воде).
Особые условия, необходимые для реакции, иногда обозначают написанием слова или символа над или под стрелкой уравнения. Например, реакция, проводимая при нагревании, может быть обозначена прописной греческой буквой дельта (Δ) над стрелкой.
[латекс] \ text {CaCO} _3 (s) \; \ xrightarrow {\ Delta} \; \ text {CaO} (s) + \ text {CO} _2 (g) [/ latex]
Другие примеры этих особых условий будут рассмотрены более подробно в следующих главах.
Учитывая обилие воды на Земле, само собой разумеется, что очень много химических реакций происходит в водных средах. Когда ионы участвуют в этих реакциях, химические уравнения могут быть записаны с различными уровнями детализации, соответствующими их предполагаемому использованию. Чтобы проиллюстрировать это, рассмотрим реакцию между ионными соединениями, протекающую в водном растворе. Когда водные растворы CaCl 2 и AgNO 3 смешиваются, происходит реакция с образованием водного Ca (NO 3 ) 2 и твердого AgCl:
[латекс] \ text {CaCl} _2 (водн.) + 2 \ text {AgNO} _3 (водн.) \ Longrightarrow \ text {Ca (NO} _3) _2 (водн.) + 2 \ text {AgCl} (s) [ / латекс]
Это сбалансированное уравнение, полученное обычным способом, называется молекулярным уравнением , потому что оно не представляет явным образом ионные частицы, присутствующие в растворе.{-} (водн.) + 2 \ text {AgCl} (s) [/ latex]
Изучение этого уравнения показывает, что два химических соединения присутствуют в идентичной форме по обе стороны стрелки: Ca 2+ ( водн., ) и NO3- (водн.). NO3- (водн.). Эти ионы-наблюдатели — ионы, присутствие которых требуется для поддержания нейтральности заряда — не изменяются ни химически, ни физически в процессе, поэтому их можно исключить из уравнения, чтобы получить более сжатое представление, называемое чистым ионным уравнением :
[латекс] \ правило [0.{+} (aq) \ longrightarrow \ text {AgCl} (s) [/ latex]
Это чистое ионное уравнение показывает, что твердый хлорид серебра может быть получен из растворенных ионов хлорида и серебра (I), независимо от источника этих ионов. Эти молекулярные и полные ионные уравнения предоставляют дополнительную информацию, а именно об ионных соединениях, используемых в качестве источников Cl — и Ag + .
Пример 2
Молекулярные и ионные уравнения
Когда диоксид углерода растворяется в водном растворе гидроксида натрия, смесь реагирует с образованием водного карбоната натрия и жидкой воды. {2 -} (aq) + \ text {H} _2 \ text {O} (l) [/ latex]
Наконец, определите ион-наблюдатель, в данном случае Na + ( водн. ), и удалите его с каждой стороны уравнения, чтобы получить чистое ионное уравнение:
[латекс] \ text {CO} _2 (aq) + \ rule [0.{2 -} (aq) + \ text {H} _2 \ text {O} (l) [/ latex]
Проверьте свои знания
Двухатомный хлор и гидроксид натрия (щелок) — это химические вещества, производимые в больших количествах вместе с двухатомным водородом в результате электролиза рассола в соответствии со следующим несбалансированным уравнением:
[латекс] \ text {NaCl} (aq) + \ text {H} _2 \ text {O} (l) \; \; \ xrightarrow {\ text {электричество}} \; \; \ text {NaOH} (водн.) + \ text {H} _2 (g) + \ text {Cl} _2 (g) [/ latex]
Напишите сбалансированные молекулярные, полные ионные и чистые ионные уравнения для этого процесса.{-} (aq) + 2 \ text {H} _2 (g) + \ text {Cl} _2 (g) (\ text {net ionic}) [/ latex]
Химические уравнения являются символическим отображением химических и физических изменений. Формулы для веществ, претерпевающих изменение (реагенты), и веществ, образующихся в результате изменения (продукты), разделены стрелкой и им предшествуют целочисленные коэффициенты, указывающие их относительные числа. Сбалансированные уравнения — это уравнения, коэффициенты которых приводят к равному количеству атомов для каждого элемента в реагентах и продуктах.Химические реакции в водном растворе, в которых участвуют ионные реагенты или продукты, могут быть более реалистично представлены полными ионными уравнениями и, более кратко, чистыми ионными уравнениями.
Химия: упражнения в конце главы
- Что значит сказать, что уравнение сбалансировано? Почему важно сбалансировать уравнение?
- Рассмотрите молекулярные, полные ионные и чистые ионные уравнения.
(а) В чем разница между этими типами уравнений?
(b) При каких обстоятельствах полное и чистое ионные уравнения реакции будут идентичными?
- Уравновесите следующие уравнения:
(a) [латекс] \ text {PCl} _5 (s) + \ text {H} _2 \ text {O} (l) \ longrightarrow \ text {POCl} _3 (l) + \ text {HCl} (aq ) [/ латекс]
(b) [латекс] \ text {Cu} (s) + \ text {HNO} _3 (aq) \ longrightarrow \ text {Cu (NO} _3) _2 (aq) + \ text {H} _2 \ text { O} (l) + \ text {NO} (g) [/ latex]
(c) [латекс] \ text {H} _2 (g) + \ text {I} _2 (s) \ longrightarrow \ text {HI} (s) [/ latex]
(d) [латекс] \ text {Fe} (s) + \ text {O} _2 (g) \ longrightarrow \ text {Fe} _2 \ text {O} _3 (s) [/ latex]
(e) [латекс] \ text {Na} (s) + \ text {H} _2 \ text {O} (l) \ longrightarrow \ text {NaOH} (aq) + \ text {H} _2 (g) [/ латекс]
(f) [латекс] \ text {(NH} _4) _2 \ text {Cr} _2 \ text {O} _7 (s) \ longrightarrow \ text {Cr} _2 \ text {O} _3 (s) + \ текст {N} _2 (g) + \ text {H} _2 \ text {O} (g) [/ latex]
(г) [латекс] \ text {P} _4 (s) + \ text {Cl} _2 (g) \ longrightarrow \ text {PCl} _3 (l) [/ латекс]
(h) [латекс] \ text {PtCl} _4 (s) \ longrightarrow \ text {Pt} (s) + \ text {Cl} _2 (g) [/ latex]
- Уравновесите следующие уравнения:
(a) [латекс] \ text {Ag} (s) + \ text {H} _2 \ text {S} (g) + \ text {O} _2 (g) \ longrightarrow \ text {Ag} _2 \ text {S} (s) + \ text {H} _2 \ text {O} (l) [/ latex]
(b) [латекс] \ text {P} _4 (s) + \ text {O} _2 (g) \ longrightarrow \ text {P} _4 \ text {O} _ {10} (s) [/ latex]
(c) [латекс] \ text {Pb} (s) + \ text {H} _2 \ text {O} (l) + \ text {O} _2 (g) \ longrightarrow \ text {Pb (OH)} _2 (s) [/ латекс]
(d) [латекс] \ text {Fe} (s) + \ text {H} _2 \ text {O} (l) \ longrightarrow \ text {Fe} _3 \ text {O} _4 (s) + \ text {H} _2 (г) [/ латекс]
(e) [латекс] \ text {Sc} _2 \ text {O} _3 (s) + \ text {SO} _3 (l) \ longrightarrow \ text {Sc} _2 \ text {(SO} _4) _3 ( s) [/ латекс]
(f) [латекс] \ text {Ca} _3 \ text {(PO} _4) _2 (aq) + \ text {H} _3 \ text {PO} _4 (aq) \ longrightarrow \ text {Ca (H} _2 \ text {PO} _4) _2 (водн.) [/ Латекс]
(g) [латекс] \ text {Al} (s) + \ text {H} _2 \ text {SO} _4 (aq) \ longrightarrow \ text {Al} _2 \ text {(SO} _4) _3 (s ) + \ text {H} _2 (g) [/ латекс]
(h) [латекс] \ text {TiCl} _4 (s) + \ text {H} _2 \ text {O} (g) \ longrightarrow \ text {TiO} _2 (s) + \ text {HCl} (g ) [/ латекс]
- Напишите сбалансированное молекулярное уравнение, описывающее каждую из следующих химических реакций.
(a) Твердый карбонат кальция нагревается и разлагается на твердый оксид кальция и газообразный диоксид углерода.
(b) Газообразный бутан, C 4 H 10 , реагирует с газообразным двухатомным кислородом с образованием газообразного диоксида углерода и водяного пара.
(c) Реакция взаимодействия водных растворов хлорида магния и гидроксида натрия с образованием твердого гидроксида магния и водного хлорида натрия.
(d) Водяной пар реагирует с металлическим натрием с образованием твердого гидроксида натрия и газообразного водорода.
- Напишите сбалансированное уравнение, описывающее каждую из следующих химических реакций.
(a) Твердый хлорат калия, KClO 3 , разлагается с образованием твердого хлорида калия и газообразного двухатомного кислорода.
(b) Твердый металлический алюминий реагирует с твердым двухатомным йодом с образованием твердого Al 2 I 6 .
(c) Когда твердый хлорид натрия добавляют к водной серной кислоте, образуются газообразный хлористый водород и водный сульфат натрия.
(d) Реакция взаимодействия водных растворов фосфорной кислоты и гидроксида калия с образованием водного дигидрофосфата калия и жидкой воды.
- Красочный фейерверк часто связан с разложением нитрата бария и хлората калия и реакцией металлов, магния, алюминия и железа с кислородом.
(a) Напишите формулы нитрата бария и хлората калия.
(b) Разложение твердого хлората калия приводит к образованию твердого хлорида калия и газообразного двухатомного кислорода. Напишите уравнение реакции.
(c) Разложение твердого нитрата бария приводит к образованию твердого оксида бария, газообразного двухатомного азота и газообразного двухатомного кислорода.Напишите уравнение реакции.
(d) Напишите отдельные уравнения реакций твердых металлов магния, алюминия и железа с газообразным двухатомным кислородом с образованием соответствующих оксидов металлов. (Предположим, что оксид железа содержит ионы Fe 3+ .)
- Заполните пробел единственной химической формулой ковалентного соединения, которая уравновесит уравнение:
- Водный фтороводород (плавиковая кислота) используется для травления стекла и анализа минералов на содержание кремния.Фтороводород также вступает в реакцию с песком (диоксид кремния).
(a) Напишите уравнение реакции твердого диоксида кремния с плавиковой кислотой с образованием газообразного тетрафторида кремния и жидкой воды.
(b) Минеральный флюорит (фторид кальция) широко встречается в Иллинойсе. Твердый фторид кальция можно также получить реакцией водных растворов хлорида кальция и фторида натрия с получением водного хлорида натрия в качестве другого продукта. Напишите полные и чистые ионные уравнения для этой реакции.
- Новый способ получения магния из морской воды включает несколько реакций. Напишите сбалансированное химическое уравнение для каждого этапа процесса.
(a) Первым этапом является разложение твердого карбоната кальция из морских ракушек с образованием твердого оксида кальция и газообразного диоксида углерода.
(b) Вторая стадия — это образование твердого гидроксида кальция как единственного продукта реакции твердого оксида кальция с жидкой водой.
(c) Затем к морской воде добавляют твердый гидроксид кальция, который реагирует с растворенным хлоридом магния с образованием твердого гидроксида магния и водного хлорида кальция.
(d) Твердый гидроксид магния добавляют к раствору соляной кислоты, получая растворенный хлорид магния и жидкую воду.
(e) Наконец, хлорид магния плавится и электролизуется с получением жидкого металлического магния и газообразного двухатомного хлора.
- Из сбалансированных молекулярных уравнений напишите полные ионные и чистые ионные уравнения для следующего:
(a) [латекс] \ text {K} _2 \ text {C} _2 \ text {O} _4 (aq) + \ text {Ba (OH)} _ 2 (aq) \ longrightarrow 2 \ text {KOH} ( aq) + \ text {BaC} _2 \ text {O} _2 (s) [/ latex]
(b) [латекс] {\ text {Pb (NO} _3)} _ 2 (aq) + \ text {H} _2 \ text {SO} _4 (aq) \ longrightarrow \ text {PbSO} _4 (s) + 2 \ text {HNO} _3 (aq) [/ latex]
(c) [латекс] \ text {CaCO} _3 (s) + \ text {H} _2 \ text {SO} _4 (aq) \ longrightarrow \ text {CaSO} _4 (s) + \ text {CO} _2 (g) + \ text {H} _2 \ text {O} (l) [/ latex]
Глоссарий
- вычисленное уравнение
- химическое уравнение с равным числом атомов для каждого элемента в реагенте и продукте
- химическое уравнение
- символическое изображение химической реакции
- коэффициент Число
- перед символами или формулами в химическом уравнении для обозначения их относительного количества
- полное ионное уравнение
- химическое уравнение, в котором все растворенные ионные реагенты и продукты, включая ионы-наблюдатели, явно представлены формулами для их диссоциированных ионов
- молекулярное уравнение
- химическое уравнение, в котором все реагенты и продукты представлены как нейтральные вещества
- чистое ионное уравнение
- химическое уравнение, в котором представлены только те растворенные ионные реагенты и продукты, которые претерпевают химические или физические изменения (исключая ионы-зрители)
- товар
- вещество, образовавшееся в результате химического или физического изменения; показано справа от стрелки в химическом уравнении
- реагент
- вещество, претерпевающее химические или физические изменения; показано слева от стрелки в химическом уравнении
- спектатор ион Ион
- , который не претерпевает химических или физических изменений во время реакции, но его присутствие необходимо для поддержания нейтральности заряда
Решения
Ответы на упражнения в конце главы по химии
1.Уравнение сбалансировано, когда одинаковое количество каждого элемента представлено на сторонах реагента и продукта. Уравнения должны быть сбалансированы, чтобы точно отражать закон сохранения материи.
3.
(a) [латекс] \ text {PCl} _5 (s) + \ text {H} _2 \ text {O} (l) \ longrightarrow \ text {POCl} _3 (l) + 2 \ text {HCl} ( водн) [/ латекс];
(b) [латекс] 3 \ text {Cu} (s) + 8 \ text {HNO} _3 (aq) \ longrightarrow 3 \ text {Cu (NO} _3) _2 (aq) + 4 \ text {H} _2 \ text {O} (l) + 2 \ text {NO} (g) [/ latex];
(c) [латекс] \ text {H} _2 (g) + \ text {I} _2 (s) \ longrightarrow 2 \ text {HI} (s) [/ latex];
(d) [латекс] 4 \ text {Fe} (s) + 3 \ text {O} _2 (g) \ longrightarrow 2 \ text {Fe} _2 \ text {O} _3 (s) [/ latex];
(e) [латекс] 2 \ text {Na} (s) + 2 \ text {H} _2 \ text {O} (l) \ longrightarrow 2 \ text {NaOH} (aq) + \ text {H} _2 (ж) [/ латекс];
(f) [латекс] \ text {(NH} _4) _2 \ text {Cr} _2 \ text {2O} _7 (s) \ longrightarrow \ text {Cr} _2 \ text {O} _3 (s) + \ текст {N} _2 (g) + 4 \ text {H} _2 \ text {O} (l) [/ latex];
(г) [латекс] \ text {P} _4 (s) + 6 \ text {Cl} _2 (g) \ longrightarrow 4 \ text {PCl} _3 (l) [/ latex];
(h) [латекс] \ text {PtCl} _4 (s) \ longrightarrow \ text {Pt} (s) + 2 \ text {Cl} _2 (g) [/ latex];
5.
(а) [латекс] \ text {CaCO} _3 (s) \ longrightarrow \ text {CaO} (s) + \ text {CO} _2 (g) [/ latex];
(b) [латекс] 2 \ text {C} _4 \ text {H} _ {10} (g) + 13 \ text {O} _2 (g) \ longrightarrow 8 \ text {CO} _2 (g) + 10 \ text {H} _2 \ text {O} (г) [/ латекс];
(c) [латекс] \ text {MgCl} _ {2} (aq) + 2 \ text {NaOH} (aq) \ longrightarrow \ text {Mg (OH)} _ 2 (s) + 2 \ text {NaCl} (водн.) [/ латекс];
(d) [латекс] 2 \ text {H} _2 \ text {O} (g) + 2 \ text {Na} (s) \ longrightarrow 2 \ text {NaOH} (s) + \ text {H} _2 (ж) [/ латекс];
7.
(а) [латекс] \ text {Ba (NO} _3) _2 [/ латекс], [латекс] \ text {KClO} _3 [/ латекс];
(b) [латекс] 2 \ text {KClO} _3 (s) \ longrightarrow 2 \ text {KCl} (s) + 3 \ text {O} _2 (g) [/ latex];
(c) [латекс] 2 \ text {Ba (NO} _3) _2 (s) \ longrightarrow 2 \ text {BaO} (s) + 2 \ text {N} _2 (g) + 5 \ text {O} _2 (г) [/ латекс];
(d) [латекс] 2 \ text {Mg} (s) + \ text {O} _2 (g) \ longrightarrow 2 \ text {MgO} (s) [/ latex]; [латекс] 4 \ text {Al} (s) + 3 \ text {O} _2 (g) \ longrightarrow 2 \ text {Al} _2 \ text {O} _3 (g) [/ latex]; [латекс] 4 \ text {Fe} (s) + 3 \ text {O} _2 (g) \ longrightarrow 2 \ text {Fe} _2 \ text {O} _3 (s) [/ latex];
9.{2 -} (aq) \ longrightarrow \ text {CaSO} _4 (s) + \ text {CO} _2 (g) + \ text {H} _2 \ text {O} (l) \; (\ text {net }) [/ latex]
Сбалансированное химическое уравнение: определение и примеры — видео и стенограмма урока
Как сбалансировать уравнение
Практика всегда добивается совершенства. В общем, чтобы сбалансировать уравнение, нам нужно сделать следующее:
- Подсчитать атомы каждого элемента в реагентах и продуктах.
- Использовать коэффициенты; при необходимости разместите их перед составами.
Шаги просты, но это процесс проб и ошибок. Давайте рассмотрим еще несколько примеров уравнений и методов, которые можно использовать для балансировки каждого из них.
Пример 1
Это реакция между метаном (Ch5) и кислородом (O2) с образованием диоксида углерода (CO2) и воды (h3O).
Показанная реакция представляет собой реакцию горения : соединение реагирует с кислородом с образованием диоксида углерода и воды.Метод заключается в том, чтобы сначала уравновесить атомы углерода (C), затем атомы водорода (H), а затем атомы кислорода (O).
В этом случае атомы углерода (C) уже уравновешены. Итак, теперь мы посмотрим на атомы водорода (H). Есть 4 атома водорода (H) на стороне реагентов и 2 атома водорода (H) на стороне продуктов. Чтобы уравновесить их, мы ставим коэффициент 2 перед h3O.
Теперь атомы водорода (H) уравновешены.Из-за коэффициента 2 перед h3O всего на стороне продуктов находится 4 атома кислорода (O). Чтобы уравновесить атомы кислорода с обеих сторон, мы ставим коэффициент 2 перед O2. Теперь химическое уравнение сбалансировано.
Пример 2
Это реакция между оксидом железа (Fe2O3) и углеродом (C) с образованием железа (Fe) и диоксида углерода (CO2).
Эта реакция не сбалансирована.Во-первых, нам нужно сбалансировать атомы кислорода. Мы делаем это так, чтобы с каждой стороны было по 6 атомов кислорода. Для этого нам нужно поставить коэффициент 2 перед Fe2O3 и коэффициент 3 перед CO2.
Теперь, когда атомы кислорода уравновешены, нам нужно сначала уравновесить атомы железа (Fe). Для этого нам нужно поставить коэффициент 4 перед Fe на стороне продуктов. Теперь, когда атомы Fe уравновешены, мы можем уравновесить атомы углерода.Мы делаем это, устанавливая коэффициент 3 перед C на стороне реагентов. Теперь химическое уравнение сбалансировано.
Пример 3
При работе с химическими уравнениями с многоатомными ионами , которые представляют собой ионы, состоящие из более чем одного атома, существует специальный метод для уравновешивания химического уравнения.
Метод состоит в том, чтобы рассматривать многоатомный ион целиком, как если бы это был только один атом.Давайте посмотрим на это химическое уравнение.
Многоатомный ион в данном случае — PO4 (зеленый). Мы будем рассматривать весь этот многоатомный ион как один атом. Со стороны реагентов есть один ион PO4, а со стороны продуктов — два иона PO4.
Первый шаг — сбалансировать многоатомные ионы с обеих сторон. Для этого мы ставим коэффициент 2 перед Na3PO4. Атомы натрия (Na) удваиваются, и PO4 теперь сбалансирован с обеих сторон.
Следующий шаг — уравновесить атомы магния (Mg), натрия (Na) и хлора (Cl). Сначала мы уравновешиваем атомы магния, задав коэффициент 3 перед MgCl2.
Затем мы уравновешиваем атомы Na и Cl с обеих сторон, помещая коэффициент 6 перед NaCl. В результате получается сбалансированное уравнение:
Пример 4
Давайте рассмотрим реакцию между алюминием (Al) и серной кислотой (h3SO4).В этой реакции наш многоатомный ион, который мы будем считать за один атом, — это SO4. Со стороны реагентов имеется один ион SO4, а со стороны продуктов — три иона SO4.
Сначала нам нужно сбалансировать ионы SO4, и для этого мы ставим коэффициент 3 перед h3SO4.
Атомы водорода и алюминия неуравновешены. Следующий шаг — уравновесить атомы водорода (H), поставив коэффициент 3 перед h3.
Последний шаг — уравновесить атомы алюминия (Al). Мы делаем это, помещая коэффициент 2 перед Al. Теперь химическое уравнение сбалансировано.
Краткое содержание урока
Согласно закону сохранения массы масса реагентов должна быть равна массе продуктов, когда происходит химическая реакция. Это означает, что количество различных атомов, участвующих в реагирующих веществах, должно оставаться неизменным после того, как реакция протекает.Там, где есть химическая реакция, есть химическое уравнение. Химическое уравнение необходимо сбалансировать так, чтобы оно подчинялось закону сохранения массы. Сбалансированное химическое уравнение возникает, когда количество различных атомов элементов на стороне реагентов равно количеству атомов на стороне продуктов.
Уравновешивание химических уравнений — это процесс проб и ошибок. При уравновешивании химических уравнений нам сначала нужно подсчитать различные атомы на стороне реагентов и на стороне продуктов.Если уравнение не сбалансировано, нам нужно использовать коэффициенты , которые являются числами, которые мы ставим перед реагирующими веществами, чтобы сбалансировать уравнение. Если перед химической формулой нет коэффициента, это означает, что коэффициент равен единице.
Для реакций горения метод заключается в уравновешивании атомов углерода (C), за которыми следуют атомы водорода (H), а затем атомы кислорода (O). Для атомов, включающих многоатомные ионы, общая методика состоит в том, чтобы считать весь многоатомный ион как один атом, сначала уравновесить их, а затем уравновесить остальные атомы.
Результаты обучения
После того, как вы закончите, вы должны уметь:
- Вспомнить, как закон сохранения массы требует сбалансированного химического уравнения
- Укажите шаги по уравновешиванию химического уравнения
- Уравновесить химическое уравнение
Как сбалансировать химические уравнения: 3 простых шага
Химическое уравнение говорит вам, что происходит во время химической реакции. Сбалансированное химическое уравнение содержит правильное количество реагентов и продуктов, удовлетворяющих Закону сохранения массы.
В этой статье мы поговорим о том, что такое химическое уравнение, как уравновесить химические уравнения, и дадим вам несколько примеров, которые помогут вам в вашей практике уравновешивания химических уравнений.
Что такое химическое уравнение?
Проще говоря, химическое уравнение говорит вам, что происходит в химической реакции . Вот как выглядит химическое уравнение:
Fe + O2 → Fe2O3
В левой части уравнения находятся реагенты. Это материалы, с которыми вы начинаете химическую реакцию.
В правой части уравнения находятся продукты. Продукты — это вещества, образованные в результате химической реакции.
Чтобы химическая реакция была правильной, она должна удовлетворять так называемому Закону сохранения массы, , который гласит, что масса не может быть создана или разрушена во время химической реакции. Это означает, что каждая сторона химического уравнения должна иметь одинаковое количество массы, потому что количество массы нельзя изменить.
Если в вашем химическом уравнении массы в левой и правой частях уравнения различаются, вам необходимо сбалансировать химическое уравнение.
Как сбалансировать химические уравнения — объяснение и пример
Уравновешивание химических уравнений означает, что вы пишете химическое уравнение правильно, чтобы на каждой стороне стрелки было одинаковое количество массы.
В этом разделе мы собираемся объяснить, как сбалансировать химическое уравнение на примере реальной жизни, химическом уравнении, которое возникает, когда железо ржавеет:
Fe + O 2 → Fe 2 O 3
# 1: Определите продукты и реагенты
Первым шагом в балансировании химического уравнения является определение ваших реагентов и ваших продуктов. Помните, ваши реагенты находятся в левой части уравнения. Товары находятся на правой стороне.
Для этого уравнения нашими реагентами являются Fe и O 2 . Наши продукты — это Fe 2 и O3.
# 2: Запишите количество атомов
Затем вам нужно определить, сколько атомов каждого элемента присутствует на каждой стороне уравнения. Это можно сделать, просмотрев индексы или коэффициенты. Если нет нижнего индекса или коэффициента, то у вас просто один атом чего-то.
Fe + O 2 → Fe 2 O 3
Со стороны реагента у нас есть один атом железа и два атома кислорода.
Что касается продукта, у нас есть два атома железа и три атома кислорода.
Когда вы записываете количество продуктов, вы можете видеть, что уравнение не сбалансировано, потому что есть разные количества каждого атома на стороне реагента и на стороне продукта.
Это означает, что нам нужно добавить коэффициенты, чтобы сбалансировать это уравнение.
# 3: добавить коэффициенты
Ранее я упоминал, что есть два способа определить, сколько атомов определенного элемента существует в химическом уравнении: взглянув на индексы и взглянув на коэффициенты.
Когда вы уравновешиваете химическое уравнение, вы меняете коэффициенты. Вы никогда не меняете индексы.
Коэффициент — это множитель целого числа. Чтобы сбалансировать химическое уравнение, вы добавляете эти целые числовые множители (коэффициенты), чтобы убедиться, что на каждой стороне стрелки находится одинаковое количество атомов.
Вот что важно помнить о коэффициентах: они применяются к каждой части продукта. Например, возьмите химическое уравнение воды: h3O. Если вы добавили коэффициент, чтобы получилось 2H 2 O, то коэффициент будет кратен для всех присутствующих элементов. Итак, 2H 2 O означает, что у вас есть четыре атома водорода и два атома кислорода. Вы не просто умножаетесь на первый присутствующий элемент.
Итак, в нашем химическом уравнении (Fe + O 2 → Fe 2 O 3 ) любой коэффициент, который вы добавляете к продукту, должен отражаться в реагентах.
Давайте посмотрим, как сбалансировать это химическое уравнение.
Что касается продукта, у нас есть два атома железа и три атома кислорода. Давайте сначала займемся железом.
При первом взгляде на это химическое уравнение вы можете подумать, что работает что-то вроде этого:
2Fe + O 2 → Fe 2 O 3
В то время как это уравновешивает атомы железа (остается по два с каждой стороны), кислород все еще неуравновешен. Это означает, что нам нужно продолжать поиски.
Если взять в первую очередь железо, мы знаем, что будем работать с кратным двум, поскольку на стороне продукта присутствуют два атома железа.
Зная, что использовать два в качестве коэффициента не получится, давайте попробуем следующее кратное двум: четыре.
4Fe + O 2 → 2Fe 2 O 3
Это создает баланс для железа, имея по четыре атома на каждой стороне уравнения. Кислород еще не совсем сбалансирован, но на стороне продукта у нас есть шесть атомов кислорода.Шесть кратно двум, поэтому мы можем работать с этим на стороне реагента, где присутствуют два атома кислорода.
Это означает, что мы можем записать наше сбалансированное химическое уравнение следующим образом:
4Fe + 3O 2 → 3Fe 2 O 3
3 Великие Источники Балансировки Химических Уравнений Практика
Есть много мест, где вы можете практиковать балансирование химических уравнений онлайн.
Вот несколько мест с практическими задачами, которые вы можете использовать:
Уравновешивание химических уравнений: основные выводы
Уравновешивание химических уравнений кажется сложным, но на самом деле это не так уж и сложно!
Ваша основная цель при балансировании химических уравнений — убедиться, что на каждой стороне стрелки химического уравнения присутствует одинаковое количество реагентов и продуктов.
Что дальше?
Ищете другие руководства по химии ? У нас есть статьи, в которых рассматриваются шесть примеров физических и химических изменений, 11 правил растворимости и константа растворимости (K sp ), а также информация по AP Chem, IB Chemistry и Regents Chemistry.
Пишете исследовательскую работу для школы, но не знаете, о чем писать? В нашем справочнике по темам исследовательских работ более 100 тем в десяти категориях, так что вы можете быть уверены, что найдете для себя идеальную тему.
Хотите узнать о самых быстрых и простых способах конвертации между градусами Фаренгейта и Цельсия? Мы вас прикрыли! Ознакомьтесь с нашим руководством по лучшим способам преобразования градусов Цельсия в градусы Фаренгейта (или наоборот).
Вы изучаете облака в своем классе естественных наук? Получите помощь по определению различных типов облаков с помощью нашего экспертного руководства.
ChemTeam: Уравновешивание химических уравнений
3O 2 —> 2O 3Пример # 4a: Na + H 2 O —> NaOH + H 2
В Каркасное уравнение, как написано, Na и O уже уравновешены.Итак, мы смотрим только на H.
Обратите внимание, что буква H должна идти парами с левой стороны. Это означает, что в правой части должно быть четное число водорода. Делаем так:
Na + H 2 O —> 2NaOH + H 2
, чтобы получить четное количество атомов водорода справа. Затем мы балансируем H следующим образом:
Na + 2H 2 O —> 2NaOH + H 2
Обратите внимание, что первое размещение двойки нарушило баланс Na и O.Кроме того, обратите внимание, что второе размещение 2 уравновешивает кислород и водород одновременно.
Последний шаг — уравновесить Na:
2Na + 2H 2 O —> 2NaOH + H 2
и готово.
Вот еще способ. Вернитесь к уравнению скелета и сбалансируйте его следующим образом:
Na + H 2 O —> NaOH + 1 ⁄ 2 H 2
Что вы сделали с 1 ⁄ 2 H 2 , так это уменьшили количество атомов водорода в правой части с 3 до 2.Поскольку все, кроме водорода, уже было сбалансировано, уравнение теперь сбалансировано.
Умножьте на 2, чтобы получить окончательный ответ (в котором не должно быть дробей).
Пример # 4b: Вот еще один пример, в котором вы уменьшаете количество чего-либо, чтобы сбалансировать уравнение:
Na 2 O 2 + H 2 O —> NaOH + O 2
1) Уравновесить натрий:
Na 2 O 2 + H 2 O —> 2NaOH + O 2
2) Обратите внимание, что водород также уравновешивается, если поставить 2 перед NaOH.Восстановление происходит с кислородом:
Na 2 O 2 + H 2 O —> 2NaOH + 1 ⁄ 2 O 2
3) Вы уменьшаете количество кислорода с четырех до трех в правой части:
Na 2 O 2 + H 2 O —> 2NaOH + 1 ⁄ 2 O 2
4) Умножьте на 2, чтобы получить окончательный ответ.
Пример # 4c: Еще одно уменьшение количества, на этот раз на стороне реагента:
SO 2 + O 2 + H 2 O —> H 2 SO 4
1) Обратите внимание, что сера и водород уже уравновешены.Оставь их.
2) Пять атомов кислорода слева и четыре справа. Попытка сбалансировать O с помощью SO 2 , H 2 O или H 2 SO 4 повлияет на баланс S или баланс H.
3) Мы надеемся на O 2 , чтобы спасти нас:
SO 2 + 1 ⁄ 2 O 2 + H 2 O —> H 2 SO 4
4) Теперь уравнение сбалансировано.Для окончательного ответа умножьте на 2.
Пример # 4d: Еще одно уравнение, в котором вы уменьшаете коэффициент, чтобы сбалансировать уравнение:
H 2 O 2 —> H 2 O + O 2
1) Два кислорода слева и три справа. Уменьшать!!
H 2 O 2 —> H 2 O + 1 ⁄ 2 O 2
2) Умножьте на 2, чтобы получить окончательный ответ:
2H 2 O 2 —> 2H 2 O + O 2
Пример № 5: Fe + CuSO 4 -> Cu + FeSO 4
Изучив уравнение, вы увидите, что оно уже сбалансировано.С каждой стороны по одному Fe, по одному Cu, по одному S и четыре атома кислорода (последние два также могут быть идентифицированы как по одному сульфату с каждой стороны).Ничего не нужно делать с этим уравнением. Как написано на бумаге (или экране), он сбалансирован.
Иногда это можно увидеть, используя фразу «сбалансировано, как написано».
Также ученики иногда сбиваются с толку из-за этого типа задач (иногда даже подозревая, что с ними разыгрывается трюк). Во многих случаях ученик видел пример за примером, когда что-то делалось с уравнением, чтобы сбалансировать его.В приведенном выше примере ничего делать не нужно; он уже сбалансирован, как написано.
Вот еще примеры «сбалансированного, как написано»:
C (т) + O 2 (г) —> CO 2 (г)Na 2 SO 3 (водн.) + H 2 SO 4 (водн.) —> Na 2 SO 4 (водн.) + SO 2 (г) + H 2 O (ℓ)
CaCl 2 (водн.) + Pb (NO 3 ) 2 (водн.) —> Ca (NO 3 ) 2 (водн.) + PbCl 2 (с)
CaO (т) + H 2 O () —> Ca (OH) 2 (т)
Hg 2 CO 3 —> Hg + HgO + CO 2
HCl + NaOH —> NaCl + H 2 O
HCOOH + NaOH —> HCOONa + H 2 O
Cu + CO 2 —> CuO + CO
Иногда писатель будет использовать «сбалансировано, как написано» для любого старого уравнения, которое уже сбалансировано (с использованием коэффициентов), когда оно представлено вам.ChemTeam предпочитает использовать этот термин только для уравнений, которые никогда не нуждаются в балансировке. Другими словами, для реакций, которые уравновешиваются с использованием только коэффициентов единицы.
Пример № 6: Zn + HCl —> ZnCl 2 + H 2
Изучив это уравнение, вы увидите, что на каждой стороне уравнения уже есть по одному Zn. Мы постараемся оставить его в покое, если это вообще возможно, поскольку он уже сбалансирован.С правой стороны мы видим два хлора и два атома водорода, по одному слева. Если поставить двойку перед HCl, количество хлора и водорода в левой части удвоится.
Теперь у нас остается два хлора и два атома водорода с каждой стороны стрелки, что делает их сбалансированными.
Поскольку цинк уже был сбалансирован, теперь все уравнение сбалансировано.
Zn + 2HCl —> ZnCl 2 + H 2
Пример № 7a: KClO 3 —> KCl + O 2
Начните с того, что обратите внимание, что K и Cl УЖЕ сбалансированы в скелетном уравнении.Однако кислород не сбалансирован: три слева и два справа.Важно подчеркнуть, что кислород слева будет увеличиваться только ступенями по три, тогда как кислород справа будет увеличиваться только с шагом два. Задайте себе вопрос: «Какое наименьшее общее кратное между 2 и 3?» Ответ конечно шесть. Нам нужно по шесть атомов кислорода на каждой стороне уравнения. Мы используем двойку с левой стороны, поскольку 2 x 3 = 6, и мы используем тройку с правой стороны, поскольку 3 x 2 = 6.
Это приводит к разбалансировке K и Cl, но установка двойки перед KCl с правой стороны исправляет это.
Эта проблема интересна, потому что вы в первую очередь сосредоточились на кислороде. Обычно кислород является последним (или предпоследним) элементом, который необходимо сбалансировать.
2KClO 3 —> 2KCl + 3O 2
Другой способ сбалансировать это уравнение — использовать дробный коэффициент:
KClO 3 —> KCl + 3 ⁄ 2 O 2
И за один этап балансировка.Затем вы умножаете на 2, чтобы получить полный набор коэффициентов, 2, 2, 3 чуть выше.
Пример # 7b: KClO 3 —> KClO 4 + KCl
Какое наименьшее общее кратное между 3 и 4? Правильно, 12. Посмотрите это:4KClO 3 —> 3KClO 4 + KCl
И это сбалансировано. Просто так. Довольно ловко, да?
Пример # 7c: H 3 PO 3 —> H 3 PO 4 + PH 3
Другой пример, где LCM равно 12:4H 3 PO 3 —> 3H 3 PO 4 + PH 3
И готово.
Пример № 8: S 8 + F 2 —> SF 6
Восьмерка перед SF 6 уравновесит серу.Это теперь дает нам 48 фтора с правой стороны, так как 8 x 6 = 48. Используйте 24 перед F 2 , поскольку 24 x 2 также равняется 48.
S 8 + 24F 2 —> 8SF 6
Пример № 9: Fe + O 2 —> Fe 2 O 3
В несбалансированном уравнении было только одно Fe слева и два справа.Если поставить двойку перед Fe слева, утюги будут сбалансированы.Ситуация с уравновешиванием кислорода довольно обычна. Вы видели это в предыдущем примере. В этот раз попробую выложить пошагово.
- Кислород слева поступает ТОЛЬКО парами, а кислород справа — ТОЛЬКО тройками.
- Мы должны получить равное количество кислорода. (Помните, что мы можем изменить только значение коэффициента. Мы не можем изменить нижний индекс.)
- Наименьшее общее кратное между двумя и тремя — шесть.Это означает, что нам потребуется по шесть атомов кислорода с каждой стороны уравнения.
- Чтобы получить это, мы ставим тройку перед O 2 , так как 3 x 2 = 6, и ставим двойку перед Fe 2 O 3 , поскольку 2 x 3 = 6.
Fe было сбалансировано, но стало неуравновешенным в результате нашей работы с кислородом. Поставив четверку перед Fe слева, решит эту проблему.
4Fe + 3O 2 —> 2Fe 2 O 3Это уравнение также можно было уравновесить с помощью дробного коэффициента:
2Fe + 3 ⁄ 2 O 2 —> Fe 2 O 3Затем умножьте на 2, чтобы получить коэффициенты для окончательного ответа, показанного выше.
Пример № 10: C 2 H 6 + O 2 —> CO 2 + H 2 O
Сначала сбалансируйте угли с помощью двойки перед CO 2 . Затем уравновесите атомы водорода с помощью тройки перед H 2 O. Это оставляет следующее уравнение:C 2 H 6 + O 2 —> 2CO 2 + 3H 2 OОстается уравновесить только кислород, но есть проблема.В правой части уравнения семь атомов кислорода, НО кислород входит только в группу из двух атомов слева. Другими словами, с помощью O 2 невозможно создать нечетное число атомов кислорода.
Однако это верно, только если вы использовали целочисленные коэффициенты. Допускается использование коэффициентов FRACTIONAL в процессе балансировки. Это означает, что я могу использовать семь половин в качестве коэффициента, чтобы сбалансировать это уравнение, например:
C 2 H 6 + 7 ⁄ 2 O 2 —> 2CO 2 + 3H 2 OКак правило, дробный коэффициент в окончательном ответе не сохраняется.Умножение коэффициентов на два избавляет от дроби. вот окончательный ответ:
2C 2 H 6 + 7O 2 —> 4CO 2 + 6H 2 OТакже следует использовать неправильные дроби, такие как 7 ⁄ 2 , а не смешанные числа, такие как 3 1 ⁄ 2 . Иногда используется десятичная дробь (в данном примере это 3,5). ChemTeam стремится не использовать десятичные значения в коэффициентах, но есть те, кто это предпочитает.Будь готов!
Пример № 11-13: Уравновесите эти три уравнения, используя дробные коэффициенты:
S 8 + F 2 —> SF 6C 4 H 10 + O 2 —> CO 2 + H 2 O
S 8 + O 3 —> SO 2
Решения:
1 ⁄ 8 S 8 + 3F 2 —> SF 6C 4 H 10 + 13 ⁄ 2 O 2 — > 4СО 2 + 5Н 2 О
1 ⁄ 8 S 8 + 2 ⁄ 3 O 3 —> SO 2
Альтернативный ответ для третьего уравнения:
3 ⁄ 8 S 8 + 2O 3 —> 3SO 2
Другая возможность для третьего уравнения:
1 ⁄ 4 S 8 + 4 ⁄ 3 O 3 —> 2SO 2
Вообще говоря, фракции в основном используются с диатомовыми продуктами (с O 2 является наиболее распространенным).Вдобавок, если вы углубитесь в балансировку, вы даже можете увидеть что-то вроде 1 ⁄ 2 H 2 O, используемое на этапе балансировки, но вы никогда не увидите это как окончательный ответ.
Пример # 14a: H 2 + O 3 —> H 2 O
Однако вы должны уравновесить это с одним ограничением: коэффициент перед водой должен быть равен единице.
Решение:
1) Отсутствие фракции для баланса водорода:
H 2 + O 3 —> H 2 OДве H слева, две H справа.
2) Фракция для уравновешивания кислорода:
H 2 + 1 ⁄ 3 O 3 —> H 2 O1 ⁄ 3 O 3 означает одну букву O слева и одну букву O справа.
Балансировка с использованием дробного коэффициента 1 ⁄ 3 необычна, но время от времени вы ее видите. Особенно, если учитель пытается сбить вас с толку. Скажем, используя 1 ⁄ 2 все время, но затем внезапно на тесте будет 1 ⁄ 3 или 5 ⁄ 2 .Учителя подлые! (Ну, по крайней мере, мы так думаем!)
Пример # 14b: Na + NH 3 —> NaNH 2 + H 2 (остаток с дробью)
Решение:
Na + NH 3 —> NaNH 2 + 1 ⁄ 2 H 2И затем умножить на 2.
Обратите внимание, как использование фракции уменьшает количество атомов водорода в правой части.Обычно вы увеличиваете количество атомов на одной стороне, чтобы получить равенство с другой стороной. Однако бывают случаи, когда уменьшение количества может быть эффективно использовано. Это одна из них.
Пример # 15a: P 4 + O 2 —> P 2 O 5
Однако уравновесите его одним ограничением: коэффициент перед P 2 O 5 должно быть единицей.
Решение:
1) Сбалансируйте P:
1 ⁄ 2 P 4 + O 2 —> P 2 O 5
2) Сбалансируйте O:
1 ⁄ 2 P 4 + 5 ⁄ 2 O 2 —> P 2 O 5
Вот еще один для баланса:
P 4 + H 2 —> PH 3
Удерживая коэффициент PH 3 равным единице, мы получаем ответ:
1 ⁄ 4 P 4 + 3 ⁄ 2 H 2 —> PH 3
Пример № 15b: N 2 + O 2 —> N 2 O 5
Решение № 1:
1) Смотрите только на кислород, так как азот уже сбалансирован.Обратите внимание, что 10 — это наименее распространенное кратное между 2 и 5:
N 2 + 5O 2 —> 2N 2 O 5
2) Зафиксируйте азот:
2N 2 + 5O 2 —> 2N 2 O 5Выполнено.
Решение № 2:
1) Используйте фракцию, чтобы уравновесить кислород:
N 2 + 5 ⁄ 2 O 2 —> N 2 O 5
2) Умножьте на 2, чтобы очистить дробь:
2N 2 + 5O 2 —> 2N 2 O 5Выполнено.
Пример # 16: KFe 3 AlSi 3 O 10 (OH) 2 + Cu + O 2 + H 2 S —> KAlSi 3 O 8 + CuFeS 2 + H 2 О
Решение:
Выглядит довольно круто, не правда ли? Перед балансировкой изучите уравнение и обратите внимание:
a) K, Al и Si уже сбалансированы.
б) Уравновесить Fe легко.
c) Буква H находится только в одном месте справа.
г) О везде. Оставьте это до последнего.
1) Имея это в виду, сбалансируйте Fe, затем Cu:
KFe 3 AlSi 3 O 10 (OH) 2 + 3Cu + O 2 + H 2 S —> KAlSi 3 O 8 + 3CuFeS 2 + H 2 O
2) Теперь S:
KFe 3 AlSi 3 O 10 (OH) 2 + 3Cu + O 2 + 6H 2 S —> KAlSi 3 O 8 + 3CuFeS 2 + H 2 O
3) K, Al и Si уже уравновешены, осталось разобраться только с H и O.Из двух H — самый простой, всего 14 слева. Итак, 7 справа уравновешивает H:
KFe 3 AlSi 3 O 10 (OH) 2 + 3Cu + O 2 + 6H 2 S —> KAlSi 3 O 8 + 3CuFeS 2 + 7H 2 O
4) Теперь посчитайте количество кислорода справа, чтобы получить 15. Посчитайте слева, чтобы получить 14. Нам нужен еще один кислород слева:
KFe 3 AlSi 3 O 10 (OH) 2 + 3Cu + 3 ⁄ 2 O 2 + 6H 2 S —> KAlSi 3 O 8 + 3CuFeS 2 + 7H 2 OОбратите внимание, что я использовал 3 ⁄ 2 .Это потому, что мне нужен был еще один атом кислорода в дополнение к тому, что уже было. То, что уже было, было одной молекулой O 2 (представьте себе это как 2 ⁄ 2 O 2 ). Увеличение с 2 ⁄ 2 до 3 ⁄ 2 — это еще один атом.
5) Умножьте на два, чтобы получить окончательный ответ:
2KFe 3 AlSi 3 O 10 (OH) 2 + 6Cu + 3O 2 + 12H 2 S —> 2KAlSi 3 O 8 + 6CuFeS 2 + 14H 2 O
Пример № 17: SiO 2 + CaC 2 —> Si + CaO + CO 2
Раствор:
1) Сбалансируйте C:
SiO 2 + CaC 2 —> Si + CaO + 2CO 2
2) Единственный элемент, который нужно уравновесить, — это кислород.Я использую дробь, чтобы сбалансировать это:
5 ⁄ 2 SiO 2 + CaC 2 —> Si + CaO + 2CO 2
3) Сбалансируйте Si:
5 ⁄ 2 SiO 2 + CaC 2 —> 5 ⁄ 2 Si + CaO + 2CO 2
4) Умножьте, чтобы очистить дробь:
5SiO 2 + 2CaC 2 —> 5Si + 2CaO + 4CO 2
Вы могли протестовать против 5 ⁄ 2 , используемого с Si.Вы могли бы сказать: «Но у вас не может быть дробных атомов» или «Но у вас не может быть 5 ⁄ 2 атома».
Эти утверждения верны, но обратите внимание, что 5 ⁄ 2 просто используется как шаг на пути к окончательному ответу. 5 ⁄ 2 не представляется в качестве окончательного ответа.
Кроме того, существует дополнительное понимание химических уравнений, о котором вы, возможно, еще не знали. Химические уравнения можно понять на основе химического измерения, называемого «моль».«Совершенно правильно сказать, что у меня есть 5 ⁄ 2 моля Si.
Если вы еще не совсем уверены, что такое родинка, ничего страшного. Дайте ему немного больше времени и изучите.
Пример № 18: NH 3 (г) + O 2 (г) —> NO 2 (г) + H 2 O (г)
Решение:
1) Азот уже сбалансирован, поэтому оставьте их в покое. Кислород находится в трех из четырех соединений, тогда как водород находится только в одном реагенте и одном продукте.И это не сбалансировано. Сбалансируйте водород:
2NH 3 (г) + O 2 (г) —> NO 2 (г) + 3H 2 O (г)Помните, 6 — это наименьшее общее кратное между 2 и 3.
2) Уравновешивание водородов нарушило баланс азота. Сбалансируйте азот:
2NH 3 (г) + O 2 (г) —> 2NO 2 (г) + 3H 2 O (г)
3) Теперь мы готовы уравновесить кислород:
2NH 3 (г) + 7 ⁄ 2 O 2 (г) —> 2НО 2 (г) + 3H 2 O (г)
4) Умножьте на 2, чтобы очистить дробь:
4NH 3 (г) + 7O 2 (г) —> 4NO 2 (г) + 6H 2 O (г)
5) Обратите внимание, что обычный способ балансировки — это оставить кислород / водород до конца.Это правило время от времени «нарушается», и это уравнение является хорошим тому примером.
Пример № 19: MgNH 4 PO 4 —> Mg 2 P 2 O 7 + NH 3 + H 2 O
Решение:
1) Сбалансируйте магний:
2MgNH 4 PO 4 —> Mg 2 P 2 O 7 + NH 3 + H 2 OЭто также уравновешивает фосфор.
2) Сбалансируйте азот:
2MgNH 4 PO 4 —> Mg 2 P 2 O 7 + 2NH 3 + H 2 O
3) Изучите ситуацию с водородом и кислородом и обнаружите, что они оба сбалансированы по 8 единиц каждого из них. Уравнение теперь сбалансировано.
Пример № 20: Баланс:
PCl 5 + H 2 O —> H 3 PO 4 + HCl
с использованием метода LCM.
Решение:
Когда я впервые увидел этот вопрос, я подумал: «Хорошо, какое-нибудь наименее распространенное множественное действие. Я знаю, как это сделать:
PCl 5 + 3H 2 O —> 2H 3 PO 4 + HCl
Когда я смотрел на это, планируя свой следующий шаг, меня внезапно осенило: автор вопроса (который не является ChemTeam) пытается запутать голову своих учеников, указав использование LCM.
На самом деле нет хорошего способа уравновесить это уравнение с помощью LCM.В конце концов, приведенный выше шаг LCM даже не уравновешивает H. А если вы попытаетесь сбалансировать H, вы испортите его еще больше. И кислород полностью испорчен.
Следует использовать метод без LCM.
Балансировка путем уравновешивания сначала кислорода. Нравится:
PCl 5 + 4H 2 O —> H 3 PO 4 + HCl (сбалансированный по кислороду)PCl 5 + 4H 2 O —> H 3 PO 4 + 5HCl (водородный баланс, также хлор)
Балансировка путем уравновешивания в первую очередь хлора.Нравится:
PCl 5 + H 2 O —> H 3 PO 4 + 5HCl (сбалансировано по хлору)PCl 5 + 4H 2 O —> H 3 PO 4 + 5HCl (водородный баланс, также кислород)
Следующее уравнение не очень хорошо согласуется с идеей LCM:
PCl 3 + H 2 O —> H 3 PO 3 + HCl
Пример бонуса №1: Баланс:
K 4 Fe (CN) 6 + H 2 SO 4 + H 2 O —> K 2 SO 4 + FeSO 4 + (NH 4 ) 2 SO 4 + CO
Решение:
Примечание: похоже, что это может быть сложное окислительно-восстановительное уравнение, включающее три полуреакции (основанные на Fe, C и N).Однако, когда вы исследуете степень окисления каждого элемента, вы обнаружите, что ничего не меняется. (Кстати, если вы понятия не имеете, что такое степень окисления или полуреакция, не беспокойтесь об этом. Вы узнаете их достаточно скоро!)
1) K, Fe, N и C переходят от одного реагента к одному продукту. Сбалансируйте их все:
K 4 Fe (CN) 6 + H 2 SO 4 + H 2 O —> 2K 2 SO 4 + FeSO 4 + 3 (NH 4 ) 2 SO 4 + 6CO
2) Сульфат присутствует только в одном месте в качестве реагента.Сложите сульфаты в правой части и сбалансируйте:
K 4 Fe (CN) 6 + 6H 2 SO 4 + H 2 O —> 2K 2 SO 4 + FeSO 4 + 3 (NH 4 ) 2 SO 4 + 6CO
3) Единственные оставшиеся элементы — это H в сульфате аммония и O в монооксиде углерода. Подсчитайте их, чтобы получить 24 H и 6 O. 12 H приходится на серную кислоту, поэтому уравновесите остальное (12 H и 6 O), используя воду слева:
K 4 Fe (CN) 6 + 6H 2 SO 4 + 6H 2 O —> 2K 2 SO 4 + FeSO 4 + 3 (NH 4 ) 2 SO 4 + 6CO
Пример бонуса № 2: C 3 H 7 S () + O 2 (г) —> CO 2 (г) + H 2 O (ℓ) + SO 2 (г)
Решение:
1) Уравновесить углерод:
C 3 H 7 S () + O 2 (г) —> 3CO 2 (г) + H 2 O (ℓ) + SO 2 (г)
2) Уравновесить водород фракцией:
C 3 H 7 S (ℓ) + O 2 (г) —> 3CO 2 (г) + 7 ⁄ 2 H 2 O (ℓ) + SO 2 (г)
3) Очистить дробь:
2C 3 H 7 S () + 2O 2 (г) —> 6CO 2 (г) + 7H 2 O (ℓ) + 2SO 2 (г)
4) Подсчитайте количество кислорода справа, чтобы найти 23.
