как получить в 2021 году
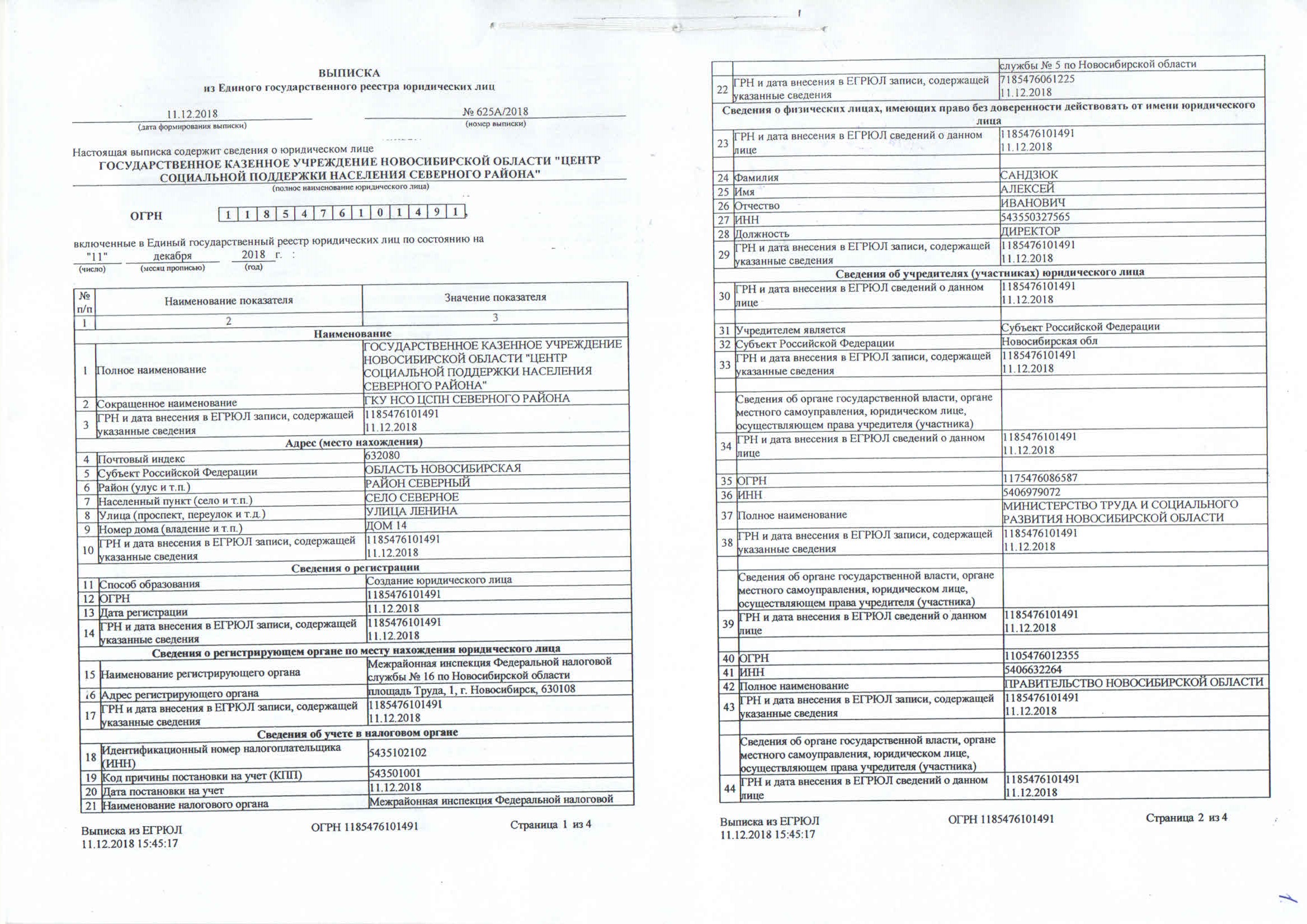
Единый государственный реестр юридических лиц — федеральный информационный ресурс, который содержит общие сведения о юрлицах на территории Российской Федерации. Проще говоря, это краткая биография организаций со всеми юридически значимыми событиями.
Ольга Макеева
юрист
Профиль автораРеестр ведет Федеральная налоговая служба с 1 июля 2002 года на бумажном и электронном носителях. Если сведения электронного реестра отличаются от сведений в документах, на основании которых информация включена в ЕГРЮЛ, преимущество имеют данные из таких документов.
ст. 4 ФЗ о госрегистрации юрлиц и ИП
Содержащиеся в реестре сведения о юрлице предоставляются в виде выписки из ЕГРЮЛ. Как правило, это многостраничный документ. Также можно оформить доступ ко всему ЕГРЮЛ. Обычно такой услугой пользуются организации, которым нужно часто обращаться к содержанию госреестра.
Какие бывают
Выписки из ЕГРЮЛ бывают электронными и бумажными — они полностью равнозначны.
Электронную, подписанную усиленной квалифицированной электронной подписью, можно получить бесплатно через интернет на сайте ФНС.
Данные из ЕГРЮЛ на бумажном носителе выдает налоговая инспекция. Это документ с голубой печатью и подписью должностного лица налоговой службы.
Образец выписки из ЕГРЮЛ АО «Тинькофф Банк». Первая страница в электронном видеКогда нужны
Выписка из ЕГРЮЛ нужна, если необходимо ознакомиться с информацией о конкретном юрлице, например узнать его местонахождение, участников, данные о генеральном директоре или деятельности конкретной организации.
Выписка на бумажном носителе пригодится для подачи заявки на участие в открытом конкурсе или закрытом аукционе.
Выписку из ЕГРЮЛ также может попросить нотариус для совершения некоторых нотариальных действий, например оформления договора купли-продажи доли в компании. Банк попросит такую бумагу для открытия счета или получения кредита.
пп. ж п. 1 ч. 1 ст. 43 ФЗ о контрактной системе
Электронную выписку, подписанную усиленной квалифицированной подписью, можно получить бесплатно и гораздо быстрее. А поскольку она юридически равнозначна бумажной, предпочтение, как правило, отдается ей.
А поскольку она юридически равнозначна бумажной, предпочтение, как правило, отдается ей.
Какие сведения содержат
Из ЕГРЮЛ можно получить следующую информацию и документы о юрлице:
- Полное и сокращенное наименование и организационно-правовая форма — ООО, ПАО, АО и т. д.
- Адрес.
- Способ образования — создание или реорганизация.
- Сведения об учредителях и участниках.
- В отношении общества с ограниченной ответственностью — сведения о размерах доли в уставном капитале общества по каждому участнику, о передаче доли или ее части в залог, в доверительное управление, а также информация о доверительном управляющем долей.
- В отношении акционерного общества — сведения о том, что общество состоит из единственного акционера, сведения об этом участнике и о держателе реестра акционеров общества.
- Сведения о деятельности на основании типового устава.
- Сведения о правопреемстве, если юрлицо создано или прекращено в результате реорганизации либо продолжает действовать в результате реорганизации.

- Способ прекращения деятельности.
- Сведения о том, что юрлицо находится в процессе ликвидации, или о возбуждении производства по делу о банкротстве юрлица.
- Размер уставного капитала или складочного капитала, уставного фонда, паевых взносов или другого капитала.
- ФИО, должность и паспортные данные лиц, которые вправе действовать от имени юрлица без доверенности.
- Сведения о лицензиях.
- Сведения о филиалах и представительствах.
- ИНН, КПП и дата постановки на учет в налоговом органе.
- Коды по ОКВЭД.
- Номер и дата регистрации в качестве страхователя в территориальном органе ПФР и в исполнительном органе ФСС.
- Сведения о том, что юрлицо находится в процессе реорганизации или уменьшения уставного капитала.
С 26 апреля 2021 года вступают в силу изменения в законе о госрегистрации юрлиц и ИП. Содержание ЕГРЮЛ будет скорректировано, но несущественно.
Стоимость получения
Как получить электронную выписку ЕГРЮЛ
Выписку из ЕГРЮЛ может получить любое лицо на основании запроса в электронном виде или в письменной форме.
Как получить выписку из ЕГРЮЛ через госуслуги. Чтобы получить электронную выписку на портале госуслуг:
- Войдите в личный кабинет.
- Нажмите «Получить услугу».
- Введите ИНН. Поле ОГРН можно не заполнять.
- Нажмите «Подать заявление».
Сначала вам в ЛК придет уведомление, что заявление принято, потом — что услуга оказана. Выписку можно будет загрузить из личного кабинета. Вся операция занимает несколько минут.
Как получить выписку из ЕГРЮЛ через СБИС. Любая организация с лицензией «Все о компаниях и владельцах» может посмотреть и сохранить данные ЕГРЮЛ по своей компании или по контрагенту.
Для этого в разделе «Компании» найдите организацию, сведения о которой хотите посмотреть. Нажмите «ЕГРЮЛ». Это будет информационная сводка, не имеющая юридической силы.
Чтобы запросить выписку из ЕГРЮЛ с электронной подписью, в карточке организации нажмите «Отчеты» и выберите «Выписка с подписью». Для этого нужно иметь лицензию «Все о компаниях и владельцах», тариф «Расширенные сведения» или лицензию «Поиск и анализ закупок», тариф «Расширенный».
Для этого нужно иметь лицензию «Все о компаниях и владельцах», тариф «Расширенные сведения» или лицензию «Поиск и анализ закупок», тариф «Расширенный».
Как получить выписку из ЕГРЮЛ через МФЦ. Если получать документ в МФЦ, срок выдачи увеличится до 7—10 дней. Через МФЦ можно получить выписку как в бумажном виде, так и в электронном.
Как получить выписку из ЕГРЮЛ через сайт налоговой. На сайте ФНС России есть электронный сервис «Предоставление сведений из ЕГРЮЛ/ЕГРИП о конкретном юридическом лице / индивидуальном предпринимателе в форме электронного документа».
Там необходимо указать ИНН, ОГРН или наименование организации и регион, в котором находится юрлицо. Выписка будет сформирована в формате PDF и подписана усиленной квалифицированной электронной подписью. Такой документ равнозначен данным ЕГРЮЛ на бумажном носителе с печатью и подписью должностного лица налогового органа.
Письмо ФНС России от 11.
Как получить бумажную выписку
Чтобы получить бумажную выписку из ЕГРЮЛ, нужно составить запрос в произвольной форме и направить его в налоговую инспекцию по почте или отнести лично.
В запросе на получение данных ЕГРЮЛ нужно указать:
- Наименование налоговой инспекции, в которую направляется запрос.
- Данные юрлица, в отношении которого запрашиваются сведения: полное или сокращенное наименование, ОГРН и ИНН.
- Сведения о заявителе: полное или сокращенное наименование юрлица либо ФИО гражданина, номер контактного телефона, почтовый адрес или адрес электронной почты.
- Сведения об удобном способе получения ответа.
- Указание, если необходимо, на срочное получение выписки.
- Количество необходимых экземпляров.
Как получить расширенную выписку
Расширенная выписка содержит больше информации, чем обычная. Но она включает персональные данные (например, личную информацию об участниках компании) и другую ограниченную для доступа информацию, поэтому любым лицам не выдается.
Но она включает персональные данные (например, личную информацию об участниках компании) и другую ограниченную для доступа информацию, поэтому любым лицам не выдается.
Получить расширенную выписку из ЕГРЮЛ можно только на самого себя, то есть на то юрлицо, директором или участником которого вы являетесь. Запрос на получение расширенной выписки аналогичен запросу на получение обычной, только нужно указать, что требуются расширенные данные.
Сроки действия
Формально выписка из ЕГРЮЛ действительна только в день выдачи, потому что уже на следующий день в реестр могут быть внесены новые сведения.
Получать каждый день новые выписки затруднительно, поэтому закон устанавливает сроки действия в зависимости от конкретного случая. Для большинства случаев документ действителен в течение месяца с даты предоставления, но сроки лучше уточнить в организации, куда представляется выписка.
Правила заполнения заявки, или как сверить заявку с документами
Правила заполнения заявкиЭлектронная подпись в документах приравнивается к собственноручной. Поэтому в заявке на ЭП должны быть указаны реальные данные. Большую часть реквизитов можно найти в электронном варианте выписки из ЕГРЮЛ/ЕГРИП, данные владельца — в паспорте.
Поэтому в заявке на ЭП должны быть указаны реальные данные. Большую часть реквизитов можно найти в электронном варианте выписки из ЕГРЮЛ/ЕГРИП, данные владельца — в паспорте.
| Реквизиты в заявке/ Данные в сертификате | Обязательные поля | Документы, с которыми необходимо сверить | Правила заполнения полей | |
| ЮЛ | ФЛ | |||
Наименование организации |
|
| ||
Адрес |
|
| ||
ИНН |
|
| ||
КПП |
|
| ||
ОГРН |
| |||
ФИО владельца |
|
| ||
| ||||
Данные документа, удостоверяющего личность владельца ЭП |
|
| ||
СНИЛС |
| |||
Должность |
| |||
Подразделение | ||||
Нашли неточность? Выделите текст с ошибкой и нажмите ctrl + enter..jpg)
Как получить выписку из ЕГРЮЛ бесплатно — Контур.Экстерн — СКБ Контур
Прежде чем получать выписку ЕГРЮЛ, важно определить, какая именно выписка нужна: юридически значимая или информационная.
Если необходима юридически значимая выписка, для этого нужно обратиться к специализированному сервису Федеральной налоговой службы на портале nalog.ru.
Благодаря сервису вы можете в режиме онлайн запросить и бесплатно получить информацию из ЕГРЮЛ об интересующем юридическом лице. Информация будет представлена в виде электронной выписки либо справки об отсутствии запрашиваемых сведений, которые в свою очередь будут подписаны УКЭП (усиленной квалифицированной электронной подписью) контролирующего органа — Федеральной налоговой службы.
Чтобы получить выписку, налогоплательщику не потребуется сертификат электронной подписи и регистрация. Выписка формируется в виде PDF-файла с усиленной квалифицированной электронной подписью ФНС и ее визуальным изображением, которое отразится и на распечатанной выписке.
Эта электронная выписка обладает юридической значимостью, равной аналогичной выписке на бумаге. Ее можно использовать при аккредитации на крупнейших ЭТП: пяти федеральных площадках госзаказа (Сбербанк-АСТ, ЕЭТП, ОСЭТ ZakazRF, ММВБ «Госзакупки», РТС тендер), а также коммерческих площадках — B2B-Center, «Фабрикант», «Газпромбанк», «ТЭК-Торг» и других.
Как получить выписку из ЕГРЮЛ
- Войти на сайт, регистрироваться не обязательно.
- Сформировать поисковый запрос: указать ИНН, ОГРН/ОГРНИП, наименование организации или ФИО ИП.
- Выбрать регион, чтобы ограничить зону поиска совпадений.
- В результатах поиска появятся все компании и предприниматели, данные которых совпадают с введенными.
- Нажать кнопку «Получить выписку», чтобы скачать PDF-файл с электронной подписью налоговой.
Информационная выписка
Пользуйтесь всеми возможностями Контур. Экстерна
Экстерна
Чтобы получить выписку:
- в Контур.Экстерне нужно выбрать в меню справа «Сервисы для бухгалтеров» пункт «Выписки из ЕГРЮЛ, ЕГРИП и проверка контрагентов»,
- указать ИНН, ОГРН, название или адрес.
После этого появится список, в котором есть совпадения с введенными данными. Нужно войти в необходимую карточку, нажать на «Сформировать выписку по состоянию на сегодня» в разделе «Выписка из ЕГРЮЛ/ЕГРИП». Затем выписку можно распечатать.
Сведения из ЕГРЮЛ
В выписке по юридическому лицу будет представлена следующая информация:
- действующее/не действующее предприятие;
- наименование;
- ИНН/КПП;
- ОГРН;
- ОКПО;
- дата образования;
- юридический адрес;
- ФИО директора;
- виды деятельности;
- ФИО учредителей, размер и доли уставного капитала;
- свидетельства;
- регистрационные номера во внебюджетных фондах и другие сведения.

Отчитывайтесь во все
контролирующие органы
| Азербайджанский | с азербайджанского на русский 3 ₽/слово ~750 ₽/страница с русского на азербайджанский 3.1 ₽/слово ~775 ₽/страница с русского на азербайджанский $0.085/слово ~$21.25/страница |
| Албанский | с албанского на русский 2.4 ₽/слово ~600 ₽/страница с русского на албанский 2. ~700 ₽/страница с русского на албанский $0.1/слово ~$25/страница |
| Английский | с английского на русский 2.4 ₽/слово ~600 ₽/страница с русского на английский 2.4 ₽/слово ~600 ₽/страница с русского на английский $0.11/слово ~$27.5/страница |
| Арабский | с арабского на русский 3.7 ₽/слово ~925 ₽/страница с русского на арабский 4. ~1075 ₽/страница с русского на арабский $0.12/слово ~$30/страница |
| Армянский | с армянского на русский 2.6 ₽/слово ~650 ₽/страница с русского на армянский 2.8 ₽/слово ~700 ₽/страница с русского на армянский $0.1/слово ~$25/страница |
| Белорусский | с белорусского на русский 2.4 ₽/слово ~600 ₽/страница с русского на белорусский 2. ~600 ₽/страница с русского на белорусский |
| Бенгальский | с бенгальского на русский 5 ₽/слово ~1250 ₽/страница с русского на бенгальский 5.5 ₽/слово ~1375 ₽/страница с русского на бенгальский $0.1/слово ~$25/страница |
| Болгарский | с болгарского на русский 2.6 ₽/слово ~650 ₽/страница с русского на болгарский 2. ~725 ₽/страница с русского на болгарский $0.1/слово ~$25/страница |
| Боснийский | с боснийского на русский 3.2 ₽/слово ~800 ₽/страница с русского на боснийский 3.6 ₽/слово ~900 ₽/страница с русского на боснийский 0.1€/слово ~25€/страница |
| Венгерский | с венгерского на русский 6 ₽/слово ~1500 ₽/страница с русского на венгерский 6 ₽/слово ~1500 ₽/страница с русского на венгерский 0. ~30€/страница |
| Вьетнамский | с вьетнамского на русский 5 ₽/слово ~1250 ₽/страница с русского на вьетнамский 5 ₽/слово ~1250 ₽/страница с русского на вьетнамский $0.12/слово ~$30/страница |
| Греческий | с греческого на русский 4 ₽/слово ~1000 ₽/страница с русского на греческий 4 ₽/слово ~1000 ₽/страница с русского на греческий $0. ~$30/страница |
| Грузинский | с грузинского на русский 2.8 ₽/слово ~700 ₽/страница с русского на грузинский 3.2 ₽/слово ~800 ₽/страница с русского на грузинский $0.11/слово ~$27.5/страница |
| Датский | с датского на русский 4 ₽/слово ~1000 ₽/страница с русского на датский 5 ₽/слово ~1250 ₽/страница с русского на датский 0. ~67.5€/страница |
| Иврит | с иврита на русский 5.6 ₽/слово ~1400 ₽/страница с русского на иврит 4.8 ₽/слово ~1200 ₽/страница с русского на иврит 0.1€/слово ~25€/страница |
| Индонезийский | с индонезийского на русский 4.4 ₽/слово ~1100 ₽/страница с русского на индонезийский 6 ₽/слово ~1500 ₽/страница с русского на индонезийский $0. ~$35/страница |
| Исландский | с исландского на русский 12 ₽/слово ~3000 ₽/страница с русского на исландский 0 ₽/слово ~0 ₽/страница с русского на исландский 0.15€/слово ~37.5€/страница |
| Испанский | с испанского на русский 3 ₽/слово ~750 ₽/страница с русского на испанский 3.5 ₽/слово ~875 ₽/страница с русского на испанский 0. ~25€/страница |
| Итальянский | с итальянского на русский 3.8 ₽/слово ~950 ₽/страница с русского на итальянский 4 ₽/слово ~1000 ₽/страница с русского на итальянский 0.09€/слово ~22.5€/страница |
| Казахский | с казахского на русский 2.8 ₽/слово ~700 ₽/страница с русского на казахский 2.8 ₽/слово ~700 ₽/страница с русского на казахский |
| Киргизский | с киргизского на русский 3 ₽/слово ~750 ₽/страница с русского на киргизский 3 ₽/слово ~750 ₽/страница с русского на киргизский |
| Китайский | с китайского на русский 4. ~1225 ₽/страница с русского на китайский 4.9 ₽/слово ~1225 ₽/страница с русского на китайский $0.15/слово ~$37.5/страница |
| Корейский | с корейского на русский 4.9 ₽/слово ~1225 ₽/страница с русского на корейский 4.9 ₽/слово ~1225 ₽/страница с русского на корейский $0.23/слово ~$57.5/страница |
| Кхмерский | с кхмерского на русский 6 ₽/слово ~1500 ₽/страница с русского на кхмерский 8 ₽/слово ~2000 ₽/страница с русского на кхмерский 0. ~37.5€/страница |
| Латышский | с латышского на русский 3 ₽/слово ~750 ₽/страница с русского на латышский 3.1 ₽/слово ~775 ₽/страница с русского на латышский $0.12/слово ~$30/страница |
| Литовский | с литовского на русский 2.8 ₽/слово ~700 ₽/страница с русского на литовский 3.3 ₽/слово ~825 ₽/страница с русского на литовский 0. ~30€/страница |
| Македонский | с македонского на русский 3.5 ₽/слово ~875 ₽/страница с русского на македонский 3.5 ₽/слово ~875 ₽/страница с русского на македонский $0.12/слово ~$30/страница |
| Малайский | с малайского на русский 4.4 ₽/слово ~1100 ₽/страница с русского на малайский 6 ₽/слово ~1500 ₽/страница с русского на малайский $0. ~$37.5/страница |
| Маратхи | с маратхи на русский 0 ₽/слово ~0 ₽/страница с русского на маратхи 0 ₽/слово ~0 ₽/страница с русского на маратхи $0.15/слово ~$37.5/страница |
| Молдавский | с молдавского на русский 2.2 ₽/слово ~550 ₽/страница с русского на молдавский 3 ₽/слово ~750 ₽/страница с русского на молдавский $0/слово ~$0/страница |
| Монгольский | с монгольского на русский 3. ~950 ₽/страница с русского на монгольский 4.6 ₽/слово ~1150 ₽/страница с русского на монгольский $0.15/слово ~$37.5/страница |
| Немецкий | с немецкого на русский 2.4 ₽/слово ~600 ₽/страница с русского на немецкий 2.6 ₽/слово ~650 ₽/страница с русского на немецкий 0.11€/слово ~27.5€/страница |
| Нидерландский | с нидерландского на русский 3. ~925 ₽/страница с русского на нидерландский 3.7 ₽/слово ~925 ₽/страница с русского на нидерландский 0.15€/слово ~37.5€/страница |
| Норвежский | с норвежского на русский 5.4 ₽/слово ~1350 ₽/страница с русского на норвежский 6 ₽/слово ~1500 ₽/страница с русского на норвежский 0.13€/слово ~32.5€/страница |
| Персидский | с персидского на русский 5. ~1400 ₽/страница с русского на персидский 5.6 ₽/слово ~1400 ₽/страница с русского на персидский $0.11/слово ~$27.5/страница |
| Польский | с польского на русский 3.3 ₽/слово ~825 ₽/страница с русского на польский 3.4 ₽/слово ~850 ₽/страница с русского на польский 0.15€/слово ~37.5€/страница |
| Португальский | с португальского на русский 3. ~925 ₽/страница с русского на португальский 4 ₽/слово ~1000 ₽/страница с русского на португальский 0.1€/слово ~25€/страница |
| Пушту | с пушту на русский 4.5 ₽/слово ~1125 ₽/страница с русского на пушту 4.5 ₽/слово ~1125 ₽/страница с русского на пушту $0.15/слово ~$37.5/страница |
| Румынский | с румынского на русский 2. ~550 ₽/страница с русского на румынский 3 ₽/слово ~750 ₽/страница с русского на румынский $0/слово ~$0/страница |
| Сербский | с сербского на русский 3.2 ₽/слово ~800 ₽/страница с русского на сербский 3.6 ₽/слово ~900 ₽/страница с русского на сербский 0.1€/слово ~25€/страница |
| Словацкий | с словацкого на русский 3 ₽/слово ~750 ₽/страница с русского на словацкий 3. ~800 ₽/страница с русского на словацкий 0.1€/слово ~25€/страница |
| Словенский | с словенского на русский 3.3 ₽/слово ~825 ₽/страница с русского на словенский 3.5 ₽/слово ~875 ₽/страница с русского на словенский 0.095€/слово ~23.75€/страница |
| Таджикский | с таджикского на русский 3 ₽/слово ~750 ₽/страница с русского на таджикский 3. ~800 ₽/страница с русского на таджикский $0.05/слово ~$12.5/страница |
| Тайский | с тайского на русский 4.4 ₽/слово ~1100 ₽/страница с русского на тайский 5 ₽/слово ~1250 ₽/страница с русского на тайский $0.13/слово ~$32.5/страница |
| Турецкий | с турецкого на русский 3.2 ₽/слово ~800 ₽/страница с русского на турецкий 3. ~875 ₽/страница с русского на турецкий $0.09/слово ~$22.5/страница |
| Туркменский | с туркменского на русский 3.4 ₽/слово ~850 ₽/страница с русского на туркменский 3.6 ₽/слово ~900 ₽/страница с русского на туркменский $0.05/слово ~$12.5/страница |
| Узбекский | с узбекского на русский 2.8 ₽/слово ~700 ₽/страница с русского на узбекский 3. ~775 ₽/страница с русского на узбекский $0.05/слово ~$12.5/страница |
| Украинский | с украинского на русский 2.4 ₽/слово ~600 ₽/страница с русского на украинский 2.4 ₽/слово ~600 ₽/страница с русского на украинский |
| Урду | с урду на русский 0 ₽/слово ~0 ₽/страница с русского на урду 0 ₽/слово ~0 ₽/страница с русского на урду $0. ~$37.5/страница |
| Финский | с финского на русский 5.5 ₽/слово ~1375 ₽/страница с русского на финский 6 ₽/слово ~1500 ₽/страница с русского на финский $0.12/слово ~$30/страница |
| Французский | с французского на русский 2.6 ₽/слово ~650 ₽/страница с русского на французский 2.8 ₽/слово ~700 ₽/страница с русского на французский 0. ~21.25€/страница |
| Хинди | с хинди на русский 7 ₽/слово ~1750 ₽/страница с русского на хинди 8 ₽/слово ~2000 ₽/страница с русского на хинди $0.1/слово ~$25/страница |
| Хорватский | с хорватского на русский 3.2 ₽/слово ~800 ₽/страница с русского на хорватский 3.6 ₽/слово ~900 ₽/страница с русского на хорватский 0. ~20€/страница |
| Черногорский | с черногорского на русский 3.2 ₽/слово ~800 ₽/страница с русского на черногорский 3.6 ₽/слово ~900 ₽/страница с русского на черногорский 0.1€/слово ~25€/страница |
| Чешский | с чешского на русский 3.4 ₽/слово ~850 ₽/страница с русского на чешский 3.8 ₽/слово ~950 ₽/страница с русского на чешский 0. ~20€/страница |
| Шведский | с шведского на русский 3 ₽/слово ~750 ₽/страница с русского на шведский 3.1 ₽/слово ~775 ₽/страница с русского на шведский 0.18€/слово ~45€/страница |
| Эстонский | с эстонского на русский 3.8 ₽/слово ~950 ₽/страница с русского на эстонский 7.8 ₽/слово ~1950 ₽/страница с русского на эстонский 0€/слово ~0€/страница |
| Японский | с японского на русский 4. ~1125 ₽/страница с русского на японский 4.9 ₽/слово ~1225 ₽/страница с русского на японский $0.11/слово ~$27.5/страница |
Как получить выписку из реестра акционеров
Хранитель таблицы участников ПО по просьбе надлежащего заявителя (имеющего полномочия) обязан сформировать выписку из списка соакционеров не позднее 3 дней после получения такой просьбы. Выписка должна соответствовать всем требованиям, которые предъявляет ЦБ РФ.
Чтобы понять, кто имеет право запросить список участников хозяйственного общества и кому хранитель реестра не имеет права отказать, нужно обратиться к законам, регулирующим финансовый рынок. Исходя из буквального прочтения законодательства, можно выделить всего две категории заявителей, которые имеют право на запрос:
- Любой соакционер компании;
- Не участник компании, но номинальный держатель акций.

Если с первой категорий все понятно, то со второй категорией нужно разобраться. Номинальным держателем называют лицо, которое не является собственником ценной бумаги, но хранит их под своим именем по поручению фактического собственника. Номинальный держателем может быть организация (как российская, так и иностранная) имеющая специальную лицензию. Отношения реального собственника и номинального держателя должны быть зафиксированы договором.
К выводу о том, что запросить выписку из реестра могут только бенефициары и номинальные держатели, неоднократно приходили и суды. Так в 2009 г. ОАО «Районное агропромышленное общество «Лебяжское» подало иск в арбитражный суд против ООО «Союз-Агро» и ООО «Иллария» о признании недействительным договора перевода долга от 20.05.2009 N 14. Истец настаивал на том, что одна из сторон договора перевода долга, а именно ООО «Союз-Агро», знала о наличии заинтересованности соучастника ОАО «РАО «Лебяжское» в оспариваемой сделке. Судья пришел к выводу, что ООО «Союз-Агро» не являлось ни реальным ни номинальным владельцем акций ОАО «РАО «Лебяжское». Поэтому, исходя из законодательства, ООО «Союз-Агро» не имела возможности получить данные об участниках истца и объеме их ценных бумаг от хранителя реестра. Исходя из этого, суд отказал в иске.
Поэтому, исходя из законодательства, ООО «Союз-Агро» не имела возможности получить данные об участниках истца и объеме их ценных бумаг от хранителя реестра. Исходя из этого, суд отказал в иске.
| Тип регулирования | Каннабис съедобный (употребление в пищу или питье) | Экстракт каннабиса (при приеме внутрь) | Экстракт конопли (ингаляции) | Каннабис местно (нанесение на кожу, волосы, ногти) |
|---|---|---|---|---|
| Предел ТГК |
|
|
| |
| Правила продукта |
|
|
|
|
| Упаковка |
|
| ||
| Этикетка |
|
|
|
|
| Прочее |
|
|
|
|
Регламент FDA в отношении каннабиса и продуктов, полученных из каннабиса, включая каннабидиол (КБД)
На этой странице:
Существует значительный интерес к разработке лекарственных средств и других потребительских товаров, полученных из каннабиса и его компонентов, включая каннабидиол (КБД). FDA признает потенциальные возможности, которые может предложить каннабис или соединения, полученные из каннабиса, и признает значительный интерес к этим возможностям. Тем не менее, FDA известно, что некоторые компании продают продукты, содержащие каннабис и соединения, полученные из каннабиса, способами, которые нарушают Федеральный закон о пищевых продуктах, лекарствах и косметике (Закон FD&C) и могут поставить под угрозу здоровье и безопасность потребителей. Агентство стремится защищать здоровье населения, а также предпринимает шаги по повышению эффективности механизмов регулирования для законного маркетинга соответствующего каннабиса и продуктов, полученных из каннабиса.У FDA есть ряд доступных ресурсов, посвященных каннабису и продуктам, полученным из каннабиса, таким как CBD, и агентство хочет обеспечить, чтобы потребители и другие заинтересованные стороны имели доступ к этим ресурсам в централизованном месте.
FDA признает потенциальные возможности, которые может предложить каннабис или соединения, полученные из каннабиса, и признает значительный интерес к этим возможностям. Тем не менее, FDA известно, что некоторые компании продают продукты, содержащие каннабис и соединения, полученные из каннабиса, способами, которые нарушают Федеральный закон о пищевых продуктах, лекарствах и косметике (Закон FD&C) и могут поставить под угрозу здоровье и безопасность потребителей. Агентство стремится защищать здоровье населения, а также предпринимает шаги по повышению эффективности механизмов регулирования для законного маркетинга соответствующего каннабиса и продуктов, полученных из каннабиса.У FDA есть ряд доступных ресурсов, посвященных каннабису и продуктам, полученным из каннабиса, таким как CBD, и агентство хочет обеспечить, чтобы потребители и другие заинтересованные стороны имели доступ к этим ресурсам в централизованном месте.
Информация для потребителей
Связь с Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов
Нормативные ресурсы
Вопросы и ответы
Ниже приведены часто задаваемые вопросы и ответы по этой теме.
- Что такое каннабис и марихуана?
- Как Закон о фермерских хозяйствах 2018 года определяет коноплю? Что это означает для продуктов, регулируемых FDA?
- Одобрено ли FDA какие-либо медицинские продукты, содержащие каннабис или производные от каннабиса соединения, такие как CBD?
- Помимо Epidiolex, существуют ли другие лекарственные препараты CBD, одобренные FDA? Как насчет продуктов, которые я видел в магазинах или в Интернете?
- Почему FDA не одобрило больше продуктов, содержащих каннабис или соединения, полученные из каннабиса, для медицинского применения?
- Какова реакция FDA на штаты, разрешающие продажу каннабиса для медицинских целей без одобрения FDA?
- Получало ли агентство какие-либо сообщения о нежелательных явлениях, связанных с употреблением каннабиса в медицинских целях?
- Законно ли мне продавать продукты CBD?
- Могут ли продукты THC или CBD продаваться в качестве пищевых добавок?
- Законно ли в торговле между штатами продавать продукты питания (включая любые корма или корма для животных), в которые были добавлены ТГК или КБД?
- Почему FDA сделало два предыдущих заключения о ТГК и сделало вывод, что ТГК является активным ингредиентом лекарственного препарата, который был одобрен в соответствии с разделом 505 Закона о FD&C? Почему, принимая два предыдущих решения о КБД, FDA определило, что существенные клинические исследования были разрешены и / или начаты, и что существование таких исследований было обнародовано?
- Можно ли использовать в пищу человека очищенные семена конопли, белковый порошок семян конопли и масло семян конопли?
- Какова позиция FDA в отношении каннабиса и ингредиентов, полученных из каннабиса, в косметике?
- Примет ли FDA меры против каннабиса или продуктов, связанных с каннабисом, которые нарушают Закон FD&C?
- Могу ли я импортировать или экспортировать продукты, содержащие или полученные из каннабиса?
- Какова роль FDA, когда речь идет об исследовании каннабиса и продуктов, полученных из каннабиса, для медицинского использования?
- Возражает ли FDA против клинических исследований каннабиса в медицинских целях?
- Как пациенты могут получить доступ к каннабису или продуктам, полученным из каннабиса, для медицинского использования посредством расширенного доступа?
- Могут ли пациенты получить доступ к каннабису или продуктам, полученным из каннабиса, для медицинского использования в рамках права на попытку?
- Есть ли у FDA опасения по поводу применения продуктов каннабиса для детей?
- Есть ли у FDA опасения по поводу назначения продукта каннабиса беременным и кормящим женщинам?
- Что FDA думает о том, чтобы сделать КБД доступным для детей с эпилепсией?
- Что делать, если мой ребенок съел что-то, содержащее каннабис?
- Я видел продукты каннабиса, которые продаются для домашних животных.
.jpg) Безопасны ли они?
Безопасны ли они? - Можно ли добавлять коноплю в корм для животных?
- Могут ли одобренные препараты для людей, содержащие КБД или синтетический ТГК, использоваться дополнительно для животных?
1. Что такое каннабис и марихуана?
A. Cannabis — растение семейства Cannabaceae, содержащее более восьмидесяти биологически активных химических соединений. Наиболее известными соединениями являются дельта-9-тетрагидроканнабинол (ТГК) и каннабидиол (КБД). Части растения Cannabis sativa контролируются в соответствии с Законом о контролируемых веществах (CSA) с 1970 года в рамках класса наркотиков «Марихуана» (обычно называемая «марихуаной») [21 U.SC 802 (16)]. «Марихуана» занесена в Список I CSA из-за ее высокого потенциала злоупотребления, что в значительной степени связано с психоактивными эффектами ТГК, а также отсутствием в настоящее время принятого медицинского использования растения в США.
2. Какое определение конопли дает Закон о фермерских хозяйствах 2018 года? Что это означает для продуктов, регулируемых FDA?
Какое определение конопли дает Закон о фермерских хозяйствах 2018 года? Что это означает для продуктов, регулируемых FDA?
A. На федеральном уровне Закон об улучшении сельского хозяйства от 2018 г., опубл. L. 115-334 (Законопроект о фермерских хозяйствах 2018 г.) был подписан в декабре.20, 2018. Среди прочего, этот новый закон изменяет некоторые федеральные полномочия, касающиеся производства и сбыта конопли, определяемой как «растение Cannabis sativa L. и любая часть этого растения, включая его семена и все производные, экстракты, каннабиноиды, изомеры, кислоты, соли и соли изомеров, растущие или нет, с концентрацией дельта-9-тетрагидроканнабинола не более 0,3 процента в пересчете на сухую массу». Эти изменения включают удаление конопли из CSA, что означает, что растения каннабиса и производные, содержащие не более 0.3 процента ТГК в пересчете на сухую массу больше не являются контролируемыми веществами в соответствии с федеральным законом.
Законопроект о фермерских хозяйствах 2018 года, однако, явно сохранил полномочия FDA по регулированию продуктов, содержащих каннабис или соединения, полученные из каннабиса, в соответствии с Законом FD&C и разделом 351 Закона об общественном здравоохранении (Закон PHS). FDA относится к продуктам, содержащим каннабис или соединения, полученные из каннабиса, так же, как и к любым другим продуктам, регулируемым FDA, то есть к ним применяются те же органы и требования, что и к регулируемым FDA продуктам, содержащим любое другое вещество.Это верно независимо от того, классифицируются ли каннабис или соединения, полученные из каннабиса, как конопля в соответствии с Законом о фермерских хозяйствах 2018 года.
FDA относится к продуктам, содержащим каннабис или соединения, полученные из каннабиса, так же, как и к любым другим продуктам, регулируемым FDA, то есть к ним применяются те же органы и требования, что и к регулируемым FDA продуктам, содержащим любое другое вещество.Это верно независимо от того, классифицируются ли каннабис или соединения, полученные из каннабиса, как конопля в соответствии с Законом о фермерских хозяйствах 2018 года.
3. Одобрено ли FDA какие-либо медицинские продукты, содержащие каннабис или производные от каннабиса соединения, такие как КБД?
A. На сегодняшний день агентство не одобрило маркетинговую заявку на каннабис для лечения какого-либо заболевания или состояния. Однако FDA одобрило один препарат, полученный из каннабиса, и три препарата, связанных с каннабисом.Эти одобренные продукты доступны только по рецепту от лицензированного поставщика медицинских услуг.
FDA одобрило Epidiolex, который содержит очищенную форму лекарственного вещества CBD для лечения судорог, связанных с синдромом Леннокса-Гасто или синдромом Драве, у пациентов в возрасте 1 года и старше. Он также одобрил Epidiolex для лечения судорог, связанных с комплексом туберозного склероза, у пациентов в возрасте 1 года и старше. Это означает, что FDA пришло к выводу, что этот конкретный лекарственный продукт безопасен и эффективен для предполагаемого использования.
Он также одобрил Epidiolex для лечения судорог, связанных с комплексом туберозного склероза, у пациентов в возрасте 1 года и старше. Это означает, что FDA пришло к выводу, что этот конкретный лекарственный продукт безопасен и эффективен для предполагаемого использования.
Агентство также одобрило Marinol и Syndros для терапевтического использования в Соединенных Штатах, в том числе для лечения анорексии, связанной с потерей веса у больных СПИДом. Marinol и Syndros включают активный ингредиент дронабинол, синтетический дельта-9-тетрагидроканнабинол (THC), который считается психоактивным компонентом каннабиса. Другой одобренный FDA препарат, Cesamet, содержит активный ингредиент набилон, который имеет химическую структуру, аналогичную ТГК, и получен синтетическим путем.
4. Помимо Epidiolex, существуют ли другие лекарственные препараты CBD, одобренные FDA? Как насчет продуктов, которые я видел в магазинах или в Интернете?
A. Нет. Других одобренных FDA лекарственных средств, содержащих CBD, не существует. Нам известно, что некоторые фирмы продают продукты CBD для лечения заболеваний или для других терапевтических целей, и мы направили таким фирмам несколько писем с предупреждениями. В соответствии с Законом о FD&C любой продукт, предназначенный для терапевтического или медицинского применения, и любой продукт (кроме продуктов питания), предназначенный для воздействия на структуру или функцию организма человека или животного, является лекарственным средством.Как правило, лекарства должны либо получить допродажное одобрение FDA в процессе подачи заявки на новое лекарство (NDA), либо соответствовать «монографии» для конкретной категории лекарств, установленной FDA’s Over-the-Counter (OTC) Drug Review. CBD не был ингредиентом, рассматриваемым в обзоре безрецептурных препаратов. Неутвержденный новый препарат не может распространяться или продаваться в торговле между штатами.
Нам известно, что некоторые фирмы продают продукты CBD для лечения заболеваний или для других терапевтических целей, и мы направили таким фирмам несколько писем с предупреждениями. В соответствии с Законом о FD&C любой продукт, предназначенный для терапевтического или медицинского применения, и любой продукт (кроме продуктов питания), предназначенный для воздействия на структуру или функцию организма человека или животного, является лекарственным средством.Как правило, лекарства должны либо получить допродажное одобрение FDA в процессе подачи заявки на новое лекарство (NDA), либо соответствовать «монографии» для конкретной категории лекарств, установленной FDA’s Over-the-Counter (OTC) Drug Review. CBD не был ингредиентом, рассматриваемым в обзоре безрецептурных препаратов. Неутвержденный новый препарат не может распространяться или продаваться в торговле между штатами.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) по-прежнему обеспокоено распространением продуктов, в которых утверждается, что они содержат КБД, которые продаются для терапевтического или медицинского применения, хотя они и не были одобрены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов. Часто такие продукты продаются в Интернете и поэтому доступны по всей стране. Продажа неутвержденных продуктов с необоснованными терапевтическими заявлениями является не только нарушением закона, но и может подвергнуть пациентов риску, поскольку безопасность или эффективность этих продуктов не доказана. Этот вводящий в заблуждение маркетинг недоказанных методов лечения также вызывает серьезную обеспокоенность общественного здравоохранения, поскольку пациенты и другие потребители могут быть вынуждены отказаться от использования утвержденных методов лечения для лечения серьезных и даже смертельных заболеваний.
Часто такие продукты продаются в Интернете и поэтому доступны по всей стране. Продажа неутвержденных продуктов с необоснованными терапевтическими заявлениями является не только нарушением закона, но и может подвергнуть пациентов риску, поскольку безопасность или эффективность этих продуктов не доказана. Этот вводящий в заблуждение маркетинг недоказанных методов лечения также вызывает серьезную обеспокоенность общественного здравоохранения, поскольку пациенты и другие потребители могут быть вынуждены отказаться от использования утвержденных методов лечения для лечения серьезных и даже смертельных заболеваний.
В отличие от лекарств, одобренных FDA, продукты, которые не были рассмотрены FDA в рамках процесса утверждения лекарств, не оценивались на предмет того, работают ли они, какова может быть правильная дозировка, если они действительно работают, как они могут взаимодействовать с другими наркотиков, или имеют ли они опасные побочные эффекты или другие проблемы безопасности.
Агентство продолжает и будет продолжать следить за рынком и принимать необходимые меры для защиты общественного здоровья от компаний, незаконно продающих каннабис и продукты, полученные из каннабиса, которые могут подвергнуть потребителей риску и которые продаются для терапевтических целей, для которых они не предназначены. одобренный.В то же время FDA признает потенциальные терапевтические возможности, которые может предложить каннабис или соединения, полученные из каннабиса, и признает значительный интерес к этим возможностям. FDA по-прежнему считает, что процесс утверждения лекарств представляет собой лучший способ гарантировать, что безопасные и эффективные новые лекарства, включая любые препараты, полученные из каннабиса, будут доступны для пациентов, нуждающихся в соответствующей медицинской терапии. Центр по оценке и исследованию наркотиков (CDER) стремится поддерживать разработку новых наркотиков, в том числе каннабиса и препаратов, полученных из каннабиса, в рамках процесса исследования нового препарата (IND) и утверждения препарата (см. Вопрос № 16).
одобренный.В то же время FDA признает потенциальные терапевтические возможности, которые может предложить каннабис или соединения, полученные из каннабиса, и признает значительный интерес к этим возможностям. FDA по-прежнему считает, что процесс утверждения лекарств представляет собой лучший способ гарантировать, что безопасные и эффективные новые лекарства, включая любые препараты, полученные из каннабиса, будут доступны для пациентов, нуждающихся в соответствующей медицинской терапии. Центр по оценке и исследованию наркотиков (CDER) стремится поддерживать разработку новых наркотиков, в том числе каннабиса и препаратов, полученных из каннабиса, в рамках процесса исследования нового препарата (IND) и утверждения препарата (см. Вопрос № 16).
5. Почему FDA не одобрило больше продуктов, содержащих каннабис или соединения, полученные из каннабиса, для медицинского применения?
A. FDA известно, что неутвержденный каннабис или продукты, полученные из каннабиса, используются для лечения ряда заболеваний, включая, например, истощение при СПИДе, эпилепсию, невропатическую боль, спастичность, связанную с рассеянным склерозом, а также рак и химиотерапию. индуцированная тошнота.
индуцированная тошнота.
На сегодняшний день FDA не одобрило маркетинговую заявку на каннабис для лечения какого-либо заболевания или состояния и, таким образом, не определило, что каннабис безопасен и эффективен при каком-либо конкретном заболевании или состоянии.Однако агентство одобрило один препарат, полученный из каннабиса, и три препарата, связанных с каннабисом (см. Вопрос № 2).
FDA полагается на заявителей и научных исследователей для проведения исследований. Роль агентства, изложенная в Законе о FD&C, заключается в рассмотрении данных, представленных в FDA в заявке на одобрение, чтобы убедиться, что лекарственный продукт соответствует установленным законом стандартам для утверждения.
Изучение каннабиса и соединений, полученных из каннабиса, в условиях клинических испытаний необходимо для оценки безопасности и эффективности этих веществ для лечения любого заболевания или состояния.В Декабрьском 2016 г. Руководство FDA для промышленности: разработка ботанических лекарственных препаратов содержит конкретные рекомендации по представлению IND для растительных лекарственных препаратов, например, полученных из каннабиса, в поддержку будущих маркетинговых приложений для этих продуктов. В проекте руководства агентства от июля 2020 года «Каннабис и соединения, производные от каннабиса: рекомендации по качеству для клинических исследований в промышленности» подчеркиваются соображения качества для всех, кто хочет проводить клинические исследования в этой области, особенно для тех, кто менее знаком с FDA.
В проекте руководства агентства от июля 2020 года «Каннабис и соединения, производные от каннабиса: рекомендации по качеству для клинических исследований в промышленности» подчеркиваются соображения качества для всех, кто хочет проводить клинические исследования в этой области, особенно для тех, кто менее знаком с FDA.
FDA продолжит содействовать работе компаний, заинтересованных в надлежащем выводе на рынок безопасных, эффективных и качественных продуктов, включая научно обоснованные исследования, касающиеся медицинского применения каннабиса. Дополнительную информацию об исследованиях использования каннабиса в медицинских целях можно получить в Национальных институтах здравоохранения, в частности в Национальном институте рака (NCI) и Национальном институте по борьбе со злоупотреблением наркотиками (NIDA).
6. Какова реакция FDA на штаты, разрешающие продажу каннабиса для медицинских целей без одобрения FDA?
А.FDA известно, что несколько штатов либо приняли законы, отменяющие государственные ограничения на использование каннабиса и его производных в медицинских целях, либо рассматривают возможность принятия этого закона. Важно проводить медицинские исследования безопасности и эффективности продуктов каннабиса посредством адекватных и хорошо контролируемых клинических испытаний. Мы приветствуем возможность поговорить со штатами, которые рассматривают возможность поддержки медицинских исследований каннабиса и его производных, чтобы мы могли предоставить информацию о федеральных и научных стандартах.
Важно проводить медицинские исследования безопасности и эффективности продуктов каннабиса посредством адекватных и хорошо контролируемых клинических испытаний. Мы приветствуем возможность поговорить со штатами, которые рассматривают возможность поддержки медицинских исследований каннабиса и его производных, чтобы мы могли предоставить информацию о федеральных и научных стандартах.
7. Получало ли агентство какие-либо отчеты о нежелательных явлениях, связанных с употреблением каннабиса по медицинским показаниям?
A. Агентство получило сообщения о побочных эффектах у пациентов, использующих каннабис или продукты, полученные из каннабиса, для лечения заболеваний. FDA рассматривает такие отчеты и будет продолжать отслеживать сообщения о нежелательных явлениях на предмет каких-либо сигналов безопасности, уделяя особое внимание серьезным неблагоприятным последствиям. Потребители и поставщики медицинских услуг могут сообщать о нежелательных явлениях, связанных с каннабисом или продуктами, полученными из каннабиса, через систему отчетности FDA MedWatch либо онлайн, либо по телефону 1-800-FDA-1088. Для получения дополнительной информации посетите веб-страницу FDA на MedWatch.
Для получения дополнительной информации посетите веб-страницу FDA на MedWatch.
Информация из отчетов о нежелательных явлениях относительно употребления каннабиса крайне ограничена; FDA в первую очередь получает отчеты о нежелательных явлениях для одобренных продуктов. Общая информация о потенциальных побочных эффектах употребления каннабиса и его компонентов может быть получена из опубликованных клинических испытаний, а также из спонтанных сообщений о нежелательных явлениях, отправленных в FDA. Необходима дополнительная информация о безопасности и эффективности каннабиса и его компонентов.Клинические испытания каннабиса, проводимые по заявке IND, могли бы собрать эту важную информацию в рамках процесса разработки лекарств.
8. Законно ли мне продавать продукты CBD?
A. Это зависит, среди прочего, от предполагаемого использования продукта и от того, как он маркируется и продается. Даже если продукт CBD соответствует определению «конопля» в соответствии с Законом о фермерских хозяйствах 2018 года (см. Вопрос № 2), он все равно должен соответствовать всем другим применимым законам, включая Закон FD&C.Приведенные ниже вопросы и ответы объясняют некоторые способы, которыми определенные части Закона о FD&C могут повлиять на законность продуктов CBD.
Вопрос № 2), он все равно должен соответствовать всем другим применимым законам, включая Закон FD&C.Приведенные ниже вопросы и ответы объясняют некоторые способы, которыми определенные части Закона о FD&C могут повлиять на законность продуктов CBD.
Нам известно, что государственные и местные органы власти задают многочисленные вопросы о законности КБР. Постоянно ведется общение с официальными лицами штата и местными властями, чтобы ответить на вопросы о требованиях в соответствии с Законом о FD&C, чтобы лучше понять ситуацию на уровне штата и иным образом взаимодействовать с партнерами по регулированию на уровне штата/местном уровне.
9. Могут ли продукты THC или CBD продаваться в качестве пищевых добавок?
A. Нет. На основании имеющихся доказательств FDA пришло к выводу, что продукты THC и CBD исключены из определения пищевых добавок в соответствии с разделом 201(ff)(3)(B) Закона FD&C [21 U.S.C. § 321(ff)(3)(B)]. В соответствии с этим положением, если вещество (например, ТГК или КБД) является активным ингредиентом лекарственного препарата, который был одобрен в соответствии с разделом 505 Закона о FD&C [21 U. S.C. § 355] или было разрешено к исследованию в качестве нового лекарственного средства, для которого были начаты существенные клинические исследования и для которого было обнародовано существование таких исследований, то продукты, содержащие это вещество, исключаются из определения пищевой добавки.FDA считает, что вещество «разрешено для исследования в качестве нового лекарства», если оно является предметом заявки на получение нового исследуемого лекарства (IND), которая вступила в силу. В соответствии с правилами FDA (21 CFR 312.2), если клиническое исследование не соответствует ограниченным критериям этого правила, IND требуется для всех клинических исследований продуктов, подпадающих под действие раздела 505 Закона FD&C.
S.C. § 355] или было разрешено к исследованию в качестве нового лекарственного средства, для которого были начаты существенные клинические исследования и для которого было обнародовано существование таких исследований, то продукты, содержащие это вещество, исключаются из определения пищевой добавки.FDA считает, что вещество «разрешено для исследования в качестве нового лекарства», если оно является предметом заявки на получение нового исследуемого лекарства (IND), которая вступила в силу. В соответствии с правилами FDA (21 CFR 312.2), если клиническое исследование не соответствует ограниченным критериям этого правила, IND требуется для всех клинических исследований продуктов, подпадающих под действие раздела 505 Закона FD&C.
Существует исключение из раздела 201(ff)(3)(B), если вещество «продавалось» как пищевая добавка или как обычный пищевой продукт до того, как лекарство было одобрено или до того, как были разрешены исследования новых лекарств, в зависимости от обстоятельств. Однако на основании имеющихся данных FDA пришло к выводу, что это не относится к ТГК или КБД.
Однако на основании имеющихся данных FDA пришло к выводу, что это не относится к ТГК или КБД.
Управлению по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) не известны какие-либо доказательства, которые могли бы поставить под сомнение его текущие выводы о том, что продукты с ТГК и КБД исключены из определения пищевых добавок в соответствии с разделом 201(ff)(3)(B) Закона FD&C. Заинтересованные стороны могут представить агентству любые доказательства, которые, по их мнению, имеют отношение к этому вопросу. Наш постоянный анализ информации, которая была представлена до сих пор, не заставил нас изменить наши выводы.
Если вещество исключено из определения пищевой добавки в соответствии с разделом 201(ff)(3)(B) Закона FD&C, исключение применяется, если FDA, по усмотрению агентства, не выпустило постановление после уведомления и комментариев, обнаружив что статья будет законной в соответствии с Законом о FD&C. На сегодняшний день такие правила не были изданы ни для одного вещества.
Ингредиенты, полученные из частей растения каннабис, не содержащие ТГК или КБД, могут не подпадать под действие этого исключения и, следовательно, могут продаваться как пищевые добавки.Тем не менее, все продукты, продаваемые как пищевые добавки, должны соответствовать всем применимым законам и правилам, регулирующим пищевые добавки. Например, производители и дистрибьюторы, желающие продавать пищевые добавки, содержащие «новые пищевые ингредиенты» (т. е. пищевые ингредиенты, которые не продавались в Соединенных Штатах в составе пищевых добавок до 15 октября 1994 г.), как правило, должны уведомить FDA об этих ингредиентах ( см. раздел 413(d) Закона FD&C [21 USC § 350b(d)]).Как правило, уведомление должно включать информацию, демонстрирующую, что пищевая добавка, содержащая новый диетический ингредиент, будет разумно считаться безопасной при условиях использования, рекомендованных или предложенных на этикетке. Пищевая добавка считается фальсифицированной, если она содержит новый пищевой ингредиент, по которому нет достаточной информации для обеспечения разумной уверенности в том, что этот ингредиент не представляет значительного или необоснованного риска заболевания или травмы (см. раздел 402(f)(1)(B) Закона о FD&C [21 U.SC 342(f)(1)(B)]).
раздел 402(f)(1)(B) Закона о FD&C [21 U.SC 342(f)(1)(B)]).
К пищевым добавкам применяются многочисленные другие юридические требования, в том числе требования, касающиеся Текущей надлежащей производственной практики (CGMP) и маркировки. Информацию об этих требованиях, а также о требованиях FDA по всем направлениям продукции можно найти на веб-сайте FDA.
10. Законно ли в торговле между штатами продавать продукты питания (включая любые продукты или корма для животных), в которые были добавлены ТГК или КБД?
А.Нет. Согласно разделу 301(ll) Закона о FD&C [21 U.S.C. § 331(ll)], запрещается ввозить или поставлять для введения в межгосударственную торговлю любые пищевые продукты (включая любые корма или корма для животных), в которые было добавлено вещество, являющееся активным ингредиентом лекарственного препарата, одобренного в соответствии с раздел 505 Закона FD&C [21 USC § 355] или лекарство, в отношении которого были начаты существенные клинические исследования и о существовании которых стало известно. Имеются исключения, в том числе когда лекарство продавали в пищевых продуктах до того, как оно было одобрено, или до того, как были начаты существенные клинические исследования, связанные с лекарством, или, в случае корма для животных, когда лекарство является новым лекарством для животных, одобренным для использования в кормить и использовать в соответствии с утвержденной маркировкой. Однако, основываясь на имеющихся доказательствах, FDA пришло к выводу, что ничего из этого не относится к ТГК или КБД. Таким образом, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) пришло к выводу, что введение или поставка для продажи между штатами любых пищевых продуктов (включая любые корма или корма для животных), в которые были добавлены ТГК или КБД, является запрещенным действием.FDA не известно о каких-либо доказательствах, которые могли бы поставить под сомнение эти выводы. Заинтересованные стороны могут представить агентству любые доказательства, которые, по их мнению, имеют отношение к этому вопросу.
Имеются исключения, в том числе когда лекарство продавали в пищевых продуктах до того, как оно было одобрено, или до того, как были начаты существенные клинические исследования, связанные с лекарством, или, в случае корма для животных, когда лекарство является новым лекарством для животных, одобренным для использования в кормить и использовать в соответствии с утвержденной маркировкой. Однако, основываясь на имеющихся доказательствах, FDA пришло к выводу, что ничего из этого не относится к ТГК или КБД. Таким образом, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) пришло к выводу, что введение или поставка для продажи между штатами любых пищевых продуктов (включая любые корма или корма для животных), в которые были добавлены ТГК или КБД, является запрещенным действием.FDA не известно о каких-либо доказательствах, которые могли бы поставить под сомнение эти выводы. Заинтересованные стороны могут представить агентству любые доказательства, которые, по их мнению, имеют отношение к этому вопросу. Наш постоянный анализ информации, которая была представлена до сих пор, не заставил нас изменить наши выводы.
Наш постоянный анализ информации, которая была представлена до сих пор, не заставил нас изменить наши выводы.
Когда этот законодательный запрет применяется к веществу, он запрещает ввоз в межгосударственную торговлю любых пищевых продуктов, в которые было добавлено это вещество, если только Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) по усмотрению агентства не издало постановление, одобряющее использование вещества в пищевых продуктах (раздел 301(ll)(2) Закона о FD&C [21 U.SC § 331 (II) (2)]). На сегодняшний день такие правила не были изданы ни для одного вещества.
Ингредиенты, полученные из частей растения каннабис, не содержащие ТГК или КБД, могут не подпадать под действие статьи 301(II), и поэтому их можно добавлять в пищу. Например, как обсуждалось в вопросе № 12, некоторые ингредиенты семян конопли могут легально продаваться в продуктах питания человека. Однако все пищевые ингредиенты должны соответствовать всем применимым законам и правилам. Например, по закону любое вещество, преднамеренно добавляемое в пищу, является пищевой добавкой и, следовательно, подлежит предпродажному рассмотрению и одобрению FDA, за исключением случаев, когда вещество в целом признано безопасным (GRAS) квалифицированными экспертами в условиях его предполагаемого использования. или использование вещества иным образом исключено из определения пищевой добавки (разделы 201(s) и 409 Закона FD&C [21 U.S.C. §§ 321(s) и 348]). Помимо трех ингредиентов семян конопли, упомянутых в вопросе № 12, ни один другой каннабис или ингредиенты, полученные из каннабиса, не были предметом петиции о пищевых добавках, оцененного уведомления GRAS или иным образом были одобрены для использования в пищевых продуктах FDA. Продовольственные компании, которые хотят использовать каннабис или ингредиенты, полученные из каннабиса, в своих продуктах питания, подпадают под действие соответствующих законов и правил, регулирующих все пищевые продукты, в том числе те, которые относятся к пищевым добавкам и процессам GRAS.
Например, по закону любое вещество, преднамеренно добавляемое в пищу, является пищевой добавкой и, следовательно, подлежит предпродажному рассмотрению и одобрению FDA, за исключением случаев, когда вещество в целом признано безопасным (GRAS) квалифицированными экспертами в условиях его предполагаемого использования. или использование вещества иным образом исключено из определения пищевой добавки (разделы 201(s) и 409 Закона FD&C [21 U.S.C. §§ 321(s) и 348]). Помимо трех ингредиентов семян конопли, упомянутых в вопросе № 12, ни один другой каннабис или ингредиенты, полученные из каннабиса, не были предметом петиции о пищевых добавках, оцененного уведомления GRAS или иным образом были одобрены для использования в пищевых продуктах FDA. Продовольственные компании, которые хотят использовать каннабис или ингредиенты, полученные из каннабиса, в своих продуктах питания, подпадают под действие соответствующих законов и правил, регулирующих все пищевые продукты, в том числе те, которые относятся к пищевым добавкам и процессам GRAS.
11. При вынесении двух предыдущих определений в отношении ТГК, почему FDA пришло к выводу, что ТГК является активным ингредиентом лекарственного препарата, который был одобрен в соответствии с разделом 505 Закона FD&C? Почему, принимая два предыдущих решения о КБД, FDA определило, что существенные клинические исследования были разрешены и / или начаты, и что существование таких исследований было обнародовано?
A. ТГК (дронабинол) является активным ингредиентом в одобренных лекарственных препаратах, капсулах Marinol (и дженериках) и пероральном растворе Syndros.CBD является активным ингредиентом одобренного лекарственного препарата Epidiolex.
Было обнародовано наличие существенных клинических исследований в отношении ТГК и КБД. Например, два таких существенных клинических исследования включают исследования GW Pharmaceuticals в отношении сативекса. (См. Sativex начинает клинические испытания фазы II/III в США при раковой боли)
12. Можно ли использовать очищенные семена конопли, белковый порошок семян конопли и масло семян конопли в пищу?
Можно ли использовать очищенные семена конопли, белковый порошок семян конопли и масло семян конопли в пищу?
А.В декабре 2018 года FDA завершило оценку трех общепризнанных безопасных (GRAS) уведомлений для следующих пищевых ингредиентов, полученных из семян конопли: очищенных семян конопли, белкового порошка из семян конопли и масла из семян конопли. У FDA не возникло вопросов относительно вывода компании о том, что использование таких продуктов, как описано в уведомлениях, безопасно. Таким образом, эти продукты могут легально продаваться в продуктах питания человека для целей, описанных в уведомлениях, при условии, что они соответствуют всем другим требованиям. Эти уведомления GRAS касались только использования этих ингредиентов в продуктах питания человека.На сегодняшний день FDA не получило никаких уведомлений GRAS об использовании ингредиентов, полученных из конопли, в кормах для животных (см. вопрос № 25).
Семена конопли — это семена растения Cannabis sativa . Семена растения не содержат ТГК или КБД. Ингредиенты, полученные из семян конопли, которые являются предметом этих уведомлений GRAS, содержат только следовые количества ТГК и КБД, которые семена могут собирать во время сбора и обработки, когда они контактируют с другими частями растения.Потребление этих ингредиентов, полученных из семян конопли, не способно вызвать у потребителей «кайф».
Семена растения не содержат ТГК или КБД. Ингредиенты, полученные из семян конопли, которые являются предметом этих уведомлений GRAS, содержат только следовые количества ТГК и КБД, которые семена могут собирать во время сбора и обработки, когда они контактируют с другими частями растения.Потребление этих ингредиентов, полученных из семян конопли, не способно вызвать у потребителей «кайф».
Выводы GRAS могут применяться к ингредиентам пищевых продуктов для человека, продаваемым другими компаниями, если они произведены способом, соответствующим уведомлениям, и соответствуют перечисленным спецификациям. Некоторые из предполагаемых применений этих ингредиентов включают добавление их в качестве источника белка, углеводов, масла и других питательных веществ в напитки (соки, смузи, протеиновые напитки, растительные альтернативы молочным продуктам), супы, соусы, спреды, соусы, заправки, растительные альтернативы мясным продуктам, десерты, выпечка, хлопья, закуски и питательные батончики. Продукты, которые содержат какие-либо из этих ингредиентов, полученных из семян конопли, должны указывать их по названию в списке ингредиентов.
Продукты, которые содержат какие-либо из этих ингредиентов, полученных из семян конопли, должны указывать их по названию в списке ингредиентов.
Эти выводы GRAS не влияют на позицию FDA в отношении добавления КБД и ТГК в пищу.
13. Какова позиция FDA в отношении каннабиса и ингредиентов, полученных из каннабиса, в косметике?
A. Косметическое средство определяется в пункте 201(i) как «(1) изделия, предназначенные для растирания, обливания, разбрызгивания или распыления, введения или иного нанесения на тело человека или любую его часть для очищения, украшения, повышение привлекательности или изменение внешнего вида, и (2) изделия, предназначенные для использования в качестве компонента любых таких изделий, за исключением того, что этот термин не включает мыло.
В соответствии с Законом FD&C, косметические продукты и ингредиенты не подлежат предварительному одобрению FDA, за исключением большинства красящих добавок. Некоторые косметические ингредиенты запрещены или ограничены законодательством, но в настоящее время это не относится к каннабису или ингредиентам, полученным из каннабиса. Ингредиенты, не указанные специально в законодательстве, должны, тем не менее, соответствовать всем применимым требованиям, и ни один ингредиент, включая каннабис или ингредиент, полученный из каннабиса, не может быть использован в косметике, если он каким-либо образом приводит к фальсификации продукта или неправильной торговой марке.Косметическое средство, как правило, является фальсифицированным, если оно несет или содержит какое-либо ядовитое или вредное вещество, которое может нанести вред пользователю при условиях использования, указанных на этикетке, или при таких условиях использования, которые являются обычными или обычными (раздел 601(a) Закон FD&C [21 USC § 361(a)]).
Некоторые косметические ингредиенты запрещены или ограничены законодательством, но в настоящее время это не относится к каннабису или ингредиентам, полученным из каннабиса. Ингредиенты, не указанные специально в законодательстве, должны, тем не менее, соответствовать всем применимым требованиям, и ни один ингредиент, включая каннабис или ингредиент, полученный из каннабиса, не может быть использован в косметике, если он каким-либо образом приводит к фальсификации продукта или неправильной торговой марке.Косметическое средство, как правило, является фальсифицированным, если оно несет или содержит какое-либо ядовитое или вредное вещество, которое может нанести вред пользователю при условиях использования, указанных на этикетке, или при таких условиях использования, которые являются обычными или обычными (раздел 601(a) Закон FD&C [21 USC § 361(a)]).
Если продукт предназначен для воздействия на структуру или функцию организма или для диагностики, лечения, смягчения последствий, лечения или предотвращения заболеваний, он является лекарственным средством или, возможно, одновременно косметическим средством и лекарственным средством, даже если он влияет на внешний вид. (Дополнительную информацию о наркотиках см. в вопросе № 3.)
(Дополнительную информацию о наркотиках см. в вопросе № 3.)
FDA может принять меры, если у него есть информация о том, что ингредиент или косметический продукт небезопасен для потребителей. Потребители могут сообщать о нежелательных явлениях, связанных с косметическими продуктами, через систему отчетности FDA MedWatch либо через Интернет, либо по телефону 1-800-FDA-1088, либо связавшись с координатором жалоб потребителей в ближайшем районном отделении FDA. Для получения дополнительной информации посетите веб-страницу FDA о том, как сообщить о жалобе, связанной с косметикой.
14. Примет ли Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) меры против каннабиса или продуктов, связанных с каннабисом, которые нарушают Закон FD&C?
A. В прошлом FDA разослало предупреждающие письма компаниям, незаконно продающим продукты CBD, которые утверждали, что предотвращают, диагностируют или лечат серьезные заболевания, такие как рак. Некоторые из этих продуктов также нарушали Закон FD&C, потому что они продавались как пищевые добавки или потому что они включали добавление КБД в пищу.
Некоторые из этих продуктов также нарушали Закон FD&C, потому что они продавались как пищевые добавки или потому что они включали добавление КБД в пищу.
Когда продукт нарушает Закон FD&C, FDA учитывает множество факторов при принятии решения о возбуждении принудительных мер. К таким факторам относятся, в том числе, ресурсы ведомства и угроза здоровью населения. FDA также может консультироваться со своими партнерами на федеральном уровне и уровне штата при принятии решений о возбуждении принудительных мер на федеральном уровне.
15. Могу ли я импортировать или экспортировать продукты, содержащие или производные от каннабиса?
А.Общую информацию об импорте/экспорте лекарственных средств, регулируемых FDA, можно найти в Интернете здесь. Управление по борьбе с наркотиками (DEA) является федеральным агентством, ответственным за соблюдение законов и правил о контролируемых веществах в США, и поэтому с ним следует консультироваться в отношении любых правил / требований, которые они могут иметь в отношении импорта или экспорта продуктов, содержащих каннабис. . Информацию об импорте или экспорте пищевых ингредиентов см. здесь.
Что касается импорта, если выяснится, что какой-либо товар является фальсифицированным, неправильно маркированным, в нарушение раздела 505 Закона о FD&C или запрещен к ввозу или доставке для использования в торговле между штатами в соответствии с разделом 301(ll) Закона о FD&C, такой товар будет быть отказано в приеме (см. раздел 801(a)(3) Закона о FD&C [21 U.SC § 381(a)(3)]).
Исследование и расширенный доступ
16. Какова роль FDA, когда речь идет об исследовании каннабиса и продуктов, полученных из каннабиса, для медицинского применения?
A. Для проведения клинических исследований, которые могут привести к одобрению нового препарата, включая исследования с использованием материалов из таких растений, как каннабис, исследователям необходимо сотрудничать с FDA и подать заявку IND в Центр оценки и исследований лекарственных средств (CDER). Процесс подачи заявки IND дает исследователям путь, который включает в себя регулярное взаимодействие с FDA для поддержки эффективной разработки лекарств, защищая при этом пациентов, участвующих в испытаниях.Для исследований для использования в качестве лекарственного препарата для животных исследователи должны создать файл исследуемого нового препарата для животных (INAD) в Центре ветеринарной медицины для проведения своих исследований, а не IND с CDER.
Процесс подачи заявки IND дает исследователям путь, который включает в себя регулярное взаимодействие с FDA для поддержки эффективной разработки лекарств, защищая при этом пациентов, участвующих в испытаниях.Для исследований для использования в качестве лекарственного препарата для животных исследователи должны создать файл исследуемого нового препарата для животных (INAD) в Центре ветеринарной медицины для проведения своих исследований, а не IND с CDER.
Как обсуждалось выше (см. вопрос № 2), Закон о фермерских хозяйствах 2018 г. исключил коноплю из CSA. Это изменение может упростить для исследователей процесс изучения каннабиса и его производных, включая КБД, которые подпадают под определение конопли, что может ускорить разработку новых лекарств.
Как уже упоминалось выше (см. вопрос № 5), в июле 2020 года агентство также выпустило проект руководства «Каннабис и соединения, полученные из каннабиса: соображения качества для клинических исследований. Руководство для промышленности» для лиц, рассматривающих возможность проведения клинических исследований в этой области.
Проведение клинических исследований с использованием веществ, связанных с каннабисом, запланированных DEA, часто предполагает взаимодействие с несколькими федеральными агентствами. Это включает в себя: регистрацию, администрируемую DEA; получение каннабиса для исследований в NIDA, в Национальных институтах здравоохранения или в другом источнике, зарегистрированном DEA; и рассмотрение FDA заявки IND или INAD и протокола исследования.Дополнительно:
- Для контролируемого вещества Списка I в соответствии с CSA DEA предоставляет исследователям регистрацию следователя и протокола и предъявляет требования безопасности уровня Списка I на месте, где будет изучаться каннабис.
- NIDA предоставляет каннабис исследовательского качества для научных исследований. Агентство отвечает за надзор за выращиванием каннабиса для медицинских исследований и заключило контракт с Университетом Миссисипи на выращивание каннабиса для исследований на охраняемом объекте.Доступен каннабис различной силы и состава.
 DEA также может позволить другим производителям зарегистрироваться в DEA для производства и распространения каннабиса в исследовательских целях.
DEA также может позволить другим производителям зарегистрироваться в DEA для производства и распространения каннабиса в исследовательских целях. - Исследователи сотрудничают с FDA и подают заявку IND в соответствующий отдел Управления новых лекарств CDER в зависимости от терапевтического показания. На основании результатов, полученных в исследованиях, проведенных на этапе IND, спонсоры могут подать маркетинговую заявку на официальное одобрение препарата.
17. Возражает ли FDA против клинических исследований каннабиса для медицинского применения?
A. Нет. FDA считает, что научно обоснованные исследования, проведенные в рамках заявки IND, являются лучшим способом определить, какую пользу пациентам может принести использование препаратов, полученных из каннабиса. FDA поддерживает проведение этого исследования:
- Предоставление информации о процессе, необходимом для проведения клинических исследований с использованием каннабиса.
- Предоставление информации о конкретных требованиях, необходимых для разработки препарата, полученного из растения, такого как каннабис. В декабре 2016 года FDA обновило «Руководство для промышленности: разработка ботанических лекарств», в котором спонсоры получают рекомендации по подаче заявок в IND на растительные лекарственные препараты.
- Предоставление конкретной поддержки исследователям, заинтересованным в проведении клинических исследований с использованием каннабиса и его компонентов в рамках процесса IND посредством встреч и регулярного взаимодействия на протяжении всего процесса разработки лекарств.
- Предоставление общей поддержки исследователям, чтобы помочь им понять и следовать процедурам проведения клинических исследований через группу поддержки малого бизнеса и промышленности Центра оценки и исследований лекарственных средств FDA.
18. Как пациенты могут получить доступ к каннабису или продуктам, полученным из каннабиса, для медицинского использования посредством расширенного доступа?
A. Расширенный доступ — это потенциальная возможность для пациента с серьезным или опасным для жизни заболеванием или состоянием попробовать исследуемый медицинский продукт (лекарство, биологическое средство или медицинское устройство) для лечения вне клинических испытаний, когда нет сопоставимых или удовлетворительных результатов. доступные терапии.Производители могут иметь возможность сделать исследуемые препараты доступными для отдельных пациентов при определенных обстоятельствах посредством расширенного доступа, как описано в Законе о FD&C и имплементирующих правилах.
19. Могут ли пациенты получить доступ к каннабису или продуктам, полученным из каннабиса, для медицинского использования в рамках права на попытку?
A. Информация для пациентов о праве на судебное разбирательство (RTT) доступна на нашем веб-сайте. RTT предназначен для облегчения доступа к определенным исследуемым препаратам посредством прямого взаимодействия между пациентами, их врачами и спонсорами лекарств — FDA не участвует в принятии этих решений.Спонсоры, разрабатывающие лекарства для опасных для жизни состояний, несут ответственность за решение о том, предоставлять ли их продукты пациентам, которые имеют право на доступ в рамках RTT. Если вы заинтересованы в RTT, вам следует обсудить этот путь со своим лицензированным врачом. Компании, разрабатывающие лекарства и биопрепараты, также известные как спонсоры, могут предоставить информацию о том, считается ли их лекарство/биологический препарат правомочным исследуемым препаратом в соответствии с Законом о RTT, и могут ли они предоставить лекарство/биологический препарат в соответствии с Законом о RTT.
Дети и беременные/кормящие женщины
20. Есть ли у FDA опасения по поводу применения каннабиса детям?
A. Мы понимаем, что родители пытаются найти лечение заболеваний своих детей. Однако использование непроверенных препаратов может иметь непредсказуемые и непредвиденные последствия. Лица, осуществляющие уход, и пациенты могут быть уверены, что препараты, одобренные FDA, прошли тщательную оценку безопасности, эффективности и качества и находятся под наблюдением FDA после их появления на рынке.FDA продолжает поддерживать надежные, научно обоснованные исследования медицинского применения лекарственных препаратов, содержащих каннабис или соединения, полученные из каннабиса, и будет продолжать работать с компаниями, заинтересованными в выводе на рынок безопасных, эффективных и качественных продуктов. За исключением Epidiolex, Marinol и Syndros, ни один продукт, содержащий каннабис или соединения, полученные из каннабиса (растительного или синтетического происхождения), не был одобрен как безопасный и эффективный для использования в любой популяции пациентов, будь то дети или взрослые.
21. Есть ли у FDA опасения по поводу назначения продукта каннабиса беременным и кормящим женщинам?
A. FDA известно о возможных неблагоприятных последствиях для здоровья при употреблении продуктов каннабиса, содержащих ТГК, беременными или кормящими женщинами. В опубликованной научной литературе сообщается о потенциальных побочных эффектах употребления каннабиса беременными женщинами, в том числе о задержке роста плода, низкой массе тела при рождении, преждевременных родах, малом весе для гестационного возраста, госпитализации новорожденных в отделение интенсивной терапии (ОИТН) и мертворождении.[1, 2, 3] Основываясь на опубликованных исследованиях на животных, есть также опасения, что употребление каннабиса во время беременности может негативно повлиять на развитие мозга плода. [4, 5, 6] Американский колледж акушеров и гинекологов (ACOG) рекомендует поощрять женщин, которые беременны или планируют беременность, прекратить употребление каннабиса. Кроме того, ACOG отмечает, что данных для оценки влияния употребления каннабиса на младенцев, находящихся на грудном вскармливании, недостаточно; поэтому употребление каннабиса не рекомендуется при грудном вскармливании.[7] Беременные и кормящие женщины должны поговорить с врачом о потенциальных неблагоприятных последствиях употребления каннабиса для здоровья.
22. Что FDA думает о том, чтобы сделать КБД доступным для детей с эпилепсией?
A. FDA одобрило Epidiolex, который содержит очищенную форму лекарственного вещества CBD, для лечения судорог, связанных с синдромом Леннокса-Гасто или синдромом Драве, у пациентов в возрасте 1 года и старше. Он также одобрил Epidiolex для лечения судорог, связанных с комплексом туберозного склероза, у пациентов в возрасте 1 года и старше.Это означает, что FDA пришло к выводу, что этот конкретный лекарственный продукт безопасен и эффективен для предполагаемого использования. Контролируемые клинические испытания, проверяющие безопасность и эффективность лекарственного средства, наряду с тщательным рассмотрением в рамках процесса утверждения лекарственного средства FDA, являются наиболее подходящим способом донести до пациентов лечение на основе каннабиса. Благодаря адекватным и хорошо контролируемым клиническим исследованиям, подкрепившим это одобрение, а также обеспечению стандартов качества производства, врачи могут быть уверены в равномерной дозировке препарата и последовательной доставке, что поддерживает надлежащую дозировку, необходимую для лечения пациентов с этими сложными и серьезными эпилептическими синдромами. .
23. Что делать, если мой ребенок съел что-то, содержащее каннабис?
A. За исключением таких продуктов, как ингредиенты из семян конопли, обсуждавшиеся в вопросе № 12, безопасность которых была оценена, важно защитить детей от случайного проглатывания каннабиса и продуктов, содержащих каннабис. FDA рекомендует хранить эти продукты в недоступном для детей месте, чтобы снизить риск случайного проглатывания. Если у родителя или опекуна есть обоснованные подозрения, что ребенок случайно проглотил продукты, содержащие каннабис, ребенка следует доставить к врачу или в отделение неотложной помощи, особенно если ребенок ведет себя необычным образом или чувствует себя плохо.
Домашние и другие животные
24. Я видел, как продукты каннабиса продаются для домашних животных. Безопасны ли они?
A. FDA известно о некоторых продуктах каннабиса, которые продаются как продукты для здоровья животных. Мы хотим подчеркнуть, что FDA не одобрило использование каннабиса для животных, и агентство не может гарантировать безопасность или эффективность этих продуктов. По этим причинам FDA предостерегает владельцев домашних животных от использования таких продуктов и рекомендует вам обсудить с вашим ветеринаром подходящие варианты лечения вашего питомца.
Признаки того, что ваш питомец может страдать от неблагоприятных последствий употребления каннабиса, могут включать вялость, депрессию, обильное слюнотечение, рвоту, возбуждение, тремор и судороги.
Если у вас есть опасения, что ваш питомец страдает от неблагоприятных последствий употребления каннабиса или любого вещества, содержащего каннабис, немедленно обратитесь к ветеринару, в местную больницу скорой помощи для животных или в токсикологический центр для животных.
Хотя агентству известно о сообщениях о том, что домашние животные употребляют различные формы каннабиса, на сегодняшний день FDA не получало напрямую никаких сообщений о побочных эффектах, связанных с животными, получавшими продукты каннабиса.Тем не менее, побочные эффекты от случайного проглатывания хорошо задокументированы в научной литературе. Если вы чувствуете, что ваше животное пострадало от употребления каннабиса, мы рекомендуем вам сообщить о нежелательном явлении в FDA. Пожалуйста, посетите Информацию о сообщениях о лекарствах и устройствах для животных, чтобы узнать больше о том, как сообщить о нежелательном явлении, связанном с лекарством для животных, или о том, как сообщить о нежелательном явлении или проблеме с кормом для домашних животных.
25. Можно ли добавлять коноплю в корм для животных?
А.Все ингредиенты в кормах для животных должны быть предметом одобренной петиции о пищевых добавках или общепризнанными безопасными (GRAS) для их предполагаемого использования у предполагаемых видов. Если корм для животных содержит ингредиент, который не является предметом одобренной петиции о пищевых добавках или GRAS для его предполагаемого использования у предполагаемых видов, этот корм для животных будет фальсифицирован в соответствии с разделом 402 (a) (2) (C) (i). Закона FD&C [21 USC § 342(а)(2)(С)(i)]. По согласованию с государственными органами по контролю за кормами CVM также признает ингредиенты, перечисленные в Официальном издании (OP) Американской ассоциации официальных лиц по контролю за кормами (AAFCO), как приемлемые для использования в кормах для животных.В настоящее время нет одобренных петиций о пищевых добавках или определений ингредиентов, перечисленных в AAFCO OP для каких-либо веществ, полученных из конопли, и нам неизвестны какие-либо выводы GRAS относительно использования каких-либо веществ, полученных из конопли, в кормах для животных. Узнайте больше о подаче ингредиентов для кормов для животных здесь.
В отношении продуктов с маркировкой «конопля», которые также могут содержать ТГК или КБД, как упоминалось выше, в соответствии с разделом 301 (II) Закона о FD&C запрещается ввоз или поставка для введения в торговлю между штатами любых продуктов животного происхождения для какой ТГК или КБД был добавлен.
26. Могут ли одобренные препараты для людей, содержащие КБД или синтетический ТГК, использоваться дополнительно для животных?
A. Закон о разъяснении использования лекарственных препаратов для животных от 1994 г. (AMDUCA) разрешает ветеринарам назначать использование разрешенных препаратов для людей и животных без маркировки для животных при определенных условиях. Использование без маркировки должно соответствовать всем положениям AMDUCA и регламенту его реализации в 21 CFR § 530. Помимо прочих ограничений, эти положения разрешают использование препарата без маркировки только по законному распоряжению лицензированного ветеринара в контексте действительного ветеринара-клиента. -терпеливое отношение и только в обстоятельствах, когда здоровье животного находится под угрозой или страдает, или может наступить смерть в результате отказа от лечения.
Кроме того, в соответствии с 21 CFR 530.20, использование без маркировки одобренного лекарственного препарата для людей у сельскохозяйственных животных не разрешено, если лекарство для животных, одобренное для использования у сельскохозяйственных животных, может быть использовано без этикетки для использования. Кроме того, в соответствии с 21 CFR 530.20(b)(2), если научная информация об аспекте безопасности пищевых продуктов для человека при использовании одобренного лекарственного средства для людей у сельскохозяйственных животных недоступна, ветеринарный врач должен принять соответствующие меры для обеспечения того, чтобы животное и его пищевые продукты не будут поступать в пищу человека.
Для получения дополнительной информации об использовании без маркировки препаратов, одобренных FDA, у животных см. Использование без маркировки препаратов, одобренных FDA, у животных.
[1] Грей и др. Выявление пренатального воздействия каннабиса и влияния одновременного воздействия табака на рост новорожденных. Клиническая химия. 2010 г.; 56(9): 1442-1450.
[2] Gunn, et al. Пренатальное воздействие каннабиса и последствия для здоровья матери и ребенка: систематический обзор и метаанализ. Открытый БМЖ. 2016; 6:e009986.
[3] Hayatbakhsh, et al.Исходы родов, связанные с употреблением каннабиса до и во время беременности. Педиатрические исследования. 2012 г.; 71 (2): 215-219.
[4] Сильва и др. Пренатальный тетрагидроканнабинол (THC) изменяет когнитивную функцию и реакцию на амфетамин у крыс от отлучения от груди до взрослой жизни. Нейротоксикол и Тератол 2012; 34(1): 63-71.
[5] Trezza, et al. Влияние перинатального воздействия дельта-9-тетрагидроканнабинола на эмоциональную реактивность потомства: продольное поведенческое исследование крыс Wistar.Психофармакология (Берл) 2008; 198(4): 529-537.
[6] Campolongo, et al. Перинатальное воздействие дельта-9-тетрагидроканнабинола вызывает стойкий когнитивный дефицит, связанный с изменением экспрессии кортикальных генов и нейротрансмиссии у крыс. Наркоман Биол 2007; 12 (3-4): 485–495.
[7] Мнение комитета ACOG: использование марихуаны во время беременности и лактации
Как извлечь часть строковой переменной с помощью регулярных выражений?
Обработка строк в Stata довольно проста из-за множества встроенных строковых функции.Среди этих строковых функций есть три функции, связанные с регулярные выражения, regexm для сопоставления, regexr для замены и регулярных выражений для подвыражений. Мы покажем несколько примеров использования регулярное выражение для извлечения и/или замены части строковой переменной используя эти три функции. Внизу страницы пояснение все операторы регулярных выражений, а также функции, которые работают с обычные выражения.
Примеры
Пример 1. Исследователь имеет адреса в виде строковой переменной и хочет создать новую переменную. который содержит только почтовые индексы.
Пример 2: у нас есть переменная, которая содержит полные имена в порядке первых имя, а затем фамилию. Мы хотим создать новую переменную с полным именем в порядок фамилии, а затем имени через запятую.
Пример 2. Даты вводились как строковая переменная, в некоторых случаях год вводился в виде четырехзначного числа. значение (это то, что Stata обычно ожидает увидеть), но в других случаях оно вводилось как двузначное ценность.Мы хотим создать переменную даты в числовом формате на основе этой строки. Переменная. С этой задачей можно легко справиться с помощью обычных команд Stata, см. нашу страницу часто задаваемых вопросов. «Моя переменная даты — это строка, как я могу превратить ее в переменную даты, которую Stata может распознавать?» для получения информации о том, как это сделать. Мы включили этот пример здесь для демонстрационных целей, а не потому, что регулярные выражения обязательно лучший способ справиться с этой ситуацией.
В этих ситуациях можно использовать регулярные выражения для определения случаев, в которых строка содержит набор значений (т.г. конкретное слово, число, за которым следует слово и т. д.) и извлечь этот набор значений из всей строки для использования в другом месте.
Пример 1. Извлечение почтовых индексов из адресов
Начнем с поддельных записей адресов.
адрес ввода str60 «4905 Лейкуэй Драйв, Колледж-Стейшн, Техас, 77845, США» «Жасмин-стрит, 673, Лос-Анджелес, Калифорния, » "2376 Первая улица, Сан-Диего, Калифорния " "Уэст Сентрал Стрит, 6, Темпе, AZ 80068" "1234 Главная улица.Кембридж, Массачусетс 01238-1234" конец
Чтобы найти почтовый индекс, мы будем искать пятизначное число в адресе. Команда gen (сокращение от «генерировать») ниже указывает Stata создать новую переменную с именем zip . Остальная часть команды немного сложна, сначала оценивается «if», if(regexm(address, «[0-9][0-9][0-9][0-9][0-9 ]»)) ищет в переменной адрес пятизначное число и, если может найти пятизначное число в переменной адрес , = regexs(0) указывает, что Stata должна установить значение zip равным этому пятизначное число.Мы указываем что мы хотим пятизначное число, указав «[0-9]» в пять раз. Если иное не указано с помощью *, + или ? знак, один и только один из символы, содержащиеся в скобках, будут совпадать. Это означает, что нанизывание пяти из этих выражения вместе позволят нам найти строку ровно из пяти цифр. Обратите внимание, что 0-9 указывает, что выражение должно соответствовать любому символу 0 до 9 (т. е. 0, 1, 2, 3, 4, 5, 6, 7, 8 и 9 совпадают).
gen zip = regexs(0) if(regexm(address, "[0-9][0-9][0-9][0-9][0-9]"))
список
+------------------------------------------------- -------------+
| почтовый индекс |
|------------------------------------------------- -------------|
1.| 4905 Lakeway Drive, Колледж-Стейшн, Техас 77845 США 77845 |
2. | 673 Jasmine Street, Лос-Анджелес, Калифорния |
3. | 2376 Первая улица, Сан-Диего, Калифорния |
4. | 6 West Central St, Tempe AZ 80068 80068 |
5. | 1234 Мейн-Стрит. Кембридж, Массачусетс 01238-1234 01238 |
+------------------------------------------------- -------------+ Пример 1, вариант № 1
В приведенном выше упрощенном примере ни один из адресов не содержит пятизначных номеров улиц. числа.Что делать, если есть адреса с пятизначными номерами улиц? Давайте посмотрим в другом наборе данных поддельных адресов и посмотреть, что происходит, когда мы пытаемся использовать тот же код выше.
прозрачный
введите адрес str60
«4905 Лейкуэй Драйв, Колледж-Стейшн, Техас 77845»
«Жасмин-стрит, 673, Лос-Анджелес, Калифорния, »
"2376 Первая улица, Сан-Диего, Калифорния "
"66666 West Central St, Tempe AZ 80068"
«12345 Мэйн-Стрит-Кембридж, Массачусетс 01238»
конец
gen zip = regexs(0) if(regexm(адрес, "[0-9][0-9][0-9][0-9][0-9]"))
список
+------------------------------------------------- ---------+
| почтовый индекс |
|------------------------------------------------- ---------|
1.| 4905 Lakeway Drive, Колледж-Стейшн, Техас 77845 77845 |
2. | 673 Jasmine Street, Лос-Анджелес, Калифорния |
3. | 2376 Первая улица, Сан-Диего, Калифорния |
4. | 66666 West Central St, Tempe AZ 80068 66666 |
5. | 12345 Мейн-Стрит. Кембридж, Массачусетс 01238 12345 |
+------------------------------------------------- ---------+ По-видимому, это работает некорректно, так как последние две строки переменная zip подобрала номера улиц для этих адресов вместо почтовых индексов.В этот набор данных, почтовый индекс появляется в конце адресной строки. Если мы предположим, что это относится ко всем адресам в данных, исправление будет очень просто. Мы можем указать «[0-9][0-9][0-9][0-9][0-9]$» который проинструктирует Stata найти пятизначное число в конце строки.
gen zip = regexs(0) if(regexm(address, "[0-9][0-9][0-9][0-9][0-9]$"))
список
+------------------------------------------------- ---------+
| почтовый индекс |
|------------------------------------------------- ---------|
1.| 4905 Lakeway Drive, Колледж-Стейшн, Техас 77845 77845 |
2. | 673 Jasmine Street, Лос-Анджелес, Калифорния |
3. | 2376 Первая улица, Сан-Диего, Калифорния |
4. | 66666 West Central St, Tempe AZ 80068 80068 |
5. | 12345 Мейн-Стрит. Кембридж, Массачусетс 01238 01238 |
+------------------------------------------------- ---------+ Пример 1, вариант № 2
Иногда почтовый индекс также включает четырехзначный добавочный номер и страну. имя может также появляться в конце адреса, например, в некоторых адреса, указанные ниже.
прозрачный введите адрес str60 «4905 Лейкуэй Драйв, Колледж-Стейшн, Техас, 77845, США» «Жасмин-стрит, 673, Лос-Анджелес, Калифорния, » "2376 Первая улица, Сан-Диего, Калифорния " "66666 West Central St, Tempe AZ 80068" «12345 Мэйн-Стрит-Кембридж, Массачусетс 01238-1234» "12345 Мейн-Сент-Соммервиль, Массачусетс, 01239-2345" "12345 Мейн-Стрит Уотертвон, Массачусетс, Массачусетс, 01239, США" конец
В такой более реалистичной ситуации код в предыдущем примеры не будут работать правильно, так как после zip есть лишние символы код, который необходимо извлечь.Вот как мы можем это сделать, используя более сложный регулярный выражение.
gen zip = regexs(1) if regexm(address, "([0-9][0-9][0-9][0-9][0-9])[-]*[0-9 ]*[ a-zA-Z]*$")список+------------------------------------------------ --------------+ | почтовый индекс | |------------------------------------------------- -------------| 1. | 4905 Lakeway Drive, Колледж-Стейшн, Техас 77845 США 77845 | 2.| 673 Jasmine Street, Лос-Анджелес, Калифорния | 3. | 2376 Первая улица, Сан-Диего, Калифорния | 4. | 66666 West Central St, Tempe AZ 80068 80068 | 5. | 12345 Мейн-Стрит. Кембридж, Массачусетс 01238-1234 01238 | |------------------------------------------------- -------------| 6. | 12345 Main St Sommerville MA 01239-2345 01239 | 7. | 12345 Main St Watertwon MA 01239 США 01239 | +------------------------------------------------- -------------+
Мы добавили в регулярное выражение следующее: «[-]*[0-9]*[ a-zA-Z]*» . В этом регулярном выражении есть три компонента.
- [-]* – совпадение нуля или более дефисов «-»
- [0-9]* – совпадение нуля или более чисел
- [a-zA-Z]* — совпадение нуля или более пробелов или букв
Эти дополнения позволяют нам сопоставлять случаи, когда есть замыкающие символов после почтового индекса и для правильного извлечения почтового индекса. Заметь мы также использовали «регулярные выражения (1)» вместо «регулярных выражений (0)», как мы делали ранее, потому что мы теперь используют подвыражения, указанные парой скобок в « ([0-9][0-9][0-9][0-9][0-9]) «.Еще одна стратегия, которая может работать лучше в некоторых случаях, — это регулярное выражение
.gen zip2 = regexs(1) if(regexm(адрес, ".*([0-9][0-9][0-9][0-9][0-9])"))
В этом примере точка (т. е. «.») соответствует любому символу, а одна звездочка («*») соответствует любому символы. Вместе, два указать, что искомое число не должно встречаться в самом начало строки, но может появиться в любом месте после.
Пример 2: извлечение имени и фамилии и изменение их порядка
У нас есть переменная, которая содержит полное имя человека в порядке имени и затем фамилия.Мы хотим создать новую переменную для полного имени в порядке фамилия, а затем имя через запятую. Для начала давайте сделаем образец данных набор.
прозрачный введите str40 полное имя "Джон Адамс" "Адам Смитс" "Мэри Смитс" "Чарли Уэйд" конец
Теперь нам нужно захватить первое слово и второе слово и поменять их местами. Здесь регулярное выражение для этой цели: (([a-zA-Z]+)[ ]*([a-zA-Z]+)).
Это регулярное выражение состоит из трех частей:
.- ([a-zA-Z]+) — подвыражение , захватывающее строку, состоящую из буквы, как строчные, так и прописные.Это будет первое имя.
- [ ]* – совпадение с пробелами. Это расстояние между первым имя и фамилия.
- ([a-zA-Z]+) – подвыражение, захватывающее строку, состоящую из буквы. Это будет фамилия.
gen n = regexs(2)+", "+regexs(1) if regexm(fullname, "([a-zA-Z]+)[ ]*([a-zA-Z]+)")
список
+-------------------------------+
| полное имя п |
|-------------------------------|
1.| Джон Адамс Адамс, Джон |
2. | Адам Смитс Смитс, Адам |
3. | Мэри Смитс Смитс, Мэри |
4. | Чарли Уэйд Уэйд, Чарли |
+---------------------------------------------+ Это действительно работает. Давайте посмотрим, как регулярных выражений работают в этом случае. регулярное выражение фактически идентифицирует ряд разделов на основе всего выражения, а также подвыражения. В следующем коде используется регулярных выражений для размещения каждого из этих компоненты (подвыражения) в свою собственную переменную а затем отображает их.
gen n0 = regexs(0) if regexm(fullname, "(([a-zA-Z]+)[ ]*([a-zA-Z]+))")
gen n1 = regexs(2) if regexm(полное имя, "(([a-zA-Z]+)[ ]*([a-zA-Z]+))")
gen n2 = regexs(3) if regexm(полное имя, "(([a-zA-Z]+)[ ]*([a-zA-Z]+))")
список полных имен n0 n1 n2
+------------------------------------------------+
| полное имя n0 n1 n2 |
|------------------------------------------------|
1. | Джон Адамс Джон Адамс Джон Адамс |
2.| Адам Смитс Адам Смитс Адам Смитс |
3. | Мэри Смитс Мэри Смитс Мэри Смитс |
4. | Чарли Уэйд Чарли Уэйд Чарли Уэйд |
+------------------------------------------------+ Пример 3: Двух- и четырехзначные значения года.
В этом примере даты введены как строковая переменная. Стата может справиться это с помощью стандартных команд (см. «Моя переменная даты является строкой, как я могу превратить его в переменную даты, которую Stata может распознать?»), мы используем это как пример того, что вы могли бы сделать с регулярными выражениями.Целью этого процесса является создание строки переменная с соответствующим четырехзначным годом для каждого случая, который Stata может затем легко преобразовать в дату. Для этого начнем с разделения вывести каждый элемент даты (день, месяц и год из двух или четырех цифр) в отдельная переменная, то мы будем присваивать случаям правильный четырехзначный год где в настоящее время только две цифры, наконец, мы объединяем переменные, чтобы создать одну строковая переменная, которая содержит месяц, день и год из четырех цифр.
Сначала введите даты:
ввод даты str18 20 января 2007 г. 16 июня 2006 г. 06 сентября 1985 г. 21 июня 2004 г. 4июля90 9 января 1999 г. 6 августа 99 г. 19 августа 2003 г. конец
Далее мы хотим определить день месяца и поместить его в переменную позвонил день . Для этого мы проинструктируем Stata найти день, глядя на начало строки (т.е. дата), для одного или нескольких значений от 0 до 9. (Другими словами, ищите номер в начале строки, так как мы знаем, что первая серия чисел день.[0-9]+»)
Строка синтаксиса ниже находит месяц, ища одну или несколько букв вместе в строке. Затем генерирует переменную month и устанавливает ее равной месяцу, указанному в строке.
gen month = regexs(0) if regexm(date, "[a-zA-Z]+")
В этом году все становится сложнее. Обратите внимание, что значения для присвоения столетия основаны на моем знании моих «данных». Прежде всего, мы извлекаем все цифры для года.Мы используем оператор «$», чтобы указать, что поиск ведется из конец строки. Затем мы превращаем строковую переменную в числовую переменную используя функцию Stata «real». Следующее действие включает в себя работу с двузначными годами начиная с «0». Это соответствует последним годам двадцать первого века. Чтобы превратить их в четырехзначные годы, мы объединяем (используя +) строку идентифицируется (год из двух цифр) строкой «20». Далее мы найдем двузначные годы 10-99 и соедините эти строки со строкой «19».[1-9][0-9]$») gen date2 = день+месяц+год список +————————————————- —+ | дата день месяц год date2 | |————————————————- —| 1. | 20 января 2007 г. 20 января 2007 г. 20 января 2007 г. | 2. | 16 июня 2006 г. 16 июня 2006 г. 16 июня 2006 г. | 3. | 06 сентября 1985 г. 06 сентября 1985 г. 06 сентября 1985 г. | 4. | 21 июня 2004 г. 21 июня 2004 г. 21 июня 2004 г. | 5.| 4июля90 4 июля 1990 4июля1990 | |————————————————- —| 6. | 9 января 1999 г. 9 января 1999 г. 9 января 1999 г. | 7. | 6 августа 1999 г. 6 августа 1999 г. 6 августа 1999 г. | 8. | 19 августа 2003 г. 19 августа 2003 г. 19 августа 2003 г. | +————————————————- —+
Регулярные выражения
Регулярные выражения — это, как правило, способ поиска и, в некоторых случаях, замены появление шаблона в строке на основе набора правил.Эти правила определяется набором операторов. Следующее Таблица показывает все операторы, которые принимает Stata, и поясняет каждый из них. Обратите внимание, что в Стате, регулярные выражения всегда заключаются в кавычки.
[ ] Квадратные скобки означают, что один из символов внутри скобки должны совпадать. Например, если я хочу найти одна буква между f и m, я бы набрал «[f-m]» а-я Диапазон указывает, что допустимо любое значение в этом диапазоне.Это чувствительно к регистру, поэтому az не совпадает с AZ, если любой регистр может считаться совпадением, включая оба a-zA-Z. Числовые значения также приемлемо в виде диапазонов (например, 0-9). . Точка соответствует любому символу. Позволяет сопоставлять символы, которые обычно являются регулярными выражениями операторы. Например, если вы хотите сопоставить «[«, введите [ вместо всего один [. * Совпадает с нулем или более символов в предыдущем выражении.Например если бы я хотел сопоставить число, состоящее из одной или нескольких цифр, если есть число, но все же хотите указать совпадение, если остальная часть выражения подходит, я мог бы указать [0-9]* + Совпадение с одним или несколькими символами в предыдущем выражении. Например если бы я хотел сопоставить слово, содержащее любую комбинацию букв, я бы указал [а-я-я]+ ? Соответствует либо нулю, либо одному из предыдущих выражений.» указывает что следующее выражение должно появиться в начале строки. $ Если в конце выражения появляется «$», это означает, что предыдущее выражение должно стоять в конце строки. Например, если бы я хотел сопоставить число, которое появилось последним в конце строки я бы указал «[0-9]+$» | Логический оператор или, указывающий, что либо выражение предшествующий это или следующее за ним квалифицируется как совпадение. ( ) Создает подвыражение внутри большего выражения. Полезно с оператор «или» (т.е. | ), и при извлечении и замене значений. Например, если я хочу извлечь числовое значение, которое, как я знаю, следует сразу после слова или набора букв, я мог бы использовать регулярное выражение «[a-zA-Z]+([0-9]+)» соответствует всему выражение, но позволяет выбрать часть в скобках (называется подстрокой). Обработка подстрок обсуждается в более подробно ниже. Эти выражения можно комбинировать для поиска самых разных строк.
Как упоминалось выше, существует три типа функций, которые можно выполнить заранее. с регулярными выражениями в Stata (если вы творческий человек, вы можете сделать любое количество другие вещи, использующие эти функции, но основными инструментами являются встроенные функции Stata). Стата имеет отдельные команды для каждого из трех типов действий регулярных выражений могут выполнить:
- регулярное выражение — используется для поиска совпадающих строк, оценивается как единица, если есть совпадение, и ноль иначе
- регулярных выражений — используется для возврата n -й подстроки в выражении соответствует регулярному выражению (следовательно, регулярное выражение всегда должно запускаться перед регулярными выражениями, обратите внимание что «если» оценивается первым, даже если оно появляется позже в строке синтаксис).
- regexr — используется для замены совпадающего выражения чем-то другим.
Каждый из них имеет немного отличающийся синтаксис. Строка ниже показывает синтаксис для regexm , то есть функция, которая соответствует вашему регулярному выражению, где строка может быть строкой, которую вы вводите сами, строкой из макроса или обычно имя переменной. Регулярное выражение является регулярным выражение для строки, которую вы хотите найти, обратите внимание, что оно должно появиться в кавычки.
регулярное выражение ( строка , " регулярное выражение ")Для регулярных выражений, то есть для вызова всей строки или ее части, используется следующий синтаксис:
регулярных выражений ( н )Где n — это номер, присвоенный подстроке, которую вы хотите извлечь. Подстроки фактически разделяются при запуске регулярного выражения. Вся подстрока возвращается нулем, и каждая подстрока последовательно нумеруется от 1 до n. За например, регулярное выражение(«907-789-3939», «([0-9]*)-([0-9]*)-([0-9]*)») возвращает следующее:
Подвыражение # Возвращенная строка 0 907-789-3939 1 907 2 789 3 3939 Обратите внимание, что в подвыражениях 1, 2 и 3 пропущены тире, так как они не заключаются в круглые скобки, которые отмечают подвыражения.
Вы можете еще раз взглянуть на то, как это работает, используя следующий синтаксис, который использует команду display для запуска функции.
отображать регулярное выражение("907-789-3939", "([0-9]*)-([0-9]*)-([0-9]*)") отображать регулярные выражения (0) отображать регулярные выражения (1) отображать регулярные выражения (2) отображать регулярные выражения (3)Поскольку это функции, команды регулярных выражений работают внутри других команд (например, генерировать), но не могут быть использованы сами по себе (т.е. вы не можете запустить команду в Stata с регулярное выражение(…)).
Артикул
Руководство по очистке сточных вод при добыче нефти и газа
Агентство по охране окружающей среды опубликовало Руководство и стандарты по выбросам при добыче нефти и газа (40 CFR, часть 435) в 1979 году и внесло поправки в правила в 1993, 1996, 2001 и 2016 годах. завершающие мероприятия. Эта деятельность осуществляется на суше, в прибрежных районах и на море.Положения о нефти и газе применяются к традиционной и нетрадиционной добыче нефти и газа, за исключением метана из угольных пластов. Нормативные требования включены в разрешения NPDES .
На этой странице:
Что такое нефтегазодобывающая промышленность?
Добыча нефти и газа — это разведка и добыча нефти и природного газа из скважин. Промышленность образует сточные воды из воды, извлекаемой из геологических формаций, и из химикатов, используемых при разведке, бурении скважин и добыче нефти и газа.
Эти виды деятельности включены в NAICS код 211111, Добыча сырой нефти и природного газа. (Примечание: списки группы NAICS приведены в качестве руководства и не определяют сферу действия правил нефтегазовой отрасли. Точные определения сферы действия см. в разделах применимости в 40 CFR Part 435.)
Покрываемые объекты
Положения о нефти и газе применяются к объектам, разделенным на 5 подкатегорий:
Оффшор
Береговой
Прибрежный
Использование воды в сельском хозяйстве и дикой природе
Колодцы стриппера
| Все детали | Только части A и D |
|---|---|
| подтоварная вода подтоварная вода флюид, извлеченный из углеводородосодержащих пластов при добыче нефти и газа, и включает, если присутствует, пластовую воду, нагнетаемую воду и любые химические вещества, добавляемые в скважину или во время добычи нефти. /процесс разделения воды.[40 CFR 435.33 (v)] | Внутренний |
| Добытый песок | Санитарный |
| Буровые растворы | Террасный дренаж |
| Буровой шлам | |
| Жидкости для обработки скважин, капитального ремонта и заканчивания |
Нетрадиционная экстракция – Стандарты предварительной обработки
EPA установило стандарты предварительной обработки в соответствии с подразделом C в 2016 году.Эти стандарты запрещают сбросы загрязнителей сточных вод с береговых объектов нетрадиционной добычи нефти и газа (UOG) на очистные сооружения, находящиеся в государственной собственности.
Изучение управления сточными водами при добыче нефти и газа — 2019
Агентство по охране окружающей среды провело целостное исследование управления попутной водой из наземных нефтяных и газовых скважин. Исследование не было сосредоточено конкретно на какой-либо одной существующей категории сточных вод.
Документы по добыче метана из угольных пластов — 2010/2013
Агентство по охране окружающей среды не обнародовало руководящие принципы и стандарты по ограничениям сбросов загрязняющих веществ с предприятий по добыче метана из угольных пластов.Агентство по охране окружающей среды инициировало разработку норм по метану из угольных пластов, но объявило о своем решении прекратить эту работу осенью 2014 года.
История нормотворчества
Поправка 2016 г.
Поправка 2001 г.
Добавлены требования к сбросу буровых растворов на синтетической основе (SBF) и других неводных буровых растворов
Поправка 1996 г.
Добавлены BAT , BCT , NSPS , PSES и PSNS , а также пересмотрены ограничения BPT для береговых объектов.Поправка 1993 г.
Добавлены требования BAT, BCT и NSPS для морских объектов
- Документы, в том числе:
- Окончательное правило (4 марта 1993 г.)
- Предлагаемые правила:
- 13 марта 1991 г.
- 26 ноября 1990 г.
- 21 октября 1988 г. (Уведомление о доступности данных)
- 26 августа 1985 г.
1979 Первоначальное нормотворчество
ОграниченияBPT для оффшорной зоны; Береговой; Прибрежный; и подкатегории использования воды в сельском хозяйстве и дикой природе
- Документы, в том числе:
- Окончательное правило (13 апреля 1979 г.)
- Промежуточные окончательные правила:
- 13 октября 1976 г. (подчасти с C по F)
- 15 сентября 1975 г. (подчасти A и B)
Дополнительная информация
Для получения дополнительной информации о Руководстве по выбросам нефти и газа обращайтесь к Стиву Уитлоку ([email protected]) или 202-566-1541.
Добыча нефти и газа. Стандарты
В следующих разделах рассматриваются стандарты OSHA, директивы (инструкции для сотрудников OSHA), письма с разъяснениями (официальные письма с разъяснениями и национальные согласованные стандарты, относящиеся к нефтегазодобывающей отрасли. Государственные и другие федеральные также выделены стандарты и даны ссылки на отраслевые организации.
Положение об общих обязанностях Закона об охране труда (закон, которым было создано OSHA) требует от работодателей предоставлять работникам безопасные рабочие места, на которых отсутствуют признанные опасности, которые вызывают или могут привести к смерти или серьезной травме.Воздействие опасностей, присутствующих в отрасли бурения, обслуживания и хранения нефтяных и газовых скважин, рассматривается в специальных стандартах для промышленности.
Как упоминалось в письме с разъяснением «Применимость 29 CFR 1926 к бурению и обслуживанию нефтяных и газовых скважин» (27 апреля 2009 г.), подготовка площадки является единственным аспектом операций по бурению и обслуживанию нефтяных и газовых скважин, подпадающим под действие 29 CFR. 1926. Подготовка площадки включает в себя такие мероприятия, как выравнивание площадки, рытье траншей и земляные работы.Все остальные аспекты операций по бурению и обслуживанию нефтяных и газовых скважин регулируются 29 CFR 1910; когда на рабочем месте существует серьезная опасность, которая не рассматривается конкретным стандартом OSHA, применяется Раздел 5 (a) (l) («Общая статья обязанностей») Закона об охране труда.
Стандарты OSHA
Часто цитируемые стандарты
OSHA поддерживает список наиболее часто цитируемых стандартов для определенных кодов Североамериканской системы отраслевой классификации (NAICS) от 2 до 6 цифр.Дополнительную информацию см. на странице часто цитируемых стандартов OSHA OSHA. Для нефтяной и газовой промышленности используйте код NAICS 21 в окне поиска NAICS.
- Промышленная группа нефтегазового сервиса (код NAICS 213111)
- Сырая нефть и природный газ (код NAICS 211111)
- Бурение нефтяных и газовых скважин (код NAICS 213111)
- Услуги по разведке нефтяных и газовых месторождений (код NAICS 213112)
- Нефтегазовые промысловые услуги, не включенные в другие категории (код NAICS 213112)
Другие выделенные стандарты
Маркировка органических продуктов | Служба сельскохозяйственного маркетинга
Об органической маркировке
На этой странице представлен обзор основных требований и различных категорий маркировки, разрешенных в соответствии с органическими правилами Министерства сельского хозяйства США.Этикетки органических продуктов должны быть проверены и одобрены сертификационным агентом, аккредитованным Министерством сельского хозяйства США, прежде чем их можно будет использовать на рынке.
Каким требованиям должны соответствовать органические продукты?- Органические продукты должны производиться с использованием методов сельскохозяйственного производства, которые способствуют круговороту ресурсов, содействуют экологическому равновесию, поддерживают и улучшают качество почвы и воды, сводят к минимуму использование синтетических материалов и сохраняют биоразнообразие. Продукты должны быть:
- Если вы производите продукт и хотите заявить, что он или его ингредиенты являются органическими, ваш конечный продукт, вероятно, должен быть сертифицирован.
- Если вы не сертифицированы, вы не должны делать каких-либо заявлений об органическом веществе на основной панели дисплея или использовать органическую печать Министерства сельского хозяйства США где-либо на упаковке. (см. освобождение ниже)
- Вы можете только на информационной панели идентифицировать сертифицированные органические ингредиенты как органические и процентное содержание органических ингредиентов.
- Надписи на обложках разрешены как на передней панели, так и на информационной панели упакованного продукта:
- Основная панель дисплея (PDP): часть упаковки, которую покупатели чаще всего видят во время покупки
- Информационная панель (IP): содержит описание ингредиентов (список ингредиентов, содержащихся в продукте, от самого высокого до самого низкого процентного содержания конечного продукта) и другую информацию о продукте
- См. полные правила в разделе «Состав продукта» органических правил Министерства сельского хозяйства США
- Используется для маркировки любого продукта, который содержит 100% органических ингредиентов (за исключением соли и воды, которые считаются натуральными)
- Большинство сырых, необработанных или минимально обработанных сельскохозяйственных культур могут быть помечены как «100% органические»
- PDP: Может включать органическую печать Министерства сельского хозяйства США и/или заявление о 100 процентной органической ценности
- IP: Определить органические ингредиенты (например,г., органический укроп) или через звездочку или другой знак
- Любой продукт, содержащий не менее 95 процентов органических ингредиентов (за исключением соли и воды)
- До 5 процентов ингредиентов могут быть неорганическими сельскохозяйственными продуктами и/или несельскохозяйственными продуктами из Национального списка (неорганические сельскохозяйственные продукты и некоторые несельскохозяйственные продукты из Национального списка могут использоваться только в том случае, если они не являются коммерчески доступными как органические)
- PDP: Может включать органическую печать Министерства сельского хозяйства США и/или органическую декларацию
- IP: Определите органические ингредиенты (например,г., органический укроп) или через звездочку или другой знак
- Продукт содержит не менее 70 процентов ингредиентов органического производства (за исключением соли и воды), с рядом подробных ограничений в отношении ингредиентов, которые составляют неорганическую часть
- PDP: Может быть указано «сделано из органических продуктов (укажите до трех ингредиентов или категорий ингредиентов)»; нигде не должен содержать органический знак Министерства сельского хозяйства США, представлять готовый продукт как органический или указывать «сделано из органических ингредиентов» .
- IP: Определите органические ингредиенты (например,г., органический укроп) или через звездочку или другой знак
- Конкретные органические ингредиенты могут быть указаны в описании ингредиентов продуктов, содержащих менее 70% органических веществ, например: «Ингредиенты: вода, ячмень, бобы, органические помидоры, соль».
- PDP: Нигде не должен содержать органический знак Министерства сельского хозяйства США или слово «органический»
- IP: Может указывать только сертифицированные органические ингредиенты как органические в списке ингредиентов и процентное содержание органических ингредиентов; остальные ингредиенты, не требуемые для соблюдения органических правил Министерства сельского хозяйства США
- Должен соответствовать как требованиям Министерства сельского хозяйства США по органическим продуктам, так и правилам Бюро по налогообложению и торговле алкоголем и табаком (TTB), включая требования к маркировке сульфитов.
- Любое использование добавленных сульфитов делает вино подходящим только для категории маркировки «сделано с»; нельзя использовать органическое уплотнение USDA
- Сульфиты можно добавлять только в вино, «сделанное из» органического винограда; вино, помеченное как «сделанное с» другими органическими фруктами (например,г., яблоки) могут не содержать добавленных сульфитов
- Все этикетки на органическом спирте должны быть проверены органом по сертификации органических продуктов и TTB
- Больше :
- Готовый продукт сертифицирован как органический и производится в полном соответствии с органическими нормами Министерства сельского хозяйства США: весь продукт может быть помечен как органический и иметь печать органического происхождения Министерства сельского хозяйства США
- Все экземпляры определенных волокон в готовом продукте сертифицированы как органические: на этикетке может быть указано, что определенные волокна являются органическими, и указано процентное содержание органических волокон
- Глобальный стандарт органического текстиля (GOTS): текстиль , соответствующий этому стандарту, может продаваться как органический в США.Текстиль: если готовый продукт не сертифицирован в соответствии с органическими нормами Министерства сельского хозяйства США, на этикетках продуктов может не указываться или не подразумеваться, что готовый продукт является органическим органическим продуктом Министерства сельского хозяйства США, или использовать знак органического происхождения Министерства сельского хозяйства США.
- Политика в отношении органического текстиля (pdf)
Существуют ли отдельные правила для меда, грибов или корма для домашних животных?
- Органические нормы Министерства сельского хозяйства США в настоящее время не включают отдельные стандарты для этих продуктов.
- Мед, грибы и корм для домашних животных могут быть сертифицированы в соответствии с действующими стандартами производства и обработки и должны соответствовать требованиям к маркировке органических продуктов, сертифицированных в соответствии с этими стандартами.Обратитесь к своему сертификатору за подробностями.
Есть ли исключения?
- Производители, которые продают органические продукты на сумму менее 5000 долларов в год, не обязаны подавать заявку на органическую сертификацию со следующими оговорками:
- Должен соответствовать нормативным требованиям к органическому производству и обработке, включая ведение документации (не менее 3 лет).
- Продукты таких несертифицированных предприятий не могут использоваться в качестве органических ингредиентов в переработанных продуктах, произведенных другим предприятием, и не могут иметь органическую печать, сертифицированную Министерством сельского хозяйства США.
Где я могу получить дополнительную информацию?
О NOP
Распространение данных | КМС
Объявление об изменениях в Национальном плане и системе регистрации поставщиков услуг (NPPES) Загружаемый файл
(также называется загружаемым файлом NPI и/или полной заменой ежемесячного файла NPI)
CMS рада сообщить, что загружаемый файл NPPES теперь будет включать деактивированные NPI в ежемесячный файл полной замены NPI.Многие организации выразили потребность в информации, касающейся деактивированных НФУ и дат деактивации. После тщательного рассмотрения CMS согласилась распространить деактивированные NPI и даты деактивации как часть полного ежемесячного файла NPI для замены.
Кроме того, CMS также предоставит полностью заменяемый ежемесячный файл деактивации NPI с деактивированными NPI и датами деактивации в формате Excel. Этот файл деактивации NPI поможет пользователям, которых интересует только информация о деактивации.Ссылку на файлы можно найти внизу этой страницы, выбрав «Загружаемые файлы NPI» в разделе «Связанные ссылки».
Еще больше хороших новостей
CMS также будет предоставлять еженедельные добавочные файлы NPI для загрузки. Эти еженедельные файлы будут иметь тот же формат, что и текущий ежемесячный файл NPI с полной заменой; однако еженедельные файлы будут включать данные только за данную неделю. Еженедельные файлы помогут пользователям, предоставляя им более актуальную информацию и включают новые назначенные NPI, обновления данных NPI и новые деактивированные NPI, охватывающие эту неделю.
Обратите внимание : Еженедельный добавочный файл NPI – это дополнительный файл, который следует использовать вместе с полностью заменяющим ежемесячным файлом NPI до тех пор, пока не будет доступен следующий полный замещающий ежемесячный файл NPI. Каждый месяц пользователям необходимо будет загружать полный заменяющий ежемесячный файл NPI, чтобы обеспечить наличие в своей системе самых последних данных NPI.
Распространение данных
В сентябре 2007 г. CMS начала раскрывать общественности данные NPPES о поставщиках медицинских услуг, которые подлежат раскрытию в соответствии с Законом о свободе информации (FOIA).В соответствии с поправками к e-FOIA, CMS раскрыла эти данные через Интернет в двух формах:
.- Реестр NPI — открывается в новом окне : Реестр NPI представляет собой базу данных только для запросов, которая ежедневно обновляется, чтобы пользователи могли запрашивать NPPES (например, выполнять поиск по NPI, имени поставщика и т. д.) и извлекать раскрываемые в соответствии с Законом о свободе информации данные из результатов поиска. Плата за просмотр данных не взимается.
- Загружаемый файл NPI — открывается в новом окне : Полная замена ежемесячного файла NPI, еженедельного инкрементного файла NPI и файла полной замены деактивации NPI.Плата за скачивание данных не взимается.
Начиная с 18 июня 2018 г. загружаемый архив NPPES будет включать следующие 3 новых справочных файла:
- Справочный файл других имен — этот файл содержит дополнительные другие имена, связанные с NPI типа 2.
- Справочный файл местоположения практики — этот файл содержит все неосновные местоположения практики, связанные с NPI типа 1 и типа 2.
- Справочный файл конечной точки — этот файл содержит все конечные точки, связанные с NPI типа 1 и типа 2.
Подробная информация о новых файлах будет включена в Файл распространения данных — файл Readme.
Важные факты о ежемесячном файле NPI с полной заменой
- Загружаемый файл представляет собой Zip-файл, представляющий собой сжатый архивный файл, который содержит (a) документ «Read Me», (b) документ Code Value, (c) документ файла заголовка и (d) FOIA- раскрываемый файл данных поставщика медицинских услуг NPPES.
- Файл данных (элемент (d) выше) представляет собой файл со значениями, разделенными запятыми, содержащий как данные, так и заголовок.Каждое значение данных заключено в пару двойных кавычек. Если элемент данных не имеет значения, это будет указано в файле двумя двойными кавычками подряд.
- Размер файла распространения данных превышает 4 ГБ . Старые утилиты сжатия файлов не могут правильно извлечь этот файл. Пожалуйста, проверьте свою утилиту сжатия файлов на наличие известных проблем и последнюю версию, чтобы избежать проблем при извлечении этого файла. Утилиты, такие как WinZip и 7-zip, успешно распаковывают файл.
- Предполагается, что файл загружается, а данные импортируются в реляционную базу данных или обрабатываются иным образом лицами, обладающими необходимыми техническими знаниями.
- Условно-бесплатные текстовые редакторы рекомендуются пользователям, желающим просмотреть файл данных и/или выполнить простой поиск. Файл данных .csv необходимо открывать в текстовом редакторе, способном открывать большие файлы. Два примера: TextPad и UltraEdit. Кроме того, файл заголовка csv достаточно мал, чтобы его можно было открыть в простом текстовом редакторе, таком как Блокнот; однако он слишком велик для открытия в Excel.
- Отсутствует служба поддержки или другая техническая поддержка от CMS, NPI Enumerator или любого другого подрядчика CMS для загрузки, обработки или использования файла.
Другие важные примечания:
Данные поставщика медицинских услуг (частного лица или организации), подлежащие раскрытию в соответствии с Законом о свободе информации, которые деактивировали NPI, теперь будут раскрываться в файлах. Для деактивированного NPI CMS будет раскрывать только деактивированный NPI и соответствующую дату деактивации в файлах.Тем пользователям, которые загружают файл и публикуют загруженные данные на своих веб-сайтах, CMS предлагает отображать только одни и те же данные для деактивированных NPI (т. е. ТОЛЬКО деактивированные NPI и дату деактивации). Пожалуйста, имейте в виду следующую информацию:
- Деактивированные записи в NPPES не могут быть просмотрены или отредактированы поставщиками медицинских услуг, которым были назначены эти NPI (эти поставщики медицинских услуг не будут иметь возможности обновлять, изменять или удалять [где это разрешено] свои данные NPPES, раскрываемые Законом о свободе информации).Нет необходимости раскрывать какую-либо информацию о том, за кем ранее был закреплен деактивированный НКО.
- Субъекты, на которые распространяется действие страховки, не должны использовать деактивированные НКО в стандартных транзакциях.
- Поставщики медицинских услуг, деактивировавшие свои НФУ, не должны использовать или позволять другим использовать свои деактивированные НФУ в стандартных транзакциях.
- Данные, раскрываемые Законом о свободе информации о поставщиках медицинских услуг, повторно активирующих свои НФУ, будут по-прежнему отображаться в Реестре НФУ и по-прежнему будут включены в загружаемый файл.
Специальное примечание для медицинских работников:
Реестр NPI и загружаемые файлы будут содержать данные из NPPES, переданные в NPPES вами, кем-либо, действующим от вашего имени, или уполномоченным должностным лицом организации-поставщика. Если загружаемый файл или реестр NPI содержат неверную информацию, поставщики медицинских услуг должны исправить эту информацию. В любое время поставщики или кто-либо, действующий от их имени, могут редактировать свои записи, перейдя по адресу https://nppes.cms.hhs.gov, или получив бумажную форму заявки/обновления NPI (CMS-10114) на странице форм CMS (/Medicare/CMS-Forms/CMS-Forms) и отправив заполненную подписанную форму счетчику NPI. Поставщики, которым нужна помощь в редактировании своих записей, должны связаться со счетчиком NPI по телефону 1-800-465-3203, по электронной почте [email protected] или письмом: NPI Enumerator, 7125 Ambassador Rd, Suite 100, Windsor Mill, MD. 21244-2751.
Информация, раскрытая в Реестре NPI и в загружаемых файлах, подлежит раскрытию в соответствии с Законом о свободе информации и требуется для раскрытия в соответствии с Законом о свободе информации и поправками eFOIA к Закону о свободе информации.

 Если в документах адрес отличается от ЕГРЮЛ, в выдаче будет отказано. Обратитесь в НИ для изменения адреса.
Если в документах адрес отличается от ЕГРЮЛ, в выдаче будет отказано. Обратитесь в НИ для изменения адреса.

 8 ₽/слово
8 ₽/слово 3 ₽/слово
3 ₽/слово 4 ₽/слово
4 ₽/слово 9 ₽/слово
9 ₽/слово 12€/слово
12€/слово 12/слово
12/слово 27€/слово
27€/слово 14/слово
14/слово 1€/слово
1€/слово 9 ₽/слово
9 ₽/слово 15€/слово
15€/слово 12€/слово
12€/слово 15/слово
15/слово 8 ₽/слово
8 ₽/слово 7 ₽/слово
7 ₽/слово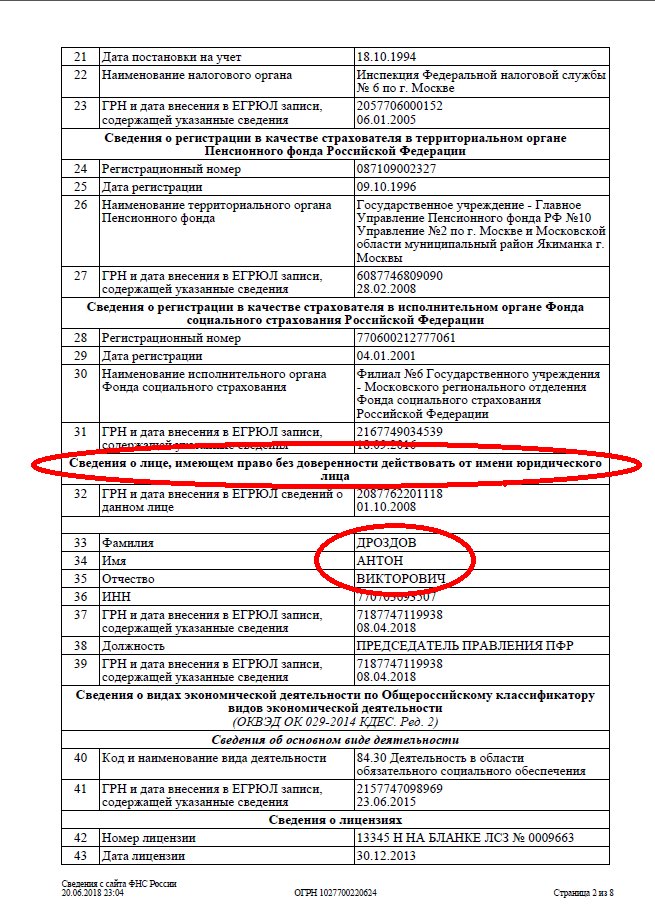 6 ₽/слово
6 ₽/слово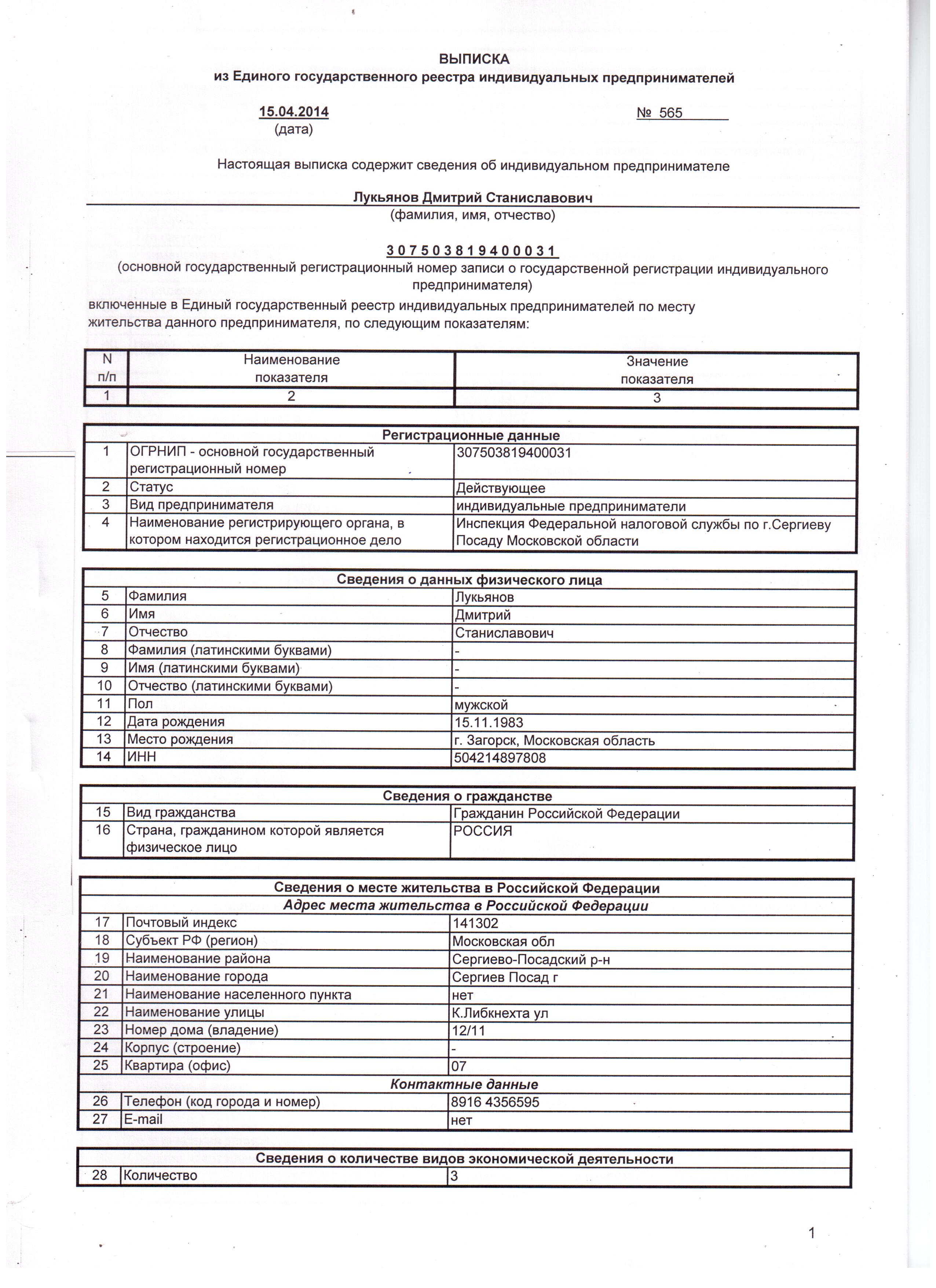 7 ₽/слово
7 ₽/слово 2 ₽/слово
2 ₽/слово 2 ₽/слово
2 ₽/слово 2 ₽/слово
2 ₽/слово 5 ₽/слово
5 ₽/слово 1 ₽/слово
1 ₽/слово 15/слово
15/слово 085€/слово
085€/слово 08€/слово
08€/слово 08€/слово
08€/слово 5 ₽/слово
5 ₽/слово 5 г для экстрактов, если содержание ТГК более 3%
5 г для экстрактов, если содержание ТГК более 3%