Уровень активности и длительность периода полураспада
Некоторые радионуклиды сильно радиоактивны – время их жизни до распада чрезвычайно мало (вплоть до нескольких миллисекунд – например, Нобелий, Лоуренсий), другие – слабо радиоактивны, и могут не распадаться тысячи и миллионы лет (изотопы урана, радия). Длительность жизни радионуклидов (время, в течение которого они сохраняют свои свойства) сильно варьируется от одного элемента к другому.
Периодом полураспада называется время, за которое радиоактивное вещество естественным образом теряет половину своей радиоактивности. Таким образом, в конце 10 периодов полураспада радиоактивность вещества снижается в 1024 раза. Период полураспада полония 214 составляет одну секунду, в то время как урана 238 – 4,5 миллиарда лет.
Кривая радиоактивного распада: через два периода радиоактивность вещества снижается в четверо, через три – в восемь раз и т.д.
Несколько примеров радиоактивности
Период полураспада вещества обратно пропорционален радиоактивности радионуклида: чем длиннее период полураспада, тем меньше радиоактивность.
Радиоактивный элемент | Период полураспада | Удельная активность |
Йод 131 | 8 дней | 4,6 квадриллионов Бк/г |
Цезий 137 | 30,2 лет | 3,2 триллионов Бк/г |
Плутоний 239 | 24 000лет | 2,3 миллиарда Бк/г |
Уран 238 | 4,5 миллиарда лет | 12 300 Бк/г |
Радиоактивные вещества в природе — ТАСС
Каждый химический элемент можно сделать радиоактивным, если в ядра атома добавить лишние нейтроны. Или, напротив, убрать часть этих частиц. Один элемент может быть представлен разными атомными ядрами, и эти варианты ядер называют изотопами. Изотопы бывают как стабильными, так и неустойчивыми: при избытке или недостатке нейтронов ядра рано или поздно распадаются и превращаются в ядра других элементов.
Или, напротив, убрать часть этих частиц. Один элемент может быть представлен разными атомными ядрами, и эти варианты ядер называют изотопами. Изотопы бывают как стабильными, так и неустойчивыми: при избытке или недостатке нейтронов ядра рано или поздно распадаются и превращаются в ядра других элементов.
Альфа-распад: из ядра атома вылетает альфа-частица, два протона и два нейтрона. Альфа-частицы являются ядрами атома гелия.
Нестабильных, то есть радиоактивных, изотопов на Земле немного: большая их часть успела распасться задолго до появления человека. В природе короткоживущие изотопы получаются в основном в недрах звезд и особенно при вспышках сверхновых, поэтому на Земле до XX века нельзя было найти ни стронция-90, ни йода-131, ни плутония в любом виде. Однако ряд медленно распадающихся изотопов вполне дошел до наших дней.
Калий-40
Калий обычно имеет атомную массу 39. Это значит, что на его 19 протонов (он 19-й в таблице Менделеева) приходится 20 нейтронов — вполне стабильное соотношение. Но кроме калия-39 есть еще калий-40, и вот он уже радиоактивен.
Но кроме калия-39 есть еще калий-40, и вот он уже радиоактивен.
Калий-40 имеет очень большой период полураспада — свыше миллиарда лет. Это значит, что если поместить перед собой атом калия-40 и ждать его превращения в кальций или аргон, то через миллиард лет шанс зафиксировать акт распада составит всего 50%. Другое определение периода полураспада гласит, что это то время, за которое распадется половина ядер. Несмотря на то что ядра калия-40 распадаются крайне редко, большое число этих ядер вокруг нас делает присутствие изотопа вполне заметным.
Пока вы читали абзац выше, у вас в теле произошли десятки тысяч актов распада калия-40. Внутри среднего по величине банана ежесекундно происходит 10-15 распадов, и в связи с этим ученые даже предложили шуточную величину «банановый эквивалент» — доза облучения, сравнимая с эффектом от съеденного банана.
Бананы богаты калием. В том числе и калием-40, который бета-активен. Бета-распад происходит при превращении одного из нейтронов в ядре в протон, электрон и антинейтрино. Электрон в данном случае называют бета-частицей. Фото: Wilfredor / Wikimedia.
Электрон в данном случае называют бета-частицей. Фото: Wilfredor / Wikimedia.
При концентрации калия-40 вполне можно получить превышение радиационного фона. Простейший способ собрать побольше калия-40 в одном месте — это собрать золу от сжигания растений. Зачастую кучи золы на садовых участках можно найти при помощи даже простого бытового радиометра. Опасности для здоровья это, впрочем, не представляет.
Углерод-14
Кроме калия-40 в органической материи можно найти еще углерод-14, однако его намного меньше. Он упоминается по единственной причине: углерод-14 позволяет археологам определить возраст находок.
Дело в том, что живое растение поглощает из атмосферы (углекислого газа) как углерод-12, самый распространенный изотоп, так и углерод-14. В момент спиливания древесина содержит изотопы углерода в той пропорции, которая характерна для окружающей среды, но затем углерод-14 постепенно распадается. Аналогично обстоит дело и с животными, которые потребляют растительную пищу: пока они живы, в их теле присутствуют оба изотопа в более или менее естественном соотношении.
Чем меньше осталось углерода-14, тем больше прошло времени. Если объект пролежал в земле дольше 50 тысяч лет, то углерода-14, и без того редкого, становится недостаточно для проведения исследований.
Уран-238, торий-232 и немного урана-235
Химический состав гранитов: натрий, алюминий, кремний, кислород, немного водорода и фтора (в составе биотита. Гранит — это смесь полевого шпата, кварца и биотита). Однако кроме этих основных элементов в граните есть примеси, и среди них особняком выделяются уран и торий. Оба элемента представлены исключительно радиоактивными изотопами, поэтому радиационный фон на гранитных скалах будет выше, чем на сложенной из глины и песка равнине.
При нормальной работе тепловая электростанция на угле выбрасывает в атмосферу больше радиоактивных веществ, чем АЭС такой же мощности. Причина этого в том, что уголь, так же как и гранит, загрязнен ураном и торием.
«Фонят» гранитные плиты, которыми облицованы многие здания, станции метро и набережные. Как и в случае с калием-40 в золе, найти такой гранит можно обычным бытовым радиометром, и говорить об опасности для человека в данном случае не приходится. Есть целые горные массивы, где фон в разы больше, чем на равнине, однако врачи не замечают в таких местах роста заболеваемости.
Как и в случае с калием-40 в золе, найти такой гранит можно обычным бытовым радиометром, и говорить об опасности для человека в данном случае не приходится. Есть целые горные массивы, где фон в разы больше, чем на равнине, однако врачи не замечают в таких местах роста заболеваемости.
Важно подчеркнуть, что облучение от гранитной плиты снизу или сбоку к тому же обладает намного меньшим биологическим эффектом, чем попадание радиоактивных изотопов внутрь тела. Гранит несъедобен и прямой угрозы не несет, разве что упадет сверху. Плотность и твердость минерала обычно угрожают человеку куда больше, чем бета- и гамма-активность.
Радон-222
Сказанное выше про гранит предполагает, что вы не проводите много времени в подвальных помещениях в местности с выходом гранита на поверхность. При распаде ядер урана в этом минерале образуется в том числе радиоактивный газ радон, а вот он уже, как показали наблюдения медиков, способен вызвать рак легких. Точнее сказать, у людей, которые работают или живут в помещениях с повышенным содержанием радона, риск рака легких выше, чем в среднем по населению.
По оценкам британских специалистов-онкологов, радон — вторая после курения причина рака легких. Несмотря на то что радон дает альфа-излучение, которое можно задержать даже картоном или фольгой, он намного опаснее всех перечисленных в этой статье изотопов. Причина — радон попадает с воздухом в легкие и облучает их изнутри.
Так выглядит обогащенный, то есть с повышенным содержанием урана-235, уран. Вопреки расхожему мнению, уран не настолько опасен, чтобы к нему нельзя было даже подойти. Намного страшнее отработанное ядерное топливо с изотопами
Единственная эффективная мера защиты против радона заключается в хорошей вентиляции. Газ проникает в здания из строительных материалов или недр земли, но при постоянной смене воздуха не успевает накапливаться в опасных количествах.
В начале XX века радоновое облучение медики считали «стимулирующим», но в наши дни радоновые ванны в большинстве стран мира (Россия тут — одно из немногих исключений) признаны как минимум бесполезными.
Самый радиоактивный элемент на Земле | ToPro
Возможно Вы задавались вопросом, какой элемент является самым радиоактивным? Из этой статьи Вы узнаете ответ.
Радиоактивность — это явление самопроизвольного распада нестабильного атомного ядра на более стабильные части.
Все элементы, начиная с 84 (по таблице Менделеева), чрезвычайно радиоактивны. Они не имеют стабильных изотопов. Кроме того радиоактивными могут быть изотопы элементов и до 84.
Элемент номер 84
В нормальных условиях это мягкий металл серебристо-белого цвета. Поскольку этот элемент при распаде выделяет огромное количество энергии, многие источники называют его самым радиоактивным.
Он настолько радиоактивен, что светится синим. Это обусловлено действием излучения на частицы окружающего газа. Один миллиграмм этого элемента испускает столько альфа-частиц, сколько 5 граммов радия.
При его распаде выделяется огромное количество энергии. Скорость распада настолько высока, что может поднять температуру образца весом в пол грамма выше 500°C.
Чрезвычайно опасен для человека. Его вообще нельзя брать в руки. С ним работают исключительно в герметичных боксах. Для летального исхода достаточно ничтожно малой дозы в 0,6 микрограмма.
Речь идёт о полонии.
Иллюстрация: Public DomainИллюстрация: Public Domain
Но есть и другие не менее радиоактивные элементы, помимо полония.
Они испускают больше частиц. Это нобелий и лоуренсий. Период полураспада этих элементов считанные минуты. Сравните это с периодом полураспада полония, который составляет 138.39 дней.
Элемент номер 118
Также самым радиоактивным элементом, известным науке, можно считать элемент номер 118 — оганессон. Он имеет самое тяжелое ядро на сегодняшний день.
Он имеет самое тяжелое ядро на сегодняшний день.
Скорость распада последних элементов, синтезированных человеком, включая 118, чрезвычайно высока. Настолько высока, что трудно определить, как быстро они распадаются. Подобные элементы распадаются по существу в момент их создания.
Разумно ожидать, что титул «самый радиоактивный» вскоре будет присвоен какому-то новому, еще не открытому элементу. Возможно, это будет элемент 120, над созданием которого работают ученые.
Обязательно подписывайтесь, Вам также понравится:
Можно ли пить тяжёлую воду?
Самый распространённый металл на Земле
Самый прочный металл на Земле
Самый твёрдый металл на Земле
История синтеза сверхтяжелых элементов — РИА Новости, 01.12.2011
Сегодня их можно получить только искусственным способом.
Развитие науки о строении атомов и ядер, разработка экспериментальных методов превращения элементов привели к расширению периодической таблицы за счет трансурановых элементов. Первый трансурановый элемент с атомным номером 93 был получен в 1940 году. Он был назван нептунием.
Первый трансурановый элемент с атомным номером 93 был получен в 1940 году. Он был назван нептунием.
В 1940-1953 годах профессором Гленом Сиборгом и его коллегами в Радиационной национальной лаборатории (Беркли, США) были синтезированы искусственные элементы с Z=93-100. Они были получены в реакциях последовательного захвата нейтронов ядрами изотопа урана — 235U в длительных облучениях на мощных ядерных реакторах.
Элемент с Z=101 (менделевий) был открыт в 1955 году при облучении эйнштейния ускоренными a-частицами.
В России в 1957 году для синтеза новых элементов была создана специальная лаборатория в Дубне, которую возглавил член-корреспондент Академии наук СССР Георгий Николаевич Флеров.
С 1960-х годов началась эпоха ускорителей элементарных частиц — циклотронов, эпоха ускорения тяжелых ионов, когда синтез новых элементов стали производить только при взаимодействии двух тяжелых ядер.
Пять элементов с Z>101 были получены на ускорителях заряженных частиц (циклотрон Объединенного института ядерных исследований (ОИЯИ; Дубна, СССР) и линейный ускоритель тяжелых ионов «Хайлак» (Беркли, США) в ядерных реакциях с ускоренными тяжелыми ионами.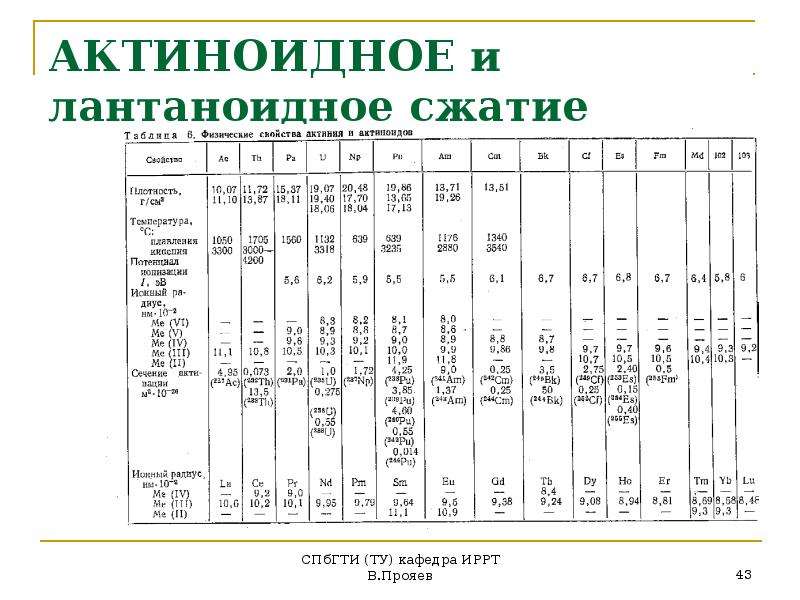
Элементы с атомными номерами, начиная с 105, являются сверхтяжелыми искусственно полученными радиоактивными химическими элементами. Элементы с атомными номерами 104 и далее называются трансактинидными.
Новый элемент не считается открытым до тех пор, пока одна группа исследователей не получит надежных результатов по исследованию его атомов и пока другая (независимая) группа ученых не подтвердит эти результаты.
104-й элемент был впервые синтезирован в Дубне в 1964 году. Его получила группа ученых Лаборатории ядерных реакций во главе с Георгием Флеровым. В 1969 году элемент был получен группой ученых в университете Беркли, Калифорния. В 1997 году элемент получил название резерфордий, символ Rf.
105 элемент был синтезирован в 1970 году двумя независимыми группами исследователей в Дубне (СССР) и Беркли (США). Получил название дубний в честь города Дубна, где располагается Объединенный институт ядерных исследований в котором синтезированы несколько химических элементов, символ Db.
Впервые 106 элемент был получен в СССР Георгием Флеровым с сотрудниками в 1974 году, практически одновременно он был синтезирован в США Гленом Сиборгом с коллегами. В 1997 году Международный союз теоретической и прикладной химии (ИЮПАК) утвердил для 106 элемента название сиборгий (в честь Сиборга), символ Sg.
Первые опыты по получению 107 элемента были выполнены в СССР Юрием Оганесяном с группой ученых в 1976 году. Первые надежные сведения о ядерных свойствах 107 элемента были получены в ФРГ в 1981 и 1989 годах. В 1997 году Международный союз теоретической и прикладной химии (ИЮПАК) утвердил для 107 элемента название борий (в честь Нильса Бора), символ Bh.
Первые опыты по получению 108 элемента были выполнены в СССР в 1983-1984 годах. Надежные данные о ядерных свойствах 108 элемента были получены в ФРГ в 1984 и 1987 годах. В 1997 году ИЮПАК утвердил для 108 элемента название хассий (по земле Гессен, Германия), символ Hs.
Впервые 109 элемент был получен в ФРГ в 1982 году и подтвержден в 1984 году. В 1994 году ИЮПАК утвердил для 109 элемента название мейтнерий (в честь Лизы Мейтнер), символ Mt.
В 1994 году ИЮПАК утвердил для 109 элемента название мейтнерий (в честь Лизы Мейтнер), символ Mt.
110 элемент был открыт в 1994 году в Центре исследований тяжелых ионов в Дармштатде (ФРГ) в ходе эксперимента по напылению на пластины специального сплава, содержащего свинец, и его бомбардировки изотопами никеля. Назван дармштадтий в честь города Дармштадт (Германия), где был обнаружен. Символ Ds.
111 элемент тоже был открыт в Германии, получил название рентгений (химический символ Rg) в честь германского ученого Вильгельма-Конрада Рентгена.
112 элемент представляет собой трансурановый элемент, полученный при бомбардировке свинцовой мишени ядрами цинка. Период его полураспада составляет около 34 сек. Элемент был впервые получен в феврале 1996 года на ускорителе тяжелых ионов в Дармштадте. Для получения атомов нового элемента команда ученых использовала ионы цинка с атомным номером 30, которые разгонялись до очень больших энергий в 120-метровом ускорителе, после чего ударялись о мишень из свинца, атомный номер которого равен 82. При слиянии ядер цинка и свинца и происходило формирование ядер нового элемента, порядковый номер которого равен сумме атомных номеров исходных компонентов.
При слиянии ядер цинка и свинца и происходило формирование ядер нового элемента, порядковый номер которого равен сумме атомных номеров исходных компонентов.
В июне 2009 года ИЮПАК официально признала его существование. В июле 2010 году 112-му элементу было присвоено официальное имя «коперникий».
Более тяжелые элементы — с атомными номерами 112-116 и самый тяжелый на данный момент 118-й элемент — были получены российскими учеными из Объединенного института ядерных исследований в Дубне в 2000-2008 годах, но пока еще ждут официального признания со стороны ИЮПАК.
В 2011 году два из них с номерами 114 и 116 получили официальный статус. Международными экспертами, устанавливающими приоритет открытия и имена для новых элементов таблицы Менделеева, был подтвержден факт открытия новых химических элементов и подтвержден приоритет в этом процессе специалистов группы под руководством академика РАН Юрия Оганесяна из Объединенного института ядерных исследований в подмосковной Дубне, синтезировавших эти элементы при содействии американских коллег из Ливероморской национальной лаборатории.
Элемент под номером 114 был впервые синтезирован в декабре 1998 года путем бомбардировки ядрами кальция-48 мишени из плутония-244, а 116 элемент — в июле 2000 года путем бомбардировки ядрами кальция-48 мишени из кюрия-248.
Новые элементы будут добавлены в периодическую таблицу Менделеева, когда получат название.
Последний успешный эксперимент по синтезу нового сверхтяжелого элемента был проведен в Лаборатории имени Флерова Объединенного института ядерных исследований в Дубне в 2010 году, был получен 117-й элемент таблицы Менделеева.
Первые ядра 117 элемента были синтезированы еще в 2009 году, однако ученые долгое время проверяли и анализировали полученные данные.
В апреле 2011 года физики из немецкого Центра исследования тяжелых ионов (GSI) в Дармштадте (Гессен) при участии российских коллег начали эксперимент по синтезу нового химического элемента с атомным номером 120.
Материал подготовлен на основе информации РИА Новости и открытых источников
Почему 118-й химический элемент назвали в честь российского учёного
Это круче, чем Нобелевская премия! Впервые за 200 лет химический элемент назван в честь действующего российского учёного.
Международный союз теоретической и прикладной химии (IUPAC) утвердил названияновых четырёх элементов таблицы Менделеева: 113-го, 115-го, 117-го и 118-го. Последний назван в честь российского физика, академика Юрия Оганесяна. Учёные попадали «в клеточку» и раньше: Менделеев, Эйнштейн, Бор, Резерфорд, чета Кюри… Но лишь второй раз в истории это произошло при жизни учёного. Прецедент случился в 1997 году, когда такой чести удостоился Гленн Сиборг. Юрию Оганесяну давно прочат Нобелевскую премию. Но, согласитесь, получить собственную клеточку в таблице Менделеева куда круче.
В нижних строках таблицы вы легко найдёте уран, его атомный номер 92. Все последующие элементы, начиная с 93-го, — это так называемые трансураны. Некоторые из них появились примерно 10 миллиардов лет назад в результате ядерных реакций внутри звёзд. Следы плутония и нептуния были обнаружены в земной коре. Но большинство трансурановых элементов давно распалось, и теперь можно лишь предсказывать, какими они были, чтобы потом пытаться воссоздать их в лабораторных условиях.
Первыми это сделали в 1940 году американские учёные Гленн Сиборг и Эдвин Макмиллан. Родился плутоний. Позднее группа Сиборга синтезировала америций, кюрий, берклий… К тому времени чуть ли не весь мир включился в гонку за сверхтяжёлыми ядрами.
Юрий Оганесян (р. 1933). Выпускник МИФИ, специалист в области ядерной физики, академик РАН, научный руководитель лаборатории ядерных реакций ОИЯИ. Председатель Научного совета РАН по прикладной ядерной физике. Имеет почётные звания в университетах и академиях Японии, Франции, Италии, Германии и других стран. Награждался Государственной премией СССР, орденами Трудового Красного Знамени, Дружбы народов, «За заслуги перед Отечеством» и пр. Фото: wikipedia.org
В 1964 году новый химический элемент с атомным номером 104 впервые синтезировали в СССР, в Объединённом институте ядерных исследований (ОИЯИ), который находится в подмосковной Дубне. Позднее этот элемент получил имя «резерфордий». Руководил проектом один из основателей института Георгий Флёров. Его имя тоже вписано в таблицу: флеровий, 114.
Его имя тоже вписано в таблицу: флеровий, 114.
Юрий Оганесян был учеником Флёрова и одним из тех, кто синтезировал резерфордий, потом дубний и более тяжёлые элементы. Благодаря успехам советских учёных Россия вырвалась в лидеры трансурановой гонки и сохраняет этот статус до сих пор.
Научный коллектив, работа которого привела к открытию, направляет своё предложение в IUPAC. Комиссия рассматривает аргументы «за» и «против», исходя из следующих правил: «…вновь открытые элементы могут быть названы: (а) по имени мифологического персонажа или понятия (включая астрономический объект), (б) по названию минерала или аналогичного вещества, (в) по названию населённого пункта или географической области, (г) в соответствии со свойствами элемента или (д) по имени учёного».
Названия четырём новым элементам присваивали долго, почти год. Дата объявления решения несколько раз отодвигалась. Напряжение нарастало. Наконец 28 ноября 2016 года, по истечении пятимесячного срока для приёма предложений и возражений общественности, комиссия не нашла причин отвергнуть нихоний, московий, теннессин и оганесон и утвердила их.
Кстати, суффикс «-он-» не очень типичен для химических элементов. Для оганесона он выбран потому, что по химическим свойствам новый элемент аналогичен инертным газам — это сходство подчеркивает созвучие с неоном, аргоном, криптоном, ксеноном.
Рождение нового элемента — событие исторического масштаба. На сегодняшний день синтезированы элементы седьмого периода до 118-го включительно, и это не предел. Впереди 119-й, 120-й, 121-й… Изотопы элементов с атомными номерами более 100 зачастую живут не более тысячной доли секунды. И кажется, чем тяжелее ядро, тем короче его жизнь. Это правило действует до 113-го элемента включительно.
В 1960-х годах Георгий Флёров предположил, что оно не обязано неукоснительно соблюдаться по мере углубления в таблицу. Но как это доказать? Поиск так называемых островов стабильности более 40 лет был одной из важнейших задач физики. В 2006 году коллектив учёных под руководством Юрия Оганесяна подтвердил их существование. Научный мир вздохнул с облегчением: значит, смысл искать всё более тяжёлые ядра есть.
Коридор легендарной Лаборатории ядерных реакций ОИЯИ. Фото: Дарья Голубович/»Кот Шрёдингера»
Юрий Цолакович, что же всё-таки представляют собой острова стабильности, о которых много говорят в последнее время?
Юрий Оганесян: Вы знаете, что ядра атомов состоят из протонов и нейтронов. Но только строго определённое количество этих «кирпичиков» связаны друг с другом в единое тело, которое представляет ядро атома. Комбинаций, которые «не срабатывают», оказывается больше. Поэтому, в принципе, наш мир находится в море нестабильности. Да, есть ядра, которые остались со времён образования Солнечной системы, они стабильны. Водород, например. Участки с такими ядрами будем называть «континентом». Он постепенно уходит в море нестабильности по мере того, как мы идём к более тяжёлым элементам. Но, оказывается, если далеко уйти от суши, возникает остров стабильности, где рождаются ядра-долгожители. Остров стабильности — это открытие, которое уже сделано, признано, но точное время жизни долгожителей на этом острове пока не предсказывается достаточно хорошо.
Как были открыты острова стабильности?
Юрий Оганесян: Мы долго их искали. Когда ставится задача, важно, чтобы был однозначный ответ «да» или «нет». Причин нулевого результата на самом деле две: либо ты не дотянулся, либо того, что ищешь, вообще нет. У нас был «ноль» до 2000 года. Мы думали, что, может быть, теоретики и правы, когда рисуют свои красивые картины, но нам до них не дотянуться. В 90-е мы пришли к выводу, что стоит усложнить эксперимент. Это противоречило реалиям того времени: нужна была новая техника, а средств не хватало. Тем не менее к началу ХХI века мы были готовы опробовать новый подход — облучать плутоний кальцием-48.
Почему для вас так важен именно кальций-48, именно этот изотоп?
Юрий Оганесян: Он имеет восемь лишних нейтронов. А мы знали, что остров стабильности там, где избыток нейтронов. Поэтому тяжёлый изотоп плутония-244 облучали кальцием-48. В этой реакции синтезировали изотоп сверхтяжёлого элемента 114 — флеровия-289, который живёт 2,7 секунды. В масштабах ядерных превращений это время считается достаточно длительным и служит доказательством того, что остров стабильности существует. Мы доплыли до него, и по мере продвижения вглубь стабильность только росла.
В масштабах ядерных превращений это время считается достаточно длительным и служит доказательством того, что остров стабильности существует. Мы доплыли до него, и по мере продвижения вглубь стабильность только росла.
Фрагмент сепаратора ACCULINNA-2, на котором изучается структура лёгких экзотических ядер. Фото: Дарья Голубович/»Кот Шрёдингера»
Почему, в принципе, была уверенность, что существуют острова стабильности?
Юрий Оганесян: Уверенность появилась, когда стало понятно, что ядро имеет структуру… Давно, ещё в 1928 году, наш великий соотечественник Георгий Гамов (советский и американский физик-теоретик) высказал предположение, что ядерное вещество похоже на каплю жидкости. Когда эту модель начали проверять, выяснилось, что она удивительно хорошо описывает глобальные свойства ядер. Но потом наша лаборатория получила результат, который коренным образом изменил эти представления. Мы выяснили, что в обычном состоянии ядро не ведёт себя подобно капле жидкости, не является аморфным телом, а имеет внутреннюю структуру. Без неё ядро существовало бы всего 10-19 секунды. А наличие структурных свойств ядерной материи приводит к тому, что ядро живёт секунды, часы, а мы надеемся, что может жить сутки, а может быть даже миллионы лет. Эта надежда, быть может, и слишком смелая, но мы надеемся и ищем трансурановые элементы в природе.
Без неё ядро существовало бы всего 10-19 секунды. А наличие структурных свойств ядерной материи приводит к тому, что ядро живёт секунды, часы, а мы надеемся, что может жить сутки, а может быть даже миллионы лет. Эта надежда, быть может, и слишком смелая, но мы надеемся и ищем трансурановые элементы в природе.
Один из самых волнующих вопросов: есть ли предел разнообразию химических элементов? Или их бесконечно много?
Юрий Оганесян: Капельная модель предсказывала, что их не более ста. С её точки зрения есть предел существования новых элементов. Сегодня их открыто 118. Сколько ещё может быть?.. Надо понять отличительные свойства «островных» ядер, чтобы делать прогноз для более тяжёлых. С точки зрения микроскопической теории, которая учитывает структуру ядра, мир наш не кончается за сотым элементом уходом в море нестабильности. Когда мы говорим о пределе существования атомных ядер, мы должны обязательно это учесть.
Есть ли достижение, которое вы считаете главным в жизни?
Юрий Оганесян: Я занимаюсь тем, что мне на самом деле интересно. Иногда увлекаюсь очень сильно. Иногда получается что-то, и я радуюсь, что получилось. Это жизнь. Это не эпизод. Я не принадлежу к категории людей, которые мечтали быть научными работниками в детстве, в школе, нет. Но просто у меня как-то хорошо получалось с математикой и физикой, и поэтому я пошёл в тот вуз, где надо было сдавать эти экзамены. Ну, сдал. И вообще, я считаю, что в жизни мы все очень сильно подвержены случайностям. Правда, ведь? Очень многие шаги в жизни мы делаем совершенно случайным образом. А потом, когда ты становишься взрослым, тебе задают вопрос: «Почему ты это сделал?». Ну, сделал и сделал. Это моё обычное занятие наукой.
Иногда увлекаюсь очень сильно. Иногда получается что-то, и я радуюсь, что получилось. Это жизнь. Это не эпизод. Я не принадлежу к категории людей, которые мечтали быть научными работниками в детстве, в школе, нет. Но просто у меня как-то хорошо получалось с математикой и физикой, и поэтому я пошёл в тот вуз, где надо было сдавать эти экзамены. Ну, сдал. И вообще, я считаю, что в жизни мы все очень сильно подвержены случайностям. Правда, ведь? Очень многие шаги в жизни мы делаем совершенно случайным образом. А потом, когда ты становишься взрослым, тебе задают вопрос: «Почему ты это сделал?». Ну, сделал и сделал. Это моё обычное занятие наукой.
«Мы можем за месяц получить один атом 118-го элемента»
Сейчас ОИЯИ строит первую в мире фабрику сверхтяжёлых элементов на базе ускорителя ионов DRIBs-III (Dubna Radioactive Ion Beams), самого мощного в своей области энергий. Там будут синтезировать сверхтяжёлые элементы восьмого периода (119, 120, 121) и производить радиоактивные материалы для мишеней. Эксперименты начнутся в конце 2017 — начале 2018 года. Андрей Попеко, из лаборатории ядерных реакций им. Г. Н. Флёрова ОИЯИ, рассказал, зачем всё это нужно.
Эксперименты начнутся в конце 2017 — начале 2018 года. Андрей Попеко, из лаборатории ядерных реакций им. Г. Н. Флёрова ОИЯИ, рассказал, зачем всё это нужно.
Андрей Георгиевич, как предсказывают свойства новых элементов?
Андрей Попеко: Основное свойство, из которого следуют все остальные, — это масса ядра. Предсказать её очень сложно, но, исходя из массы, уже можно предположить, как ядро будет распадаться. Есть разные экспериментальные закономерности. Вы можете изучать ядро и, скажем, пытаться описать его свойства. Зная что-то о массе, можно говорить об энергии частиц, которые будет испускать ядро, делать предсказания о времени его жизни. Это довольно громоздко и не очень точно, но более-менее надёжно. А вот если ядро делится спонтанно, прогнозирование становится делом гораздо более сложным и менее точным.
Что мы можем сказать о свойствах 118-го?
Андрей Попеко: Он живёт 0,07 секунды и испускает альфа-частицы с энергией 11,7 МэВ. Это измерено. В дальнейшем можно сравнивать экспериментальные данные с теоретическими и поправлять модель.
В дальнейшем можно сравнивать экспериментальные данные с теоретическими и поправлять модель.
На одной из лекций вы говорили, что таблица, возможно, заканчивается на 174-м элементе. Почему?
Андрей Попеко: Предполагается, что дальше электроны просто упадут на ядро. Чем больше заряд ядра, тем сильнее оно притягивает электроны. Ядро — плюс, электроны — минус. В какой-то момент ядро притянет электроны настолько сильно, что они должны упасть на него. Наступит предел элементов.
Могут ли такие ядра существовать?
Андрей Попеко: Полагая, что существует 174-й элемент, мы полагаем, что существует и его ядро. Но так ли это? Уран, 92-й элемент, живёт 4,5 млрд лет, а 118-й — меньше миллисекунды. Собственно, раньше считалось, что таблица заканчивается на элементе, время жизни которого пренебрежимо мало. Потом выяснилось, что не всё так однозначно, если двигаться по таблице. Сначала время жизни элемента падает, потом, у следующего, немножко увеличивается, потом опять падает.
Рулоны с трековыми мембранами — наноматериалом для очистки плазмы крови при лечении тяжёлых инфекционных заболеваний, устранении последствий химиотерапии. Эти мембраны разработали в Лаборатории ядерных реакций ОИЯИ ещё в 1970-е годы. Фото: Дарья Голубович/»Кот Шрёдингера»
Когда увеличивается — это и есть остров стабильности?
Андрей Попеко: Это указание на то, что он есть. На графиках это хорошо видно.
Тогда что же такое сам остров стабильности?
Андрей Попеко: Некоторая область, в которой находятся ядра изотопов, обладающие более долгим по сравнению с соседями временем жизни.
Эту область ещё предстоит найти?
Андрей Попеко: Пока только самый краешек зацепили.
Что вы будете искать на фабрике сверхтяжёлых элементов?
Андрей Попеко: Эксперименты по синтезу элементов занимают много времени. В среднем полгода непрерывной работы. Мы можем за месяц получить один атом 118-го элемента.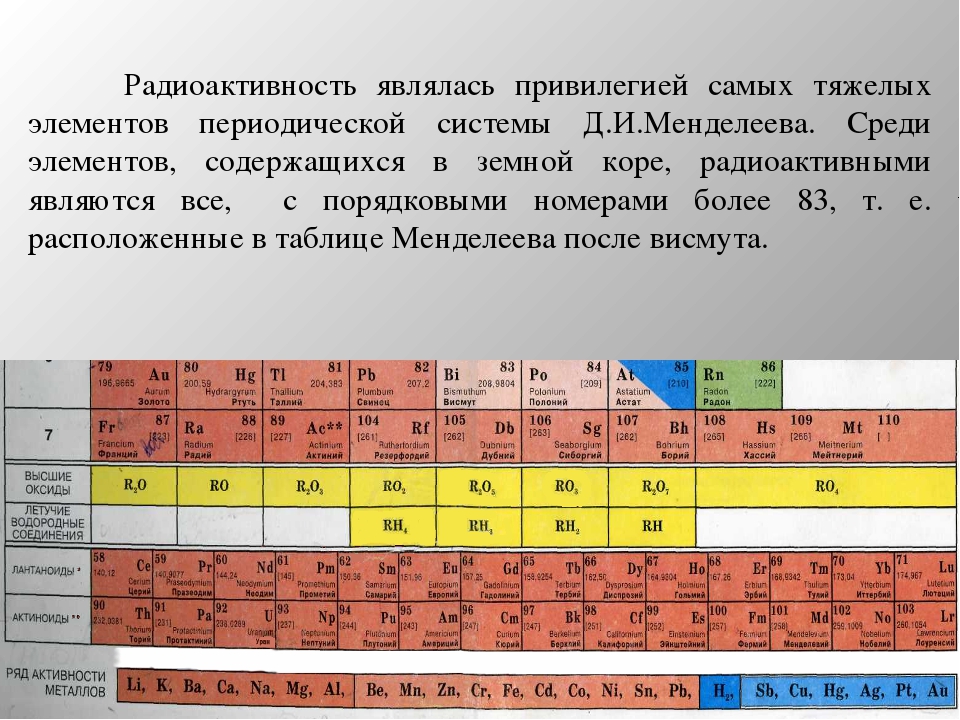 Кроме того, мы работаем с высокорадиоактивными материалами, и наши помещения должны отвечать специальным требованиям. Но когда создавалась лаборатория, их ещё не было. Сейчас строится отдельное здание с соблюдением всех требований радиационной безопасности — только для этих экспериментов. Ускоритель сконструирован для синтеза именно трансуранов. Мы будем, во-первых, подробно изучать свойства 117-го и 118-го элементов. Во-вторых, искать новые изотопы. В-третьих, пробовать синтезировать ещё более тяжёлые элементы. Можно получить 119-й и 120-й.
Кроме того, мы работаем с высокорадиоактивными материалами, и наши помещения должны отвечать специальным требованиям. Но когда создавалась лаборатория, их ещё не было. Сейчас строится отдельное здание с соблюдением всех требований радиационной безопасности — только для этих экспериментов. Ускоритель сконструирован для синтеза именно трансуранов. Мы будем, во-первых, подробно изучать свойства 117-го и 118-го элементов. Во-вторых, искать новые изотопы. В-третьих, пробовать синтезировать ещё более тяжёлые элементы. Можно получить 119-й и 120-й.
Планируются эксперименты с новыми материалами для мишеней?
Андрей Попеко: Мы уже начали работать с титаном. На кальций потратили в общей сложности 20 лет — получили шесть новых элементов.
К сожалению, научных областей, где Россия занимает ведущие позиции, не так много. Как нам удаётся побеждать в борьбе за трансураны?
Андрей Попеко: Собственно, здесь лидерами всегда были Соединённые Штаты и Советский Союз. Дело в том, что основным материалом для создания атомного оружия был плутоний — его требовалось как-то получать. Потом задумались: а не использовать ли другие вещества? Из ядерной теории следует, что нужно брать элементы с чётным номером и нечётным атомным весом. Попробовали кюрий-245 — не подошёл. Калифорний-249 тоже. Стали изучать трансурановые элементы. Так получилось, что первыми этим вопросом занялись Советский Союз и Америка. Потом Германия — там в 60-е годы была дискуссия: стоит ли ввязываться в игру, если русские с американцами уже всё сделали? Теоретики убедили, что стоит. В итоге немцы получили шесть элементов: со 107-го по 112-й. Кстати, метод, который они выбрали, разрабатывал в 70-е годы Юрий Оганесян. И он, будучи директором нашей лаборатории, отпустил ведущих физиков помогать немцам. Все удивлялись: «Как это?» Но наука есть наука, здесь не должно быть конкуренции. Если есть возможность получить новые знания, надо участвовать.
Дело в том, что основным материалом для создания атомного оружия был плутоний — его требовалось как-то получать. Потом задумались: а не использовать ли другие вещества? Из ядерной теории следует, что нужно брать элементы с чётным номером и нечётным атомным весом. Попробовали кюрий-245 — не подошёл. Калифорний-249 тоже. Стали изучать трансурановые элементы. Так получилось, что первыми этим вопросом занялись Советский Союз и Америка. Потом Германия — там в 60-е годы была дискуссия: стоит ли ввязываться в игру, если русские с американцами уже всё сделали? Теоретики убедили, что стоит. В итоге немцы получили шесть элементов: со 107-го по 112-й. Кстати, метод, который они выбрали, разрабатывал в 70-е годы Юрий Оганесян. И он, будучи директором нашей лаборатории, отпустил ведущих физиков помогать немцам. Все удивлялись: «Как это?» Но наука есть наука, здесь не должно быть конкуренции. Если есть возможность получить новые знания, надо участвовать.
Сверхпроводящий ECR-источник — при помощи которого получают пучки высоко-зарядных ионов ксенона, йода, криптона, аргона. Фото: Дарья Голубович/»Кот Шрёдингера»
Фото: Дарья Голубович/»Кот Шрёдингера»
В ОИЯИ выбрали другой метод?
Андрей Попеко: Да. Оказалось, что тоже удачный. Несколько позже подобные эксперименты стали проводить японцы. И синтезировали 113-й. Мы получили его почти на год раньше как продукт распада 115-го, но не стали спорить. Бог с ними, не жалко. Эта группа японская стажировалась у нас — многих из них мы знаем лично, дружим. И это очень хорошо. В некотором смысле это наши ученики получили 113-й элемент. Они же, кстати, подтвердили наши результаты. Желающих подтверждать чужие результаты немного.
Для этого нужна определённая честность.
Андрей Попеко: Ну да. А как по-другому? В науке, наверное, вот так.
Каково это — изучать явление, которое по-настоящему поймут от силы человек пятьсот во всём мире?
Андрей Попеко: Мне нравится. Я всю жизнь этим занимаюсь, 48 лет.
Большинству из нас невероятно сложно понять, чем вы занимаетесь. Синтез трансурановых элементов — не та тема, которую обсуждают за ужином с семьёй.
Андрей Попеко: Мы генерируем новые знания, и они не пропадут. Если мы можем изучать химию отдельных атомов, значит, обладаем аналитическими методами высочайшей чувствительности, которые заведомо пригодны для изучения веществ, загрязняющих окружающую среду. Для производства редчайших изотопов в радиомедицине. А кто поймёт физику элементарных частиц? Кто поймёт, что такое бозон Хиггса?
Да. Похожая история.
Андрей Попеко: Правда, людей, понимающих, что такое бозон Хиггса, всё же больше, чем разбирающихся в сверхтяжёлых элементах… Эксперименты на Большом адронном коллайдере дают исключительно важные практические результаты. Именно в Европейском центре ядерных исследований появился интернет.
Интернет — любимый пример физиков.
Андрей Попеко: А сверхпроводимость, электроника, детекторы, новые материалы, методы томографии? Всё это побочные эффекты физики высоких энергий. Новые знания никогда не пропадут.
Боги и герои. В честь кого называли химические элементы
В честь кого называли химические элементы
Ванадий, V (1801 г.). Ванадис — скандинавская богиня любви, красоты, плодородия и войны (как у неё всё это получается?). Повелительница валькирий. Она же Фрейя, Гефна, Хёрн, Мардёлл, Сюр, Вальфрейя. Это имя дано элементу потому, что он образует разноцветные и очень красивые соединения, а богиня вроде тоже очень красивая.
Ниобий, Nb (1801 г.). Изначально назывался колумбием в честь страны, откуда привезли первый образец минерала, содержащего этот элемент. Но потом был открыт тантал, который практически по всем химическим свойствам совпадал с колумбием. В итоге решено было назвать элемент именем Ниобы, дочери греческого царя Тантала.
Палладий, Pd (1802 г.). В честь открытого в том же году астероида Паллада, название которого тоже восходит к мифам Древней Греции.
Кадмий, Cd (1817 г.). Изначально этот элемент добывали из цинковой руды, греческое название которой напрямую связано с героем Кадмом. Сей персонаж прожил яркую и насыщенную жизнь: победил дракона, женился на Гармонии, основал Фивы.
Прометий, Pm (1945 г.). Да, это тот самый Прометей, который отдал огонь людям, после чего имел серьёзные проблемы с божественными властями. И с печенью.
Самарий, Sm (1878 г.). Нет, это не совсем в честь города Самары. Элемент был выделен из минерала самарскита, который предоставил европейским учёным горный инженер из России Василий Самарский-Быховец (1803-1870). Можно считать это первым попаданием нашей страны в таблицу Менделеева (если не брать в расчёт её название, конечно).
Гадолиний, Gd (1880 г. Назван в честь Юхана Гадолина (1760-1852), финского химика и физика, открывшего элемент иттрий.
Тантал, Ta (1802 г.). Греческий царь Тантал обидел богов (есть разные версии, чем именно), за что в подземном царстве его всячески мучили. Примерно так же страдали учёные, пытаясь получить чистый тантал. На это ушло больше ста лет.
Торий, Th (1828 г.). Первооткрывателем был шведский химик Йёнс Берцелиус, который и дал элементу имя в честь сурового скандинавского бога Тора.
Кюрий, Cm (1944 г.). Единственный элемент, названный в честь двух человек — нобелевских лауреатов супругов Пьера (1859-1906) и Марии (1867-1934) Кюри.
Эйнштейний, Es (1952 г.). Тут всё понятно: Эйнштейн, великий учёный. Правда, синтезом новых элементов никогда не занимался.
Фермий, Fm (1952 г). Назван в честь Энрико Ферми (1901-1954), итало-американского учёного, внёсшего большой вклад в развитие физики элементарных частиц, создателя первого ядерного реактора.
Менделевий, Md (1955 г.). Это в честь нашего Дмитрия Ивановича Менделеева (1834-1907). Странно только, что автор периодического закона попал в таблицу не сразу.
Нобелий, No (1957 г.). Вокруг названия этого элемента долго шли споры. Приоритет в его открытии принадлежит учёным из Дубны, которые назвали его жолиотием в честь ещё одного представителя семейства Кюри — зятя Пьера и Марии Фредерика Жолио-Кюри (тоже нобелевского лауреата). Одновременно с этим группа физиков, работавших в Швеции, предложила увековечить память Альфреда Нобеля (1833-1896). Довольно долго в советской версии таблицы Менделеева 102-й значился как жолиотий, а в американской и европейской — как нобелий. Но в итоге ИЮПАК, признавая советский приоритет, оставил западную версию.
Довольно долго в советской версии таблицы Менделеева 102-й значился как жолиотий, а в американской и европейской — как нобелий. Но в итоге ИЮПАК, признавая советский приоритет, оставил западную версию.
Лоуренсий, Lr (1961 г.). Примерно та же история, что и с нобелием. Учёные из ОИЯИ предложили назвать элемент резерфордием в честь «отца ядерной физики» Эрнеста Резерфорда (1871-1937), американцы — лоуренсием в честь изобретателя циклотрона физика Эрнеста Лоуренса (1901-1958). Победила американская заявка, а резерфордием стал 104-й элемент.
Резерфордий, Rf (1964 г.). В СССР он назывался курчатовием в честь советского физика Игоря Курчатова. Окончательное название было утверждено ИЮПАК только в 1997 году.
Сиборгий, Sg (1974 г.). Первый и единственный до 2016 года случай, когда химическому элементу присвоили имя здравствующего учёного. Это было исключение из правила, но уж больно велик вклад Гленна Сиборга в синтез новых элементов (примерно десяток клеток в таблице Менделеева).
Борий, Bh (1976 г.). Тут тоже была дискуссия о названии и приоритете открытия. В 1992 году советские и немецкие учёные договорились назвать элемент нильсборием в честь датского физика Нильса Бора (1885-1962). ИЮПАК утвердил сокращённое название — борий. Это решение нельзя назвать гуманным по отношению к школьникам: им приходится запомнить, что бор и борий — это совершенно разные элементы.
Мейтнерий, Mt (1982 г.). Назван в честь Лизы Мейтнер (1878-1968), физика и радиохимика, работавшей в Австрии, Швеции и США. Кстати, Мейтнер была одним из немногих крупных учёных, отказавшихся участвовать в Манхэттенском проекте. Будучи убеждённой пацифисткой, она заявила: «Я не стану делать бомбу!».
Рентгений, Rg (1994 г.). В этой клеточке увековечен открыватель знаменитых лучей, первый в истории нобелевский лауреат по физике Вильгельм Рентген (1845-1923). Элемент синтезировали немецкие учёные, правда, в исследовательскую группу входили и представители Дубны, в том числе Андрей Попеко.
Коперниций, Cn (1996 .). В честь великого астронома Николая Коперника (1473-1543). Как он оказался в одном ряду с физиками XIX-XX века, не совсем понятно. И уж совсем непонятно, как называть элемент по-русски: коперниций или коперникий? Допустимыми считаются оба варианта.
Флеровий, Fl (1998 г.). Утвердив это название, международное сообщество химиков продемонстрировало, что ценит вклад российских физиков в синтез новых элементов. Георгий Флёров (1913-1990) руководил лабораторией ядерных реакций в ОИЯИ, где были синтезированы многие трансурановые элементы (в частности, от 102-го до 110-го). Достижения ОИЯИ увековечены также в названиях 105-го элемента (дубний), 115-го (московий — в Московской области расположена Дубна) и 118-го (оганесон).
Оганесон, Og (2002 г.). Первоначально о синтезе 118-го элемента заявили американцы в 1999 году. И предложили назвать его гиорсий в честь физика Альберта Гиорсо. Но их эксперимент оказался ошибочным. Приоритет открытия признали за учёными из Дубны. Летом 2016 года ИЮПАК рекомендовал дать элементу название оганесон в честь Юрия Оганесяна.
Приоритет открытия признали за учёными из Дубны. Летом 2016 года ИЮПАК рекомендовал дать элементу название оганесон в честь Юрия Оганесяна.
Периодическая таблица химических элементов: окно во Вселенную
В этом году мы празднуем 150-ю годовщину одного из самых значительных достижений в науке, создания инструмента, который позволяет нам разобраться в основных компонентах нашей Вселенной, и который до сих пор питает исследования и инновации – Периодической таблицы химических элементов. Международный год Периодической таблицы химических элементов отдает должное потенциалу, позволяющему разрабатывать решения, необходимые для обеспечения устойчивого развития, и помогающему ученым предсказывать строение и свойства веществ. Международный год откроется 29 января проведением конференций и дебатов, подчеркивающих актуальность Периодической таблицы в решении соответствующих задач в таких разнообразных областях, как здравоохранение, продовольственная безопасность или энергетика. Данные мероприятия будут транслироваться онлайн в прямом эфире.
Данные мероприятия будут транслироваться онлайн в прямом эфире.
В 1869 году Дмитрий Менделеев заметил, что при систематизации известных элементов по атомному весу определенные типы элементов можно упорядочить. Эта система показала существования связи между структурой элементов и их свойствами, а также указала на пропуски между известными элементами, что позволило Менделееву предсказать существование элементов, которые до этого не были известны, что вскоре было подтверждено открытиями галлия (1875 г.), скандия (1879 г.) и германия (1887 г.).
Открытие Менделеева является важной вехой в растянувшейся на целое тысячелетие истории, берущей начало в IX веке, когда алхимик Джабир ибн Хайян впервые выделил в чистом виде химические элементы мышьяк (Ar) и сурьму (Sb).
Периодическая таблица позволила ученым прогнозировать строение и свойства элементов, которые ещё предстоит открыть. Несколько десятилетий спустя после обнаружения радиоактивных элементов, Мария Склодовская-Кюри и Ирен Кюри провели первые диагностические процедуры для раненых и контуженных солдат в мобильных фронтовых госпиталях, что стало первым применением радиации в медицине.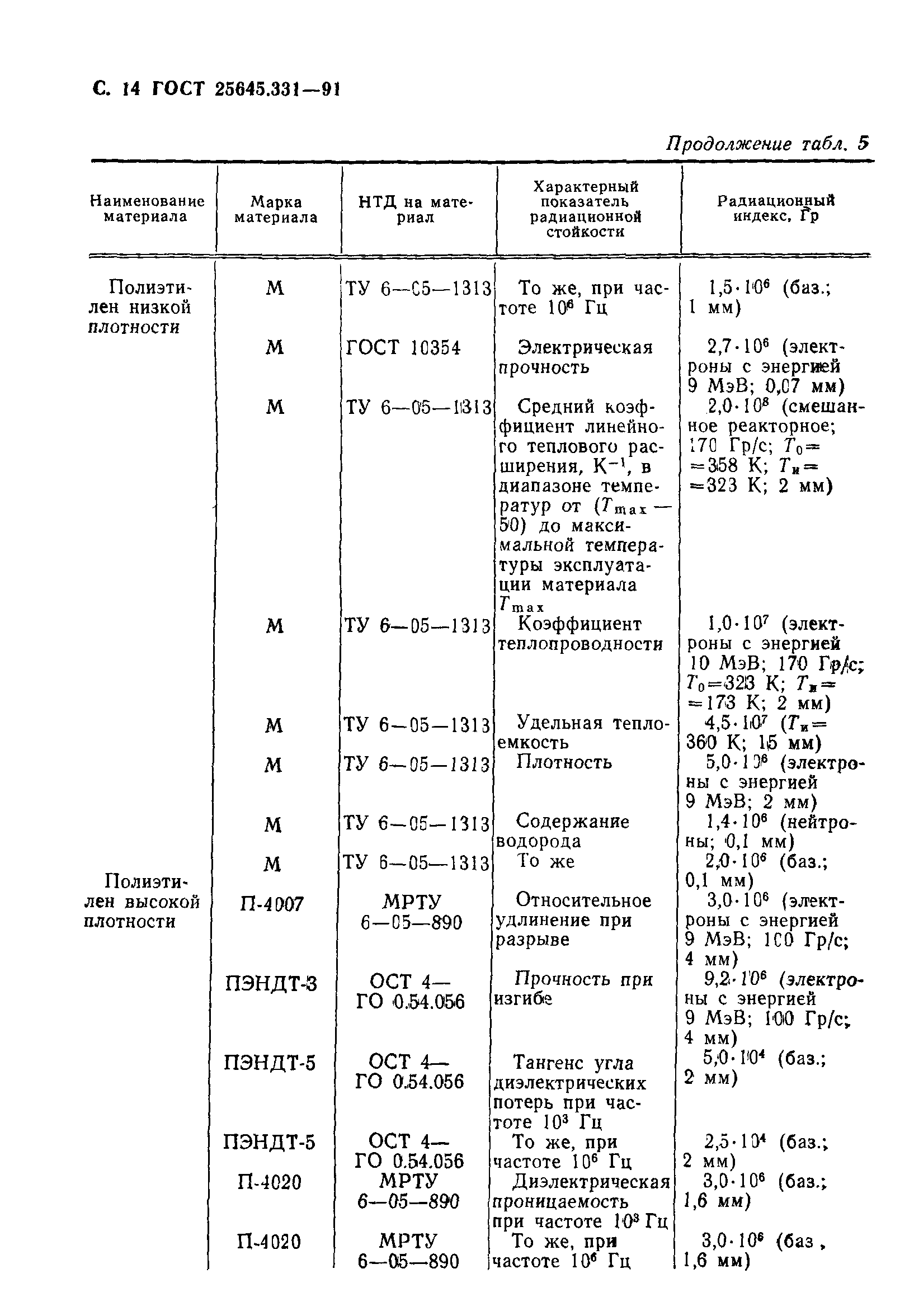 Сегодня ядерная медицина играет ключевую роль как в диагностике, так и таргетной терапии.
Сегодня ядерная медицина играет ключевую роль как в диагностике, так и таргетной терапии.
Первые искусственные элементы (нептуний и плутоний) были открыты в 1940-41 гг. Когда 1 марта 1869 года Менделеев закончил свой труд «Опыт системы элементов, основанной на их атомном весе и химическом сходстве» было известно всего около 60 элементов. Сегодня известно118 элементов, из которых первые 94 встречаются в природе на Земле, а остальные 24 являются синтетическими.
Поиски новых элементов продолжаются и вдохновляют нас на освоение космоса. Современные исследования показывают, что химические элементы составляют около 5% от общей массы-энергии Вселенной, а всё остальное состоит из «темной» энергии (69%) и «темной» материи (26%), природа которой до сих пор остается неизвестной. В поисках новых элементов были разработаный действенные квантовые прогностические методы, которые привели к открытию новых материалов и химических явлений, и расширили границы знаний.
Международный год Периодической таблицы химических элементов предоставляет возможность осмыслить многие аспекты Периодической таблицы, включая ее историю, социальные и экономические последствия, роль женщин в исследованиях, и глобальные тенденции в науке для её устойчивого развития.
Церемония открытия будет включать выступления лауреата Нобелевской премии по химии 2016 года Бернарда Феринга и Юрия Оганесяна, сыгравшего важную роль в синтезе и изучении новейших и самых тяжелых элементов от 104 до 118. В рамках мероприятия также состоится презентация инициативы «1001 изобретение: путешествие от алхимии к химии», которая будет способствовать научному образованию посредством мероприятий в реальном времени, научного театра и практических экспериментов.
Международный год Периодической таблицы химических элементов был провозглашен Генеральной Ассамблеей ООН. Его проведение координируется ЮНЕСКО совместно с Международным союзом теоретической и прикладной химии (IUPAC), Европейской ассоциацией химических и молекулярных наук (EuCheMS), Международным советом по науке (ISC), Международным астрономическим союзом (IAU), Международным союзом теоретической и прикладной физики (IUPAP) и Международным союзом истории и философии науки (IUHPST).
Элементы радиоактивные — Справочник химика 21
В 1900 г. Крукс (см. гл. 12) обнаружил, что свежеприготовленные соединения чистого урана обладают только очень незначительной радиоактивностью и что с течением времени радиоактивность этих соединений усиливается. К 1902 г. Резерфорд и его сотрудник английский химик Фредерик Содди (1877—1956) 5 высказали предположение, что с испусканием альфа-частицы природа атома урана меняется и что образовавшийся новый атом дает более сильное излучение, чем сам уран (таким образом, здесь учитывалось наблюдение Крукса). Этот второй атом в свою очередь также расщепляется, образуя еще один атом. Действительно, атом урана порождает целую серию радиоактивных элементов — радиоактивный ряд, включающий радий и полоний (см. разд. Порядковый номер ) и заканчивающийся свинцом, который не является радиоактивным. Именно по этой причине радий, полоний и другие редкие радиоактивные элементы можно найти в урановых минералах. Второй радиоактивный ряд также начинается с урана, тогда как третий радиоактивный ряд начинается с тория.
Крукс (см. гл. 12) обнаружил, что свежеприготовленные соединения чистого урана обладают только очень незначительной радиоактивностью и что с течением времени радиоактивность этих соединений усиливается. К 1902 г. Резерфорд и его сотрудник английский химик Фредерик Содди (1877—1956) 5 высказали предположение, что с испусканием альфа-частицы природа атома урана меняется и что образовавшийся новый атом дает более сильное излучение, чем сам уран (таким образом, здесь учитывалось наблюдение Крукса). Этот второй атом в свою очередь также расщепляется, образуя еще один атом. Действительно, атом урана порождает целую серию радиоактивных элементов — радиоактивный ряд, включающий радий и полоний (см. разд. Порядковый номер ) и заканчивающийся свинцом, который не является радиоактивным. Именно по этой причине радий, полоний и другие редкие радиоактивные элементы можно найти в урановых минералах. Второй радиоактивный ряд также начинается с урана, тогда как третий радиоактивный ряд начинается с тория. [c.164]
[c.164]
Радиоактивность (от лат. radio — излучаю и a tivus — деятельный) —самопроизвольное превращение неустойчивых (нестабильных) изотопов одного химического элемента в изотопы другого элемента, сопровождающееся испусканием элементарных частиц или ядер (напр., гелия). Существует а-распад, -распад, которые часто сопровождаются испусканием у-лучей, спонтанное деление и др. Скорость радиоактивного распада характеризуется периодо.м,полураспада (Т» / ). Наиболее распространенной единицей измерения Р. является кюри. Р. используется в науке, технике и медицине. См. Радиоактивные изотопы, Радиоактивные элементы. Радиоактивные изотопы — неустойчивые, самопроизвольно распадающиеся изотопы химических элементов. При радиоактивном распаде происходит превращение атомов Р. и. в атомы одного или нескольких других элементов. Известны Р. и. всех химических элементов. В природе существует около 50 естественных Р. и. с помощью ядерных реакций получено около 1500 искусственных Р, и.
 Активность Р. и. определяется числом радиоактивных распадов в данной порции Р. и. в единицу времени (единица активности — кюри). Р. и. характеризуются периодом полураспада (время, в течение которого активность убывает вдвое), типом и энергией (жесткостью) излучения. Р. и. широко используются в науке и технике как радиоактивные индикаторы и как источники излучений. В технике применяются только некоторые из искусственных Р. и.— наиболее дешевые, достаточно долговечные с легко регистрируемым излучением. Наиболее важные области применения — радиационная химия, изучение механизма различных химических процессов, в том числе в доменных и мартеновских печах, износа деталей машин, режущего инструмента, процессов диффузии и самодиффузии и др. В у-дефектоскопии используются Р. и. с у-излученнем для просвечивания изделий и материалов, для выявления внутренних дефектов. [c.110]
Активность Р. и. определяется числом радиоактивных распадов в данной порции Р. и. в единицу времени (единица активности — кюри). Р. и. характеризуются периодом полураспада (время, в течение которого активность убывает вдвое), типом и энергией (жесткостью) излучения. Р. и. широко используются в науке и технике как радиоактивные индикаторы и как источники излучений. В технике применяются только некоторые из искусственных Р. и.— наиболее дешевые, достаточно долговечные с легко регистрируемым излучением. Наиболее важные области применения — радиационная химия, изучение механизма различных химических процессов, в том числе в доменных и мартеновских печах, износа деталей машин, режущего инструмента, процессов диффузии и самодиффузии и др. В у-дефектоскопии используются Р. и. с у-излученнем для просвечивания изделий и материалов, для выявления внутренних дефектов. [c.110]ПРЕВРАЩЕНИЕ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ РАДИОАКТИВНОЕ ПРЕВРАЩЕНИЕ [c.14]
ТРАНСУРАНОВЫЕ ЭЛЕМЕНТЫ (за-урановые элементы) — радиоактивные химические элементы, расположенные вслед за ураном в конце периодической системы элементов Д. И. Менделеева. Т. э. имеют п. н. 93—103, принадлежат к группе актиноидов. Все изотопы Т. э. обладают периодами полураспада, значительно меньшими, чем возраст Земли, поэтому они отсутствуют в природе и получаются искусственно посредством различных ядерных реакций. Исследование физических свойств Т. э. показало, что они аналоги лантаноидов. Из всех Т. э. наибольшее значение имеет зврц как ядерное топливо, используется в изотопных источниках тока, применяемых для питания радиоаппаратуры на спутниках и др. [c.253]
На управляемых реакциях деления ядер (урана, плутония) основано действие ядерных реакторов. Расщепление ядер в атомных реакторах используется для производства энергии, получения трансурановых элементов, радиоактивных изотопов других элементов и и др. [c.661]
Естественные радиоактивные изотопы, т. е. изотопы, образующиеся в природе помимо деятельности человека, были обнаружены у очень многих элементов начала и середины периодической системы. В табл. 10 приводятся естественные радиоактивные изотопы элементов с порядковыми номерами от 1 до 83 (т. е. до тех естественных элементов, радиоактивные свойства которых были давно открыты и изучены), радиоактивность которых в настоящее время бесспорно установлена. Из табл. 10 видно, что, помимо девяти тяжелых радиоактивных элементов, известных еще с первых десятилетий исследования радиоактивности (полоний, астат, радон, франций, радий, актиний, торий, протактиний и уран ), естественные радиоактивные изотопы существуют, по крайней мере, еще у 46 химических элементов. Таким образом, большая часть элементов периодической системы обладает естественной радиоактивностью. [c.60]
В том же 1913 г. Мозли дает в руки исследователей рентгеноспектральный метод определения положительного заря/ а ядра элемента, а следовательно, его места в Периодической системе. Это способствовало поиску новых радиоактивных элементов и исправлению порядковых номеров элементов. Была установлена правильная последовательность превращений одних радиоактивных изотопов в другие, открыты пропущенные звенья в цепи генетически связанных элементов — радиоактивных рядах. В это время радиохимия как наука о химических и физико-химических свойствах радиоактивных элементов разрабатывает свои специфические методы исследования. В ее задачу входит широкий круг вопросов, связанных с проблемами разделения, очистки, концентрирования радиоактивных элементов. Таким образом, открытие радиоактивности было важной вехой на пути познания окружающего мира. Изучение же радиоактивности дало неопровержимые доказательства сложности структуры атома. Оно стало основным фактом, опровергающим представления о неизменности атомов, и показало, что в определенных условиях одни атомы разрушаются, превращаясь в другие. [c.394]
Хроматографический анализ прост и настолько чувствителен, что с его помощью разделяют вещества, весьма близкие по природе редкоземельные элементы, радиоактивные изотопы, различные пигменты, белки и т. д. [c.294]
Со временем были заполнены три оставшихся в периодической таблице пробела (см. гл. 8). В 1939 и 1940 гг. были открыты элементы номер 87 (франций) и номер 85 (астат), а в 1947 г.— элемент номер 61 (прометий). Все эти элементы радиоактивны. [c.174]
Трансурановые элементы (заурановые элементы) — радиоактивные химические элементы, расположенные вслед за ураном в периодической системе Д. И. Менделеева. Атомные номера 93. Большинство известных трансурановых элементов (93—103) принадлежит к числу актиноидов. Все изотопы их имеют период полураспада значительно меньший, чем возраст Земли. Поэтому Т. э. практически отсутствуют в природе и получаются искусственно посредством различных ядерных реакций. Первый из трансурановых элементов нептуний Np (п. н. 93) был получен в 1940 г. бомбардировкой урана нейтронами. За ним последовало открытие плутония (Ри, п. н. 94), америция (Ага, п. н. 95), кюрия (Сга, п. н. 96), берклия (Вк, п. н. 97), калифорния( f, п. н. 98), эйнштейния (Es, п. н. 99), фермия (Рш, п.н. 100), менделевия (Md, п. н. 101), нобелия (No, п. н. 102), лоуренсия (Lr, п. н. 103) и курчатовия (Ки, п. н. 104). Так же получены Т. э.с порядковым номером 105— 106. Более или менее полно изучены химические свойства Т. э. Криста.члографи-ческне исследования, изучение спектров поглощения растворов солей, магнитных свойств ионов и других свойств Т. э. показали, что элементы с п. н. 93—103 — аналоги лантаноидов. Из всех Т. э. наибольшее применение нашел Ри как ядерное горючее. [c.138]
Как говорится, что хотели, то и получили Но эта связь не носит характера закономерного синтеза знаний. Это формальное совмещение двух «снимков», разноуровневых по смыслу, на общее «клише». Я не оспариваю целесообразности такого метода сопряжения знаний вообще. Но в этом аспекте, в каком мы рассматриваем множество атомов, его не назовешь генетически последовательным, потому что смысл элемента радиоактивного ряда (атом) искусственно расширен до смысла химического элемента, чтобы стать адекватным первоэлементу в структуре Периодической системы. Как видим, здесь обошлось без натяжки. [c.103]
Вернадский Владимир Иванович (1863—1945)—выдающийся советский минералог и кристаллограф, основоположник геохимии, биогеохимии, радиогеологии и учения о биосфере. Академик АН СССР. Занимался изучением редких и рассеянных элементов, радиоактивных элементов в земной коре. Лауреат Государственной премии. [c.428]
Как правило, искусственные радиоэлементы распадаются с отщеплением электрона или позитрона, причем соблюдается следующая закономерность относительно тяжелые (по сравнению со средним атомным весом данного элемента) радиоактивные изотопы испускают электроны, относительно легкие — позитроны. Довольно часто происходит также одновременное выделение у-лучей. [c.519]
Все изотопы трансурановых элементов радиоактивны, их период полураспада значительно меньше возраста нашей планеты, а потому в природе в ощутимых количествах не встречаются, [c.286]
При рассмотрении свойств галогенов всегда надо учитывать особенности фтора и его соединений. Следует отдельно рассматривать свойства А1, так как он является элементом радиоактивным (п. 2). [c.127]
Устойчивость тяжелых ядер определяется параметром Бора, т. е. отношением 2 /Л. Если больше 33, то все изотопы данного элемента радиоактивны . Есте- [c.58]
Изучение Р. сьп рало огромную роль в развитии научного познания, т. к. позволило выяснить мн. вопросы, связанные с явлением радиоактивности. Длит, время Р. был единств, элементом, радиоактивные св-ва к-рого находили практич. применение в медицине, для приготовления люминофоров постоянного свечения и др. Добыча Р. в 30-е гг. достигала более 350 г в год. Однако в 50-е гг. Р. почти повсеместно был вытеснен другими, более дешевыми искусственно получаемыми радионуклидами. Р. сохранил нек-рое значение в медицине как источник Нп для приготовления радоновых ванн. В небольших кол-вах Р. в смеси с Ве используют в ампульных источниках нейтронов. [c.154]
Иногда в составе почвенного воздуха могут присутствовать некоторые газы, диффундирующие через толщи горных пород из мест их скопления. В результате этого явления почвы над нефтяными и газовыми месторождениями бывают обогащены углеводородами над скоплениями радиоактивных элементов — радиоактивными эманациями, отчасти гелием. На этом основаны специальные газовые геохимические методы поисков месторождений полезных ископаемых (нефтегазовая съемка, эманационная съемка и др.). [c.63]
Во всех случаях эффективность выбранной схемы разделения можно проконтролировать методом радиоактивных индикаторов. Для этого в искусственно приготовленный исходный раствор вводят радиоактивный индикатор одного из определяемых элементов или какой-либо возможной примеси и в соответствии с разработанной схемой выделяют элементы, эффективность радиохимической очистки которых хотят оценить. Отношение исходной активности к активности радиоактивного индикатора, которая попадает в конечную фракцию исследуемого элемента, является мерой эффективности выбранной схемы выделения и называется коэффициентом очистки относительно элемента, радиоактивный индикатор которого был введен в исходный раствор. [c.154]
ИЛИ 0,22 г изотопа С) составляет один кюри (Ки). Один милликюри (мКи) —это 2,22-Ю расп.-мин . Меченое соединение обычно содержит сравнительно мало радиоактивного изотопа по сравнению со стабильным изотопом того же элемента. Радиоактивные препараты характеризуют их суммарной радиоактивностью, выражаемой в милли- или микрокюри, и удельной активностью — мКи-ммоль . Например, если соединение содержит в каком-то одном положении изотоп и обладает удельной активностью 50 мКи-ммоль , то содержится в этом положении в количестве 0,17%. [c.170]
Характеристика элемента. Радиоактивный элемент III группы периодической системы, относится к семейству актиноидов. Атомный но мер 92. Металлический У. является самым тяжелым химическим элементом из всех, содержащихся в земной коре. Природный У. состоит из смеси трех изотопов (99,2739 %), а-излучатель с периодом полураспада 4,51-10 лет, числом распадов 442 на 1 мг в 1 мин, энергией излучения 4,18 МэВ (0,7024%), а-излучатель с периодом полурас- [c.268]
Анализ образцов с короткоживущей основой. Совершенно очевидно, что у-спектрометрию можно успешно применять и в случае, когда в результате активации основы образуется более короткоживущий изотоп, чем радиоактивные изотопы определяемых элементов. В этом случае активности примесей можно измерить после распада мешающей активности до ничтожно малого уровня, что обычно требует выдерживания образца в течение 10 периодов полураспада или более. Поэтому от периода полураспада основы зависят круг определяемых элементов, радиоактивные изотопы которых должны иметь достаточно большой период полураспада, и продолжительность анализа. [c.259]
Известные изотопы трансурановых элементов радиоактивны. [c.155]
Стандарты определяемых элементов, которые готовились из химически чистых металлов или соединений, объединялись в группы в соответствии со схемой анализа. В каждой группе весовые количества элементов выбирались с таким расчетом, чтобы после облучения элементы, радиоактивные изотопы которых имеют жесткое у-излучение, давали бы небольшую, но четко регистрируемую активность. Для элементов, изотопы которых имеют более мягкое у-излучение, брали такие количества, чтобы получить более высокий уровень активности. Этз мера позволяет избежать затруднений, связанных с непрерывным комптоновским распределением от жестких у-линий, и проводить точные измерения площадей пиков. [c.281]
Определяемый элемент Радиоактивный изотоп, по которому проводится идентификация Чувствитель ность определения, % Характеристические Y-линии, Мэе [c.93]
Радиоактивные элементы. К примесям природных вод относятся и радиоактивные элементы. Радиоактивность в той или иной мере свойственна всем водам [80—83]. Допустимым пределом радиоактивности в обычной питьевой воде считается 10 — 10 мкКи/л. Радиоактивность некоторых минеральных вод достигает 2,8 10 мкКи/л. [c.39]
В каждой группе эталонов количества элементов выбирают с таким расчетом, чтобы после облучения для элементов, радиоактивные изотопы которых дают более жесткое уизлучение, могла бы быть получена небольшая, но четко регистрируемая активность в 10—20 раз выше предела чувствительности, а для элементов, даюш,их изотопы, с более мягким у-излучением берут несколько большие количества, для того чтобы получить более высокий уровень активности. Эта мера позволяет избежать затруднений, связанных с непрерывным комптоновским распределением от жесткого у-излучения и проводить точное измерение площадей пиков соответствующих эталонов. Точные объемы растворов групповых эталонов отбирают в полиэтиленовые ампулы весовым методом, высушивают в вакуумном эксикаторе при 60° С. запаивают, обертывают алюминиевой фольгой и помещают в контейнер для облучения вместе с образцами. После облучения содержимое ампул переносят в тефлоновые чашки растворами различных кислот (в зависимости от группы), к которым добавлено по 10 мкг носителей элементов данной группы, и растворы выпаривают досуха. [c.98]
Недеструктивный, чувствительный ко всем газам и парам, имеющий большой выбор газов-носителей, обладающий малым рабочим объемом и хорошим быстродействием ультразвуковой детектор, кроме того, достаточно прост, надежен и безопасен в работе, так как не имеет чувствительных элементов, радиоактивных источников и не требует применения водорода. [c.142]
Кроме перечисленных элементов радиоактивностью обладают и остальные элементы последнего ряда периодической системы. Наиболее сильной радиоактивностью обладает радий, который изучен лучше других. [c.180]
Элементы с порядковыми номерами 43, 61 и 84—104, для которых не известно ни одного устойчивого изотопа, называются радиоактивными. У других элементов радиоактивность присуща только некоторым изотопам. Нет ни одного элемента, для которого не были бы известны радиоактивные изотопы, в настоящее время число радиоактивных изотопов достигает 1500. [c.40]
TOB. Чаще всего эти побочные радиоактивные изотопы получаются также без изотопного носителя, поэтому встает задача отделения нужного радиоизотопа от радиоизотопов других элементов. Действительное количество неактивных изотопов этого же элемента, содержащихся в выделенном радиоактивном изотопе без носителя , определяется содержанием примеси в материале мишени и в реактивах. В связи с этим необходима тщательная очистка материала мишени и всех используемых реагентов от элемента, радиоактивный изотоп которого получают. При получении радиоизотопов без носителей предпочитают экстрагировать сам активный изотоп, отделяя его от основной массы материала мишени и от большинства радиоактивных примесей. Если изотопы-примеси получаются без носителя, то перед выделением иногда добавляют небольшие количества их носителей, что делается для увеличения чистоты выделяемого радиоизотопа. [c.322]
Общая радиохимия занимается изучением физико-химических закономерностей поведения радиоактивных изотопов и элементов. Радиоактивные элементы и изотопы во многих случаях получают и применяют в недоступных для взвешивания количествах. [c.10]
Если в соединении элемент, радиоактивный изотоп которого введен в молекулу, содержится в нескольких различных положениях в молекуле, то в ряде случаев необходимо определение удельной активности отдельно по разным положениям элемента в молекуле — внутримолекулярного распределения. [c.500]
В настоящее время можно определить радиохимию как химию радиоактивных веществ (радиоактивных элементов, радиоактивных изотопов и их соединений) и химию процессов, индуцированных ядерными превращениями. Признаком, отличающим радиохимию от всех других химических дисциплин, является радиоактивность и связанные с ней специфические особенности как самих объектов исследования, так и применяемых методов. [c.13]
Все радиоактивные элементы и изотопы, как известно сейчас объединены в семейства распадаясь, ядро радио активного атома превращается в атомное ядро другого дочернего элемента. Все элементы радиоактивных се мейств находятся между собой в определенном равнове сии. Измерено, что в урановых рудах равновесное отно шепие урана к полонию составляет 1,9-10 , а в равпове сии с граммом радия находятся 0,2 мг полония. Это зна чит, что в урановых минералах радия почти в 4 млн раз меньше, чем урана, а полония еще в 5 тыс. ра меньше. [c.286]
Для выделения групп изотопов или отдельных изотопов элементов радиоактивных семейств используются разнообразные методы, в том числе метод активных осадков, сущность которого заключается в улавливании на катоде продуктов распада эманации [60]. В сосуд, на дне которого находится высокоэманирующий препарат радиотория, актикия или радия, понещаетси илатиновый или танталовый катод (потенциал 600—800 в), укрепленный при помощи держателя, изолированного от корпуса. Образующиеся в результате распада эманаций положительно заряженные ионы активного осадка улавливаются на катоде, с которого затем могут быть удалены обработкой горячей разбавленной азотной кислотой. [c.42]
Метод зманирования нашел применение для определения величины поверхности образцов, содержащих материнский элемент радиоактивного благородного газа [29], Так, при исследовании меченных торйём-228 гидроокисей цинка, никеля, магния, алюминия, тория и циркония найдено, что удельная поверхность гидроокисей указанного ряда меняется от 30 до 190 м г [369]. [c.196]
Использование неизотопных индикаторов позволяет определять при совместном присутствии даже три элемента. Радиоактивными индикаторами в этом случае должны быть изотопы элементов, имеющих наибольшую и наименьшую константу экстракции Индикаторы являются неизотопными по отношению к элементу с константой экстракции промежуточной величины. Так, при титровании смеси Ag — Сп — d раствором дитизона в качестве радиоизотопов использовали и Сс1 , при титровании смеси Hg—Си— —7п — изотопы Hg2 з и [673]. При постепенном добавлении дитизона сначала экстрагируется ртуть (последний пример), затем медь и, наконец, цинк. В работе [668] показана аналогичная возможность титрования смеси Hg—Ag—2п (при двух различных pH). Кривые титрования трех элементов с двумя радиошстивными индикаторами показаны на рис. 65. [c.209]
Наконец, третья гипотеза — и здесь мы снова видим, что химия апнелирует к физике кончается второй химический этап в биографии шестьдесят первого элемента. Согласно третьей гипотезе, которая принадлежит И. Ноддак, эка-неодим является элементом радиоактивным с очень небольшим периодом полураспада. Когда-то он содержался в земной коре, но за нредшествуюш,ие нашему времени геологические эпохи распался нацело. [c.166]
Радиоактивный распад | Агентство по охране окружающей среды США
Радиоактивный распад — это излучение энергии в виде ионизирующего излучения. Ионизирующее излучение. Излучение с такой большой энергией, что оно может выбивать электроны из атомов. Ионизирующее излучение может воздействовать на атомы в живых существах, поэтому оно представляет опасность для здоровья, повреждая ткани и ДНК в генах. Ионизирующее излучение, которое испускается, может включать альфа-частицы альфа-частицы Форма ионизирующего излучения твердых частиц, состоящая из двух нейтронов и два протона.Альфа-частицы не представляют прямой или внешней радиационной угрозы; однако они могут представлять серьезную угрозу для здоровья при проглатывании или вдыхании., бета-частицы бета-частицы Форма ионизирующего излучения твердых частиц, состоящая из небольших, быстро движущихся частиц. Некоторые бета-частицы способны проникать через кожу и вызывать такие повреждения, как ожоги кожи. Бета-излучатели наиболее опасны при вдыхании или проглатывании. и / или гамма-лучи гамма-лучи Форма ионизирующего излучения, состоящая из невесомых пакетов энергии, называемых фотонами.Гамма-лучи могут полностью проходить через человеческое тело; Проходя через них, они могут вызвать повреждение тканей и ДНК. Радиоактивный распад происходит в несбалансированных атомах, называемых радионуклидами.
Элементы периодической таблицы могут принимать разные формы. Некоторые из этих форм стабильны; другие формы нестабильны. Обычно наиболее устойчивая форма элемента является наиболее распространенной в природе. Однако все элементы имеют нестабильную форму. Неустойчивые формы излучают ионизирующее излучение и радиоактивны. Некоторые элементы, не имеющие стабильной формы, всегда радиоактивны, например уран.Элементы, излучающие ионизирующее излучение, называются радионуклидами.
При распаде радионуклид превращается в другой атом — продукт распада. Атомы продолжают превращаться в новые продукты распада, пока не достигнут стабильного состояния и не перестанут быть радиоактивными. Большинство радионуклидов распадаются только один раз, прежде чем становятся стабильными. Те, которые распадаются более чем за одну ступень, называются серийными радионуклидами. Серия продуктов распада, созданная для достижения этого баланса, называется цепочкой распада. Цепочка распада . Серия распадов или превращений, через которые радионуклиды проходят, прежде чем достичь стабильной формы.Например, цепочка распада, которая начинается с урана-238, достигает высшей точки в свинце-206 после образования промежуточных продуктов, таких как уран-234, торий-230, радий-226 и радон-222. Также называется «серией распада».
Каждая серия имеет свою уникальную цепочку распада. Продукты распада в цепи всегда радиоактивны. Только последний стабильный атом в цепочке не является радиоактивным. Некоторые продукты распада — это другой химический элемент.
Каждый радионуклид имеет определенную скорость распада, которая измеряется в терминах «период полураспада период полураспада » Время, необходимое для распада или преобразования половины имеющихся радиоактивных атомов.У некоторых радионуклидов период полураспада составляет всего секунды, а у других период полураспада составляет сотни или миллионы лет. «Период полураспада радиоактивных веществ — это время, необходимое для распада половины имеющихся радиоактивных атомов. У некоторых радионуклидов период полураспада составляет всего за секунды, а у других период полураспада составляет сотни, миллионы или миллиарды лет.
радиоактивных элементов | Департамент здравоохранения штата Вермонт
Радиоактивные материалы выделяют форму энергии, называемую ионизирующим излучением.Когда человек вступает в контакт с излучением, энергия может поглощаться телом.
Следующие радиоактивные элементы встречаются в окружающей среде естественным образом.
Альфа-излучение
Альфа-излучение — это тип энергии, выделяющейся при распаде или разрушении определенных радиоактивных элементов. Например, уран и торий — два радиоактивных элемента, которые естественным образом встречаются в земной коре. В течение миллиардов лет эти два элемента медленно меняют форму и производят продукты распада, такие как радий и радон.Во время этого процесса высвобождается энергия. Одна из форм этой энергии — альфа-излучение.
Узнать больше об альфа-излучении в питьевой воде
Уран
Уран — радиоактивный элемент, который можно найти в почве, воздухе, воде, камнях, растениях и продуктах питания. Уран очень медленно распадается или распадается на другие элементы, включая радий и радон.
Узнать больше об уране в питьевой воде
Радий
Радий — это радиоактивный металл, который можно найти в разном количестве по всему Вермонту и на всей Земле — в почве, воде, камнях, растениях и продуктах питания.
Узнать больше о радии в питьевой воде
Радон
Радон — радиоактивный газ, не имеющий цвета, запаха и вкуса. Радон образуется при распаде урана, который является радиоактивным элементом, естественным образом обнаруживаемым в земной коре. За миллиарды лет уран распадается на радий и, в конечном итоге, на радон.
Подробнее о радоне в воздухе помещений и питьевой воде
Полоний
Полоний (Po-210) — это радиоактивный материал, который в природе встречается в окружающей среде в очень низких концентрациях.Его можно производить на университетских или государственных ядерных реакторах, но для этого требуются специальные знания.
Po-210 становится радиационной опасностью только в том случае, если он попадает внутрь организма через дыхание, еду или попадание через рану. Это внутреннее заражение может вызвать облучение органов, что может привести к серьезным медицинским симптомам или смерти. По-210 и его излучение не проникают через неповрежденную кожу или мембраны. Это не внешняя опасность для тела. Большинство следов можно удалить путем тщательной мойки.
Узнать больше о полонии
Частей Периодической таблицы
Актиниды , элементы 90-103, следуют за актинием на периодическая таблица. Они имеют электронную конфигурацию 5 f x 6 d 1 7 с 2 . За исключением актиния, тория и урана актиниды не обнаружены естественно, и вместо этого производятся синтетически путем бомбардировки нейтронами. или в ускорителях частиц.
Торий (Th, Z = 90)
Торий — мягкий серебристый радиоактивный металл. Он назван в честь Тор, норвежский бог грома. Он находится в земной коре на концентрация 12 частей на миллион, что делает его 37-м наиболее распространенным элементом, и самый распространенный из актинидов. Встречается в рудах торита. [ThSiO 4 ], ураноторит [(U, Th) SiO 4 ] и торианит [ThO 2 ].Он также содержится в монаците (см. Введение для разреза лантаноидов) как оксид тория, ThO 2 , в концентрациях до 12%.
Торий медленно реагирует на воздухе и в воде. Оксид образует защитное покрытие по металлу, что делает его устойчивым при высоких температурах. В своих соединениях он находится в степени окисления +4. Все изотопы тория радиоактивны; самый стабильный изотоп — это торий-232 с периодом полураспада 14 000 000 000 лет; этот изотоп содержит почти 100% тория, встречающегося в природе в мире. Поскольку торий является слабым альфа-излучателем, его относительно безопасно использовать в некоторые коммерческие приложения. Торий используется как легирующий агент. для некоторых металлов, таких как магний, для улучшения их высокотемпературной сила. Он также используется в электронных фотодатчиках для измерения ультрафиолетовое излучение.
Оксид тория (IV), ThO 2 , использовался в мантии в переносные газовые фонари. Это ингредиент некоторых высококачественных линзы, так как образует очки с высоким показателем преломления и низким дисперсия.Он также используется в высокотемпературной лаборатории. тиглей, так как он имеет очень высокую температуру плавления 3300 ° C. это также используется в качестве катализатора превращения аммиака в азотную кислоту, в крекинг нефти и производство серной кислоты.
Торий-232 может быть преобразован в торий-233 путем бомбардировки нейтронов, затем распадаясь на протактиний-233, а затем на уран-233. Уран-233 делится по цепочке ядер реакция, и этот цикл может быть использован в ядерном синтезе растения.Поскольку тория больше, чем урана, это может быть некоторые надежды появятся в последующих поколениях атомных электростанций.
Протактиний (Па, Z = 91)
Протактиний — серебристо-белый радиоактивный металл. Его имя происходит от греческого слова proto и actinium , что означает «родитель актиния», потому что он подвергается радиоактивному распаду с образованием актиний.Он содержится в земной коре в незначительных количествах и является среди десяти наименее распространенных элементов. Встречается в урановых рудах. такие как уран, в очень низких концентрациях.
Протактиний чрезвычайно радиоактивен. На воздухе медленно окисляется. В своих соединениях он находится в степенях окисления +4 и +5. Есть два встречающихся в природе изотопа протактиния: протактиний-234 с периодом полураспада 6 часов 42 минуты, и протактиний-231 с периодом полураспада 32 500 лет.Потому что это так высокорадиоактивный и токсичный, коммерческое применение для протактиний.
Уран (U, Z = 92)
Уран — блестящий, серебристо-белый, твердый, плотный, пластичный, радиоактивный металл. Он назван в честь планеты Уран, которая когда-то была открыли за несколько лет до открытия элемента в 1789 году. планета Уран, в свою очередь, была названа в честь греческого бога неба.) Он содержится в земной коре в концентрации 2 ppm, что делает его 48-й по численности элемент. Встречается в урановых рудах. [в основном оксид урана (IV), UO 2 ], уранинит [UO 2 , UO 3 , и следы других минералов], аутунит [Ca (UO 2 ) 2 (PO 4 ) 2 (10-12) H 2 O], карнотит [K 2 (UO 2 ) 2 (VO 4 ) 2 3H 2 O], самарскит [(Y, Fe, U) (Nb, Ta) 5 O 4 и следы других редкоземельных элементов элементы], торбернит [Cu (UO 2 ) 2 (PO 4 ) 2 (8-12) H 2 O], бетафит [(Ca, U) 2 (Ti, Nb, Ta) 2 O 6 (OH)], уранофан [Ca (UO 2 ) 2 (SiO 3 ) 2 (OH) 2 5H 2 O], и коффинит [U (SiO 4 ) 1-x (OH) 4x ]. Бурый уголь и монацитовая руда также содержат следовые количества урана.
Уран тускнеет на воздухе, образуя оксидное покрытие. В своем соединений, уран обычно находится в степенях окисления +4 или +6. Во многих соединениях уран присутствует в виде уранил-иона, UO 2 2+ .
Одно из важнейших свойств урана не было обнаружено. до 1896 года, когда Анри Беккерель обнаружил, что уран радиоактивен. В одном из классических примеров «случайного» открытия в науке он поместил образец солей урана рядом с фотопластинкой, намереваясь изучить фосфоресценцию урана при воздействии солнечного света. Однако он обнаружил, что пластины были обнажены, хотя образец остался в темноте, и понял, что уран был самопроизвольно испускать излучение, не связанное с каким-либо внешняя стимуляция.Он разделил Нобелевскую премию по физике за открытие радиоактивности с Пьером и Мари Кюри в 1903 году.
Есть три основных встречающихся в природе изотопа урана (там довольно много других изотопов, но их периоды полураспада относительно короткие, и они не встречаются в каких-либо значительных количествах в природных источниках). Основным изотопом является уран-238, содержание которого составляет 99,275%; Это имеет период полураспада 4.4610 9 гг. Он испускает альфа-частицы и гамма-лучи, не расщепляется, поглощает нейтроны вместо расщепления. Уран-235, которого много 0,720%, имеет период полураспада 7,0410 8 годы. Он также излучает альфа-частицы и гамма-лучи, а его мощность составляет баллов. расщепляющийся , расщепляющийся на более легкие атомы при ударе нейтрона. Уран-234, период полураспада которого составляет 245000 лет, находится в очень низких концентрациях. концентрации, около 0.005%, и образуется как часть распада последовательность урана-235. Уран-235 в конечном итоге распадается на свинец-206, а уран-238 — в свинец-207. Радиоактивный распад изотопы урана вносят большой вклад во внутреннее тепло Земля. Относительные количества урана и свинца в горных породах могут быть используется в методах радиоактивного датирования.
Когда нейтроны выстреливают по урану-235, чрезвычайно нестабильный образуется изотоп урана-236, который быстро распадается на две более мелкие ядра (такие как барий и криптон), освобождая часть ядерной связи энергия и больше нейтронов.Этот процесс известен как ядерный процесс . Ашхабад . Эти нейтроны могут столкнуться с другим ураном-235. изотопы, заставляя их расщепляться и выделять энергию и даже больше нейтронов в цепной реакции. На атомных электростанциях топливные стержни содержат уран или оксид урана, обогащенный до 2–3% урана-235. Замедлители, такие как бериллий, графит, вода или тяжелая вода (D 2 O) замедляют нейтроны, которые высвобождаются в реакциях деления, производя «тепловые нейтроны», которые могут быть захвачены атомами урана, а не просто отскакивает.(В «легководных» реакторах замедлителем является обычная вода — т.е. вода, содержащая изотоп водород-1; эти для реакторов требуется обогащенный уран. В реакторах «тяжелой воды» замедлитель D 2 O — т.е. вода, содержащая дейтерий, изотоп водорода-2; в этих реакторах можно использовать природный необогащенный уран.) Скорость ядерных реакций контролируется регулирующими стержнями, которые содержат элементы, способные поглощать нейтроны, не подвергаясь деление, такое как серебро, индий, кадмий, бор, кобальт, гафний, гадолиний и европий.Поднимая тяги управления из реактор позволяет реакции ускориться, при этом опуская их в реактор замедляет реакцию и предотвращает неуправляемую цепную реакцию происходит.
В атомных бомбах реакция выходит из-под контроля, вызывая огромный взрыв, высвобождающий огромное количество энергии и радиации. Взорвавшаяся атомная бомба «Маленький мальчик» в Хиросиме, Япония, 6 августа 1945 г. была заложена урановая бомба, имеющая разрушительный потенциал 12 500 тонн в тротиловом эквиваленте, и погибло более 75 000 человек. В этой бомбе были собраны два куска докритического урана. быстро взрывчаткой, делая критическую массу урана, в которой может произойти неконтролируемая цепная реакция.
Один способ обогащения урана делящимся изотопом уран-235 это по преобразование его в форму летучего гексафторида урана, UF 6 , который переходит в газовую фазу при 56,5 ° C. Затем газ распространяется через серию проницаемые мембраны: начиная с 235 UF 6 на 3 атомные единицы массы легче, чем 238 UF 6 , диффундирует 1.0043 раза быстрее через мембраны, в результате конечный продукт, обогащенный ураном-235 по сравнению с исходным материал. (Гексафторид урана чрезвычайно агрессивен: во время Манхэттенский проект по созданию первой атомной бомбы, тефлон использовался для сделать газонепроницаемую арматуру для клапанов и уплотнений, используемых в газодиффузии оборудования.) Обогащенный уран также может быть получен в высокоскоростная газовая центрифуга или с помощью лазера для диссоциации связей UF в UF 6 , вызывая выпадение урана-235.
Уран-238 не подвергается делению, но при бомбардировке нейтронами уран-238 поглощает нейтроны с образованием плутония-239. Поглощение нейтроны от урана-235 производят плутоний-238.
Уран-233 (период полураспада 159 000 лет) может быть получен нейтронной бомбардировкой тория-232. Этот изотоп урана также подвергается ядерному делению и имеет потенциал для использования в термоядерных установках. Поскольку тория больше, чем урана, это может быть некоторые надежды появятся в последующих поколениях атомных электростанций.
Обедненный уран состоит из урана, взятого из отработавших топливных стержней и легированные с небольшим процентным содержанием других элементов. Он содержит в основном U-238 и менее 0,7% U-235. — обычно от 0,2 до 0,4%. это чрезвычайно плотный, используется для изготовления бронебойных и балластных боеприпасов. для кораблей и самолетов.
Урановое стекло — это стекло желтого или желто-зеленого цвета, окрашенное оксид урана. В ультрафиолетовом свете урановое стекло флуоресцирует. с ярко-зеленым окрасом.Включая другие минералы, непрозрачный, желтый или белый керамика, называемая «вазелиновым стеклом» (так называемая, потому что ее внешний вид похож на вазелин). Небольшие количества урана также встречается в красных предметах в линии посуды, называемой Fiestaware; так называемая окраска «Красная Фиеста» содержит оксид урана в глазурь, которая дает яркий красновато-оранжевый цвет (см. вот для примера).
Уран, попадая в организм, концентрируется в костях, потому что уран образует комплексы с фосфат-ионами.
Нептуний (Np, Z = 93)
Нептуний — это искусственно созданный радиоактивный элемент серебра. Он назван в честь планеты Нептун, поскольку Нептун следует за Ураном в Солнечная система. Он содержится в урановых рудах при очень низких концентрации, но коммерческий источник нептуния — отработанный урановые твэлы ядерных реакторов.
Двумя наиболее долгоживущими изотопами нептуния являются нептуний-237, который имеет период полураспада 2140 000 лет, а нептуний-236 с периодом полураспада 155000 лет. Все остальные изотопы имеют период полураспада в этом диапазоне от нескольких минут до чуть более года.
Нептуний — первый из трансурановых элементов , которые имеют более высокие атомные номера, чем уран. За очень немногими исключениями трансурановые элементы слишком редки и слишком опасны, чтобы их можно было найти коммерческое использование.
Нептуний был впервые получен в 1940 году Эдвином Макмилланом и Филипом Х. Абельсона из Калифорнийского университета в Беркли, Калифорния, автор: бомбардировка урана-238 нейтронами с образованием урана-239, который подвергся бета-распаду с образованием нептуния-239. Уран-235 может также преобразоваться в нептуний при бомбардировке нейтронами, поглотив два нейтрона для производства урана-237, который затем подвергается бета-распаду с образованием нептуний-237.Уран-238 также может поглотить один нейтрон, испустить два. нейтронов и превращается в уран-237, который затем подвергается бета-распаду до производят нептуний-237.
Плутоний (Pu, Z = 94)
Плутоний — это искусственно созданный радиоактивный элемент серебра. Он назван в честь планеты (ну, бывшей планеты) Плутона, поскольку Плутон следует за Нептун (обычно) в солнечной системе. Его первооткрыватель Гленн Т.Сиборг частично выбрал символ «Pu» для элемента, а не «Pl». чтобы избежать путаницы с платиной, Pt, но также «шутливо», — говорит он: «привлечь внимание» — П.У. старый жаргон для гнилостного, что-то, что вызывает вонь ». * В небольших количествах встречается в урановых рудах, получаемых из изотопы урана-238, которые захватывают нейтроны, испускаемые ураном-235; это один из десяти элементов с наименьшим содержанием на Земле.
Плутоний был впервые синтезирован Гленном Т.Сиборг, Артур К. Валь, и Джозеф В. Кеннеди из Калифорнийского университета в Беркли, Калифорния в 1940 году, хотя о его существовании не сообщалось до тех пор, пока 1946 г. из-за ограничений безопасности, связанных с ядерными исследованиями и Манхэттенский проект по созданию первых атомных бомб. Уран-238 бомбардировали нейтронами, чтобы получить уран-239, который затем подвергся бета-распад с образованием нептуния-239, который также подвергся бета-распаду до производят плутоний-239.
Самым долгоживущим изотопом плутония является плутоний-244, имеющий период полураспада 82 000 000 лет; плутоний-242 и -239 также имеют достаточно длительный период полураспада, составляющий 380 000 лет и 24 000 лет. Чаще всего используемые изотопы: плутоний-238 (период полураспада 87,7 года) и плутоний-239.
Плутоний-238 не расщепляется и испускает альфа-частицы без испускает гамма-лучи, что делает его более безопасным в обращении.это используется в основном в качестве источника энергии с длительным сроком службы в кардиостимуляторах, космических кораблях и спутники и костюмы для глубоководных водолазов.
Плутоний-239 расщепляется и используется в атомном оружии. Критическая масса плутония-239 составляет около 16 кг, но это может быть восстанавливается путем окружения плутония оболочкой из бериллия, которая отражает нейтроны обратно к плутонию, ускоряя синтез процесс. Один килограмм плутония-239 имеет взрывной эквивалент 20000 тонн тротила.
Плутоний-240 (период полураспада 6500 лет) является загрязняющим веществом в оружейный плутоний; поскольку этот изотоп испускает нейтроны, когда он подвергается самопроизвольному делению, плутоний нельзя использовать в пушечном устройство как уран-235 может (см. запись для урана), потому что устройство будет взорван до того, как критическая масса плутония-239 сможет пройти много деления. Это требует, чтобы оружие на основе плутония использовало больше сложный дизайн имплозии.
Плутоний был компонентом первой взорванной атомной бомбы, Испытательный полигон Тринити недалеко от Аламагордо, Нью-Мексико, 16 июля 1945 года. В этом устройстве оболочка из плутония была взорвана обычным взрывчатые вещества, которые сжимали плутоний вместе, чтобы сформировать критический масса; взрыв был инициирован ливнем нейтронов, испущенных источник полония. Была сброшена первая атомная бомба, использованная в войне в Хиросиме, Япония, 6 августа 1945 года, но здесь использовался только уран. Атомная бомба «Толстяк», взорванная в августе в Нагасаки, Япония. 9 января 1945 г. была также плутониевая бомба, обладающая разрушительным потенциалом около 21000 тонн тротила и погибло более 70 000 человек.
Плутониевые бомбы также используются для инициирования взрыва водорода. бомбы, которые работают на ядерном синтезе вместо деления (см. запись для водорода на странице Группы 1А).
Америций (Am, Z = 95)
Америций — серебристый синтетический радиоактивный металл, производимый нейтронная бомбардировка плутония.Впервые это сделал Гленн Т. Сиборга, Ральфа А. Джеймса, Леона О. Моргана и Альберта Гиорсо в Чикагском университете в 1944 году. назван в честь американского континента из-за его химического сходства с европий (элемент непосредственно над ним в ряду лантанидов), который назван в честь Европы. Самый долгоживущий изотоп, америций-243, имеет период полураспада 7370 лет; америций-241 имеет период полураспада 432 годы.
Америций-241 используется в газе и детекторы дыма в виде микрограмм оксида америция, АМО 2 .Альфа-частицы, испускаемые изотопом ионизирует воздух в пространстве между электродами в детекторе, заставляя электрический ток течь между электродами. Когда дым попадает в извещатель, ток прерывается или уменьшается потому что ионы поглощаются частицами дыма, вызывая будильник звучит. Альфа-частицы, испускаемые америцием, делают не представляют опасности для здоровья, так как легко блокируются металлом и пластик в корпусе детектора, и собирать электроны, чтобы стать безвредные атомы гелия.
Кюрий (Cm, Z = 96)
Кюрий — серебристый синтетический радиоактивный металл, производимый бомбардировка плутония-239 альфа-частицами. Это было впервые сделано Гленн Т. Сиборг, Ральф А. Джеймс и Альберт Гиорсо из Калифорнийского университета в Беркли в 1944 году. Он был назван в честь Мари и Пьера Кюри, соавторов радиоактивности. Самый долгоживущий изотоп, кюрий-247, имеет период полураспада 16000000 годы.
Берклий (Bk, Z = 97)
Берклий — серебристый синтетический радиоактивный металл, производимый бомбардировка америция-241 альфа-частицами. Впервые это сделали Стэнли Г. Томпсон, Альберт Гиорсо и Гленн Т. Сиборга в Калифорнийском университете в Беркли в 1949 году. назван в честь Беркли, Калифорния, где он был впервые произведен. Самый долгоживущий изотоп, берклий-247, имеет период полураспада 1400 лет.
Калифорний (Cf, Z = 98)
Калифорний — синтетический радиоактивный металл, получаемый путем бомбардировки. кюрий-242 с альфа-частицами. Впервые это сделал Стэнли Г. Томпсон, Кеннет-стрит-младший, Альберт Гиорсо и Гленн Т. Сиборг в Калифорнийский университет в Беркли в 1950 году. Он был назван в честь Университета Калифорнии (и штата). В Самый долгоживущий изотоп, калифорний-251, имеет период полураспада 898 лет.
Калифорний является мощным излучателем нейтронов и используется как нейтрон источник в датчиках влажности, датчиках на нефтяных скважинах и нейтронной активации анализ для измерения следовых количеств элементов. Он также используется при лечении некоторых видов рака шейки матки.
Эйнштейний (Es, Z = 99)
Эйнштейний — синтетический радиоактивный металл, получаемый путем бомбардировки. плутоний-239 с нейтронами в течение нескольких месяцев; сложная серия чередование процессов распада и захвата в конечном итоге приводит к эйнштейний-253.Впервые он был выделен в остатке Испытание водородной бомбы «Майк» на острове Элугелаб атолла Эниветак Маршалловы острова 1 ноября 1952 г .; около 200 атомов einsteinium были обнаружены в тоннах радиоактивных обломков, которые были обрабатывается в Калифорнийском университете и Лос-Аламосском национальном Лаборатория Грегори Р. Чоппина, Стэнли Г. Томпсона, Альберта Гиорсо, и Бернард Г. Харви. Об открытии публично не сообщалось до 1955 года из-за ограничений безопасности, связанных с испытанием бомбы. Он был назван в честь Альберта Эйнштейна. Самый долгоживущий изотоп эйнштейний-252 имеет период полураспада 472 дня.
Фермий (Fm, Z = 100)
Фермий — синтетический радиоактивный металл, получаемый путем бомбардировки. плутоний-239 с нейтронами в течение нескольких месяцев; сложная серия чередование процессов распада и захвата в конечном итоге приводит к фермий-253. Впервые он был выделен в остатке «Майка». испытание водородной бомбы на острове Элугелаб атолла Эниветак Маршалловы острова 1 ноября 1952 г .; около 200 атомов фермия были идентифицированы в тоннах радиоактивного мусора, которые были переработаны на Калифорнийский университет и Национальная лаборатория Лос-Аламоса. Грегори Р.Чоппин, Стэнли Г. Томпсон, Альберт Гиорсо и Бернард Г. Харви. Об открытии не сообщалось публично до 1955 года. из-за ограничений безопасности, связанных с испытанием бомбы. Это было назван в честь Энрико Ферми. Самый долгоживущий изотоп, фермий-257, имеет период полураспада 100 дней.
Фермий трудно производить, и его производили только с плотностью менее пикограмма. количества, потому что фермий-257 легко поглощает нейтроны, а когда синтезируется фермий, образуя фермий-258, который имеет период полураспада 0.37 миллисекунд.
Менделевий (Md, Z = 101)
Менделевий — синтетический радиоактивный металл, получаемый путем бомбардировки. эйнштейний-253 с альфа-частицами. Впервые он был сделан Альбертом. Гиорсо, Бернар Дж. Харви, Греогори Р. Шопен, Стэнли Г. Томпсон и Гленн Т. Сиборг в Калифорнийском университете в Беркли в 1955 году. Он был назван в честь Дмитрия Менделева, создателя периодического издания. таблица элементов.Самый долгоживущий изотоп, менделевий-258, имеет период полураспада 51,5 дней.
Нобелий (№, Z = 102)
Нобелий — синтетический радиоактивный металл, получаемый путем бомбардировки. калифорний-249 с ионами углерода-12. Впервые это было сделано Альберт Гиорсо, Торбьорн Сиккеланд, Джон Р. Уолтон и Гленн Т. Сиборга в 1958 году. Он был назван в честь Альфреда Нобеля, изобретатель динамита и основатель Нобелевской премии.В Самый долгоживущий изотоп, нобелий-259, имеет период полураспада 58 минут.
Лоуренсий (Lr, Z = 103)
Лоуренсий — синтетический радиоактивный металл, получаемый путем бомбардировки. калифорний-252 с ионами бора-10. Впервые это сделал Альберт Гиорсо, Торбьорн Сиккеланд, Алмон Ларш и Роберт М. Латимер в 1961 году. был назван в честь Эрнеста О. Лоуренса, изобретателя циклотрона. первых ускорителей частиц.Самый долгоживущий изотоп, лоуренсий-262, имеет период полураспада 216 минут.
Список литературы
Джон Эмсли, Элементы , 3-е издание. Оксфорд: Clarendon Press, 1998.
Джон Эмсли, Природные строительные блоки: Руководство по элементам Z-Z . Оксфорд: Оксфордский университет Пресс, 2001.
Дэвид Л. Хейзерман, Исследование Химические элементы и их соединения .Нью-Йорк: TAB Книги, 1992.
* Ричард Родс, Создание атомной бомбы. Нью-Йорк: Саймон и Шустер, 1986, с. 414.
Радиоактивность
Если вы посмотрите на таблицу Менделеева, вы заметите, что все элементы после висмута с атомным номером 83 имеют атомную массу, обозначенную целым числом в скобках. Такие большие ядра нестабильны и претерпевают радиоактивность , самопроизвольный распад за счет испускания частиц.Этот процесс также известен как радиоактивный распад. Атомная масса, указанная в периодической таблице, является массовым числом наиболее распространенного изотопа каждого радиоактивного элемента.
Для химических целей наиболее важными видами излучения являются альфа- и бета-частицы. альфа-частица (α) — это ядро с 2 протонами и 2 нейтронами. В этой ядерной записи используется нижний левый индекс для записи количества протонов, а верхний левый индекс — это массовое число , , общее количество нуклонов.Число протонов определяет химический элемент, тогда как общее количество нуклонов — это массовое число для частицы или изотопа.
Если нестабильное ядро испускает альфа-частицу, его атомный номер уменьшается на 2, а его массовое число уменьшается на 4. Примером может служить распад тория-232:
Обратите внимание, что при радиоактивном распаде один химический элемент фактически превращается в другой, этот процесс называется трансмутацией . Также обратите внимание, что сумма массовых чисел на каждой стороне одинакова, что означает, что они сохранены.Это также верно для общего заряда с каждой стороны.
Другой химически важный способ радиоактивной трансмутации обеспечивается отрицательными бета-частицами (β), которые являются электронами, испускаемыми атомными ядрами, а не окружающими электронными орбиталями. Бета-частица может быть обозначена как электрон (e — ) или греческой буквой бета (). Бета-частица возникает в результате распада нейтрона на протон:
Создание протона приводит к увеличению атомного номера на единицу.Примером бета-трансмутации является распад свинца-212:
.Атомный номер увеличился до 83 из-за нового протона, но массовое число осталось постоянным, потому что оба ядра металла содержат 212 протонов плюс нейтроны.
Самый известный радиоактивный элемент — уран, который имеет два встречающихся в природе изотопа с массовыми числами 235 и 238, которые распадаются очень медленно. Просмотрите первые несколько этапов распада урана-238, который превращается в свинец-206 после выброса восьми альфа- и шести бета-частиц.Самые ранние стадии схемы распада включают только три элемента, как показано на рисунке 1.
Рисунок 1. Три радиоактивных элемента.
Вам следует внимательно изучить изменения как атомного номера (протоны), так и массового числа (протоны плюс нейтроны):
В этой краткой последовательности есть два разных изотопа урана и два изотопа тория.
- Следующим шагом в схеме распада урана-238 является выброс альфа-частицы из тория-230.Опишите массовое число, атомный номер и название элемента для полученного ядра.
Радиоактивный элемент — обзор
V.F Утилизация радиоактивных отходов
Химические отходы, содержащие радиоактивные элементы, представляют собой особенно сложные проблемы захоронения. Трудности частично технические, а частично политические: радиоактивные составляющие, которые попадают в грунтовые и поверхностные воды, должны сохраняться в чрезвычайно малых количествах в течение очень долгого времени, а страх перед таинственными эффектами радиации заставляет политиков неохотно рассматривать вопрос об утилизации радиоактивных отходов. на территории их составляющих.
Радиоактивные элементы широко распространены в материалах земной коры и в небольших количествах входят в состав живых тканей всех растений и животных. Радиоактивные атомы производятся в воздухе космическими лучами, которым постоянно подвергается окружающая среда. Дополнительное радиационное облучение большей части населения происходит в результате обычного использования рентгеновских лучей в медицинской диагностике и терапии. Таким образом, радиация — это просто часть нашей окружающей среды, и ее нельзя считать вредной сама по себе.Даже в тех регионах Земли, где радиоактивных минералов больше, чем обычно, а уровень радиации несколько выше, чем в среднем в мире, не было продемонстрировано никакого вреда для жителей. Тревожная особенность радиоактивных отходов заключается не в том, что они генерируют радиацию, а в том, что , количество радиации настолько велико. Известно, что такое концентрированное излучение губительно для живых организмов. Более того, ущерб от радиации, по крайней мере частично, является кумулятивным, так что повторное воздействие малых доз может привести к болезни много лет спустя.Неизвестно, какое именно количество радиации можно переносить без долгосрочных последствий, но при отсутствии этих знаний, очевидно, желательно, чтобы радиоактивные отходы были максимально эффективно изолированы от окружающей среды, в которой мы живем.
Радиоактивный материал в отходах обычно включает в себя множество элементов, некоторые из которых быстро распадаются до нерадиоактивных дочерей и, таким образом, становятся безвредными, а другие остаются опасно радиоактивными в течение длительного времени, вплоть до многих сотен тысяч лет.Проблема изоляции сложна главным образом из-за этих долгоживущих элементов: конечно, можно воздвигнуть барьеры, чтобы не допустить попадания радиоактивных элементов в окружающую среду в течение десятилетий или столетий, но нельзя полагаться, что ни одна искусственная конструкция выдержит 10 000 или 100 000 человек. г. В конечном итоге, что бы ни было сделано для удаления отходов, существует возможность разрушения искусственных барьеров и воздействия на отходы естественных агентов окружающей среды, особенно грунтовых вод, поскольку планы по удалению обычно предусматривают размещение значительно ниже поверхности земли.Таким образом, геохимическая проблема захоронения радиоактивных отходов заключается в том, чтобы определить местонахождение мест, где подземные воды движутся так медленно, где их состав не вызывает коррозии и где прилегающая порода содержит такое количество сорбирующего материала, что не более чем незначительные количества радиоактивного материала будут растворяются в грунтовых водах и переносятся ими в поверхностные среды даже в течение очень долгого времени. Поиску таких мест было посвящено много исследований, и было найдено несколько вероятных кандидатов, но всегда остается некоторая небольшая неопределенность относительно того, насколько точно можно предсказать поведение горных пород и грунтовых вод на 100 000 лет в будущем.
Произошло множество видов радиоактивных отходов, от таких материалов с низким уровнем активности, как слегка загрязненное лабораторное оборудование и одежда, до сильно радиоактивных топливных стержней ядерных реакторов, которые были удалены после многих месяцев нейтронной бомбардировки содержащегося в них урана. Различные типы требуют разных методов утилизации. Отходы с низким уровнем активности, особенно если большинство их радиоактивных материалов представляют собой элементы с коротким периодом полураспада, можно безопасно захоронить в неглубоких крытых траншеях у поверхности.Однако высокоактивные отходы требуют захоронения на глубине нескольких сотен метров под землей. Различные методы захоронения призваны гарантировать, что радиация, достигающая окружающей среды из любого хранилища отходов, будет не больше, чем радиация от рудных залежей радиоактивных элементов, другими словами, не больше, чем люди подвергались воздействию на протяжении многих тысячелетий.
Вырабатывая ядерную энергию за счет деления атомов урана, а затем закапывая образующиеся радиоактивные отходы, люди будут сложным образом изменять окружающую среду.С геологической точки зрения изменение незначительное, но необратимое: добыча урана и его бомбардировка нейтронами в реакторах удаляют с Земли часть урана, которым изначально была наделена наша планета. Это означает, что в далеком будущем, после того, как все вновь образованные радиоактивные элементы распадутся, общее количество радиации, которому подвергаются живые организмы, будет уменьшено. В ближайшем будущем некоторые части окружающей среды могут подвергнуться временному значительному воздействию, если отходы, содержащие новые элементы, не будут утилизированы должным образом.Но если земная поверхность будет защищена в течение десятков тысяч лет за счет размещения отходов глубоко под землей, общее изменение поверхностной среды будет незаметным.
Радиоактивность — Energy Education
Рис. 1. Диаграмма, показывающая кулоновскую силу отталкивания внутри ядра вместе с сильной силой притяжения. Дополнительно показаны три формы радиоактивного распада. [1]Радиоактивность — это физическое явление, при котором определенные элементы, такие как уран, выделяют энергию в виде излучения.Эта энергия возникает в результате распада нестабильного ядра. [2] Любые виды ядер (определенная конфигурация протонов, нейтронов и энергии), которые проявляют радиоактивность, известны как радиоактивные ядра . Кроме того, радиоактивность или просто активность можно использовать как измерение, чтобы описать, сколько распадов проходит радиоактивный атом за период времени. [3] Эти распады приводят к выбросу энергии и частиц из ядра. Радиоактивность также можно обозначать как радиоактивный распад или ядерный распад .
Наиболее распространенные формы излучения включают альфа, бета и гамма-излучение, но существуют и другие типы радиоактивного распада, такие как испускание протонов или нейтронов, или спонтанное деление больших ядер. [4]
Радиоактивность имеет множество различных применений в медицине и промышленности. Радиоактивность используется даже в дымовых пожарных извещателях (подробнее см. Здесь). Кроме того, эти радиоактивные элементы действуют как топливо на атомных электростанциях для выработки электроэнергии. Кроме того, излучение этих элементов можно использовать для облучения пищевых продуктов и предотвращения их порчи.Чтобы узнать больше об использовании радиоактивности элементов, см. Изотопы для общества.
Что вызывает радиоактивность?
Стабильность ядерной разновидности (также называемой нуклидом) определяется силами внутри ядра. Эти силы определяют его ядерную устойчивость. Нестабильные ядерные изотопы испускают излучение в результате конфликта силы кулоновской силы отталкивания между протонами в ядре и сильной ядерной силы притяжения между нуклонами. [1] Если кулоновская сила и сильная ядерная сила не уравновешиваются, рассматриваемый нуклид находится за пределами пояса стабильности и является радиоактивным.Число, известное как отношение нейтронов к протонам или отношение N / Z , можно использовать, чтобы быстро увидеть, остаются ли кулоновские силы и сильные ядерные взаимодействия достаточно сбалансированными или несбалансированными. [5] Для более мелких элементов в верхней части таблицы Менделеева соотношение стабильности составляет почти 1: 1. По мере увеличения ядер отношение N / Z немного увеличивается для стабильности. [5] Если в ядре слишком много протонов или нейтронов, оно, скорее всего, подвергнется какой-то трансмутации, чтобы достичь более стабильного состояния (где оно превращается в какой-то новый нуклид с «лучшим» отношением N / Z). [5]
Существует множество сложных факторов, которые определяют, является ли нуклид радиоактивным. Например, если нуклид имеет нечетное количество протонов или нечетное количество нейтронов, он с большей вероятностью будет радиоактивным. Если оба нечетные, нуклид почти наверняка радиоактивен! Эта большая нестабильность возникает из-за стремления протонов и нейтронов «образовывать пары» с частицами того же типа, повышая стабильность. [5] (Из тысяч исследованных нуклидов найдено только 4 стабильных нечетно-нечетных ядра.) Некоторое количество протонов или нейтронов в ядре, которое способствует стабильности. Эти числа известны как магические числа.
Большинство крупных нуклидов имеют тенденцию быть радиоактивными, и последний полностью стабильный нуклид — висмут (который имеет 83 протона). Эти большие радиоактивные элементы часто подвергаются альфа-распаду, так как это быстро снижает количество протонов и нейтронов в ядре. [5] Большинство нуклидов, встречающихся в природе, не радиоактивны, потому что все короткоживущие радиоактивные ядра уже распались, оставив подавляющее большинство стабильных ядер.Есть только 50 естественных нуклидов, которые проявляют радиоактивность, в то время как существует около 270 стабильных нуклидов. [4] Тысячи короткоживущих нуклидов созданы в лабораториях и на ускорителях частиц.
Для дальнейшего изучения этой темы посетите Интерактивную карту нуклидов Energy Education.
Измерение радиоактивности
Радиоактивность также можно использовать для описания того, сколько ионизирующего излучения испускается радиоактивным материалом. [3] Единицей измерения радиоактивности в системе СИ является беккерель (Бк), равный одному распаду в секунду.Кюри (Ки) была исходной единицей измерения радиоактивности и равнялась 3,7 × 10 10 Бк. [2] Счетчики Гейгера могут использоваться для измерения радиоактивности вещества, и эти устройства широко известны тем, что издают «щелкающий» шум, когда они обнаруживают распад, вызывающий ионизирующее излучение.
Другой способ измерить, насколько что-то радиоактивно, — это исследовать период его полураспада, поскольку период полураспада нуклида связан с его радиационным риском.
Безопасность
Одно из распространенных заблуждений о радиоактивности состоит в том, что любой радиоактивный объект вреден для здоровья человека.Однако это не так, поскольку не было доказано, что малые дозы радиации вредны для человека. Фактически, есть много радиоактивных продуктов, которые можно купить и которые не представляют угрозы для здоровья человека. Бананы, детекторы дыма, керамическая посуда, наполнитель для кошачьих туалетов, пиво и бразильские орехи — все радиоактивно. [6]
Однако в больших дозах радиация действительно оказывает негативное воздействие на здоровье. Когда радиоактивные материалы распадаются, они производят ионизирующего излучения . Проще говоря, этот тип излучения может оторвать электроны от атомов или разорвать химические связи (чтобы образовались ионы).Это вызывает повреждение живых тканей, которое не всегда можно восстановить. [7] Хроническое воздействие радиации может привести к раку (в результате повреждения на клеточном или молекулярном уровне) или другим мутациям, которые могут быть вредными для плода. Последствия острого воздействия радиации проявляются быстро и включают ожоги и радиационное отравление. Симптомы радиационного отравления включают тошноту, слабость, выпадение волос и снижение функции органов, и эта лучевая болезнь может привести к смерти, если доза будет достаточно высокой. [4]
Кроме того, некоторое излучение вредно только при определенных обстоятельствах. Например, детекторы дыма обычно содержат источник альфа-частиц, известный как америций (который является радиоактивным). Америций используется для обнаружения дыма. В самом дымовом извещателе этот источник радиоактивен, но не вреден. Однако из-за природы альфа-частиц америций очень опасен при проглатывании. Детекторы дыма ежегодно спасают множество жизней, поэтому рекомендуется менять батареи раз в год.Однако вскрытие дымовых извещателей может быть опасным.
Для дальнейшего чтения
Список литературы
- ↑ 1.0 1.1 Гиперфизика. (7 июля 2015 г.). Радиоактивность [Онлайн]. Доступно: http://hyperphysics.phy-astr.gsu.edu/hbase/nuclear/radact.html#c1
- ↑ 2,0 2,1 Глоссарий NRC. (8 июля 2015 г.). Радиоактивность [Онлайн]. Доступно: http://www.nrc.gov/reading-rm/basic-ref/glossary/radioactivity.html
- ↑ 3,0 3,1 NRC. (8 июля 2015 г.). Измерение радиации [Онлайн]. Доступно: http://www.nrc.gov/about-nrc/radiation/health-effects/measuring-radiation.html
- ↑ 4,0 4,1 4,2 Агентство по охране окружающей среды США, лаборатория Беркли. (7 июля 2015 г.). Радиоактивность [Онлайн]. Доступно: http://www2.lbl.gov/abc/wallchart/chapters/03/0.html
- ↑ 5,0 5,1 5,2 5,3 5.4 Джефф К. Брайан. Введение в ядерную науку, 1-е изд. Бока-Ратон, Флорида, США: CRC Press, 2009.
- ↑ Энн Мари Хелменстин. (7 июля 2015 г.). 10 радиоактивных предметов повседневного обихода [Онлайн]. Доступно: http://chemistry.about.com/od/nucleardecay/ss/10-Radioactive-Products-Everyday-Items-That-Emit-Radiation.htm#showall
- ↑ Агентство по охране окружающей среды США. (8 июля 2015 г.). Воздействие на здоровье: радиация [Интернет]. Доступно: http://www.epa.gov/radiation/understand/health_effects.html # q1
Радий — Информация об элементе, свойства и использование
Расшифровка:
Химия в ее элементе: радий
(Promo)
Вы слушаете Химию в ее элементе, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Здравствуйте, на этой неделе самосветящаяся история элемента номер 88. Вот Брайан Клегг.
Брайан Клегг
В Radium есть что-то восхитительно викторианское. Дело не только в том, что этот радиоактивный элемент был обнаружен в конце викторианской эпохи в 1898 году. Есть еще что-то в его раннем использовании в качестве универсального восстанавливающего средства, имеющего особую атмосферу того времени.Его считали источником энергии и яркости, его включали в зубные пасты и шарлатанские зелья — его даже втирали в кожу головы как средство для восстановления волос.
Но применение радия, которое принесло ему известность, заключалось в его использовании в светящейся в темноте краске. Жуткое синее свечение радия, часто используемое для обеспечения световых индикаторов на часах, переключателях самолетов и циферблатах приборов, считалось безвредным и практичным источником ночного освещения. И только когда несколько рабочих, которые красили светящиеся циферблаты, начали страдать от язв, анемии и рака вокруг рта, стало ясно, что что-то не так.Работницы регулярно доводили свои кисти до точки, облизывая их. Это оставило достаточно радиоактивного остатка во рту, чтобы вызвать повреждение клеток. В конце концов более 100 рабочих умрут от последствий.
Более известной жертвой радия стала его открывшая, дважды лауреат Нобелевской премии Мария Кюри, урожденная Мария Склодовская. Вместе со своим мужем Пьером Мария Кюри изучала уран, минерал из Северной Богемии, содержащий уран. Пичбленда была добыта недалеко от того места, где сейчас находится Яхимов, в Чешской Республике, и после того, как уран был извлечен для использования для окраски керамической глазури и тонирования фотографий, остаточный шлак был сброшен в близлежащий лес.Без урана настуран оказался радиоактивным — фактически, каким бы ни был другой радиоактивный материал, он был гораздо более радиоактивным, чем сам уран.
Мария Кюри написала сестре Бронии, что «излучение, которое я не могу объяснить, исходит от нового химического элемента. Элемент есть, и я должен его найти! Мы уверены!’ Проработав тонны уранового шлака, Кюри определили в оставшемся материале два новых элемента — полоний и радий.Наконец, в 1902 году они выделили радий в его чистой металлической форме. Радий был назван от латинского слова «луч» и оказался самым радиоактивным природным веществом из когда-либо обнаруженных.
Хотя Мария Кюри жила до 1934 года, ее смерть от апластической анемии почти наверняка связана с воздействием радиоактивных материалов, в частности радия. По сей день ее записные книжки и бумаги приходится хранить в ящиках с свинцовым покрытием и носить защитную одежду, так как они остаются радиоактивными.
Радий образуется в естественных условиях при распаде урана, хотя и в очень небольших количествах.Потребовалось много тонн урана, чтобы произвести десятую долю грамма радия, который в конечном итоге извлекли Кюри. Он классифицируется в периодической таблице как щелочноземельный металл — самый тяжелый из ряда — наряду с более привычными металлами, такими как магний и кальций. С атомным номером 88 он имеет четыре природных изотопа с атомным весом 228, 226, 224 и 223, хотя есть еще 21 замечательный искусственный изотоп.
Позднее радий сыграет главную роль в качестве источника альфа-частиц — ядер гелия — используемых Резерфордом в 1909 году в лаборатории Кавендиша в Кембридже для стрельбы по тонкой золотой фольге.Радий распадается на радон, выбрасывая альфа-частицу из своего ядра. Неожиданно помощники Резерфорда Ханс Гейгер и Эрнест Марсден обнаружили, что очень немногие из альфа-частиц отскочили назад — Резерфорд сравнил это с «выстрелом 15-дюймовым снарядом по куску папиросной бумаги, после чего он вернулся и поразил вас». Это поведение использовалось для вывода о существовании компактного плотного ядра в атоме — радий оказался ключом к раскрытию структуры атома.
Основное практическое применение радия — в медицине, в производстве газообразного радона из хлорида радия для использования в лучевой терапии рака.Этот процесс начался еще во времена Марии Кюри. Первые исследователи обнаружили, что они получили ожоги кожи при обращении с радиоактивными материалами, а когда Кюри работали с врачами, они обнаружили, что радиацию можно использовать для уменьшения или даже лечения опухолей. Это стало известно как терапия Кюри, и Сорбонна в Париже открыла лабораторию частично для Кюри, чтобы продолжить ее исследования, а частично для изучения медицинских применений излучения, которая впоследствии стала известна как Радиевый институт.
Если бы вы держали в руке кусок радия, он был бы теплым.Первоначально он был ярко-белым, но при взаимодействии с воздухом он становился черным с образованием нитрида радия. Он останется твердым — радий не плавится до температуры около 700 градусов по Цельсию. Он также будет трескать и плевать на поверхности вашей ладони, когда реагирует с водой на вашей коже с образованием гидроксида радия. Однако держать радий я бы не рекомендовал. Радий постоянно распадается, производя альфа-частицы, используемые Резерфордом, бета-частицы, которые представляют собой быстрые электроны, и гамма-лучи, такие как рентгеновские лучи высокой энергии, которые будут проходить сквозь вашу плоть, разрушая ДНК и вызывая повреждение клеток.Изотопы радия различаются по периоду полураспада — времени, за которое задерживается половина молекул в образце — от 1602 лет для наиболее стабильного изотопа радия 226 до 11½ дней для радия 223.
Это элемент, который необходимо изменить. обращаться с осторожностью. Тем не менее, для любого, кто вырос на детской фантастике, полной лучевых пушек и в мире, где еще существовали рентгеновские аппараты для проверки размера вашей обуви, это вызывает ностальгическое чувство, которое когда-либо сделает его увлекательным.
Крис Смит
Интересно, будут ли подкастеры следующего века так же говорить о мобильных телефонах, микроволновых печах и МРТ-сканерах.Это был научный писатель из Бристоля Брайан Клегг с историей о радии. На следующей неделе к металлу, способному на ужасную жестокость по отношению к раку.
Кэтрин Хэкстон
В начале 1960-х Барнетт Розенберг проводил эксперименты на бактериях, измеряя влияние электрического тока на рост клеток. Бактерии E.coli были аномально длинными во время эксперимента, что не могло быть связано с электрическим током. Ряд соединений платины образовывался за счет реакции буфера и платинового электрода.Было обнаружено, что цисплатин ингибирует деление клеток, вызывая тем самым рост бактерий, и был протестирован на мышах на предмет противораковых свойств. В настоящее время цисплатин широко используется для лечения злокачественных новообразований эпителия с выдающимися результатами при лечении рака яичек.
