Виды фармацевтической деятельности в России и их классификация
Фармацевтическая деятельность в России находится под строгим контролем государства. К ней допускают только тех предпринимателей и организации, которые способны обеспечить безопасный и эффективный оборот продукции в соответствии с нормами законодательства. Строгий контроль фармацевтической деятельности объясняется просто: лекарственные препараты требуют особого обращения. В противном случае, медикаменты могут стать неэффективными и даже опасными для человека. К этому может привести даже небольшое отклонение от нормативных требований по обращению с медицинской продукцией.
Виды фармацевтической деятельности можно классифицировать по двум основным критериям:
- По конечному покупателю: оптовая и розничная.
- По направлению: производство, торговля, хранение, перевозка, отпуск продукции населению.
Хранение – это размещение и сбережение товара в таких условиях, которые обеспечивают неизменность исходных характеристик до момента реализации покупателю.
Хранение фармацевтической продукции могут осуществлять как производители товара, так и организации оптовой, розничной торговли. Правила размещения лекарственных препаратов и требования к оснащенности склада, обеспечивающие сохранность продукции, указаны в профильных нормативно-правовых актах и федеральных законах РФ.
Нормы, обеспечивающие неизменность исходных свойств фармацевтической продукции, разработаны для всех направлений деятельности. Система качества, внедренная на предприятии, должна гарантировать соблюдение условий хранения и перевозки, торговли и изготовления.
- Разработка и внедрение обязательных требований к обращению с фармацевтической продукцией.
- Стандартизация требований к характеристике лекарственных препаратов и направлениям деятельности.
- Контроль со стороны государственных надзорных структур за выполнением законодательных требований.
Производство, оптовая и розничная торговля, хранение, перевозка – это виды деятельности, подлежащие лицензированию. Оказывать услуги в данной сфере в праве предприниматели и организации, которые прошли государственную проверку. В процессе лицензирования ведомственная структура проверяет, созданы ли на предприятии необходимые условия для безопасного и эффективного обращения с лекарственными препаратами.
Виды лицензий на фармацевтическую деятельность
Виды лицензий классифицируют аналогично направлениям деятельности: оптовая или розничная торговля, хранение, отпуск населению, перевозка, изготовление. Предприниматель при заполнении заявления может выбрать одну или несколько сфер, в которых планирует оказывать услуги. Например, производство и перевозка или производство и оптовое хранение.
Предприниматель при заполнении заявления может выбрать одну или несколько сфер, в которых планирует оказывать услуги. Например, производство и перевозка или производство и оптовое хранение.
Выдачей оптовых фармацевтических лицензий занимается Росздравнадзор. Для получения разрешительного документа соискатель должен доказать, что его компания соответствует требованиям по технической оснащенности и высокой квалификации сотрудников и может обеспечить безопасное обращение с лекарственными препаратами. Именно ремонт и оборудование фармацевтического склада обычно становится камнем преткновения на пути предпринимателя, который решил пройти проверку в Росздравнадзоре самостоятельно.
Обеспечить грамотное хранение лекарственных препаратов в соответствии с требованиями – сложная задача, с которой сможет справиться далеко не каждый бизнесмен. Необходимо предусмотреть систему контроля и поддержания оптимального микроклимата для разных категорий фармацевтической продукции, эффективную вентиляцию и охранное оборудование, продумать систему размещения и маркировки для быстрого поиска позиций, обеспечить сохранность и учет наркотических, сильнодействующих, психотропных медикаментов.
Компания «КАСЛ» поможет оформить «под ключ» любые виды оптовых лицензий на фармацевтическую деятельность за 2 месяца. Если вам необходимо начать работу в самое ближайшее время, вы можете приобрести фирму, которая уже прошла проверку в Росздравнадзоре. В этом случае для переоформления документов на нового собственника потребуется всего несколько дней. Задать вопросы и узнать стоимость услуг можно у менеджера «КАСЛ» по телефону.
Статья 66. Виды фармацевтической деятельности — КиберПедия
1. Фармацевтическая деятельность включает профессиональную деятельность физических лиц, получивших высшее или среднее профессиональное фармацевтическое образование, а также юридических лиц, осуществляющих деятельность в области здравоохранения.
2. Фармацевтическая деятельность включает следующие виды:
1) производство лекарственных средств;
2) производство изделий медицинского назначения;
3) производство медицинской техники;
4) изготовление лекарственных препаратов;
5) изготовление изделий медицинского назначения;
6) оптовая реализация лекарственных средств;
7) оптовая реализация изделий медицинского назначения;
8) оптовая реализация медицинской техники;
10) розничная реализация изделий медицинского назначения;
11) розничная реализация медицинской техники.

Статья 67. Производство лекарственных средств, изделиймедицинского назначения и медицинской техники
1. Производство лекарственных средств, изделий медицинского назначения и медицинской техники — фармацевтическая деятельность, включающая совокупность всех работ, необходимых для серийного выпуска лекарственных средств, изделий медицинского назначения и медицинской техники, связанных с приобретением сырья, материалов и полуфабрикатов, технологическим процессом, в том числе с осуществлением одной из его стадий, хранением, реализацией произведенной продукции, а также всеми видами сопровождающего их контроля.
2. Производство лекарственных средств, изделий медицинского назначения и медицинской техники осуществляется в соответствии с правилами производства и нормативными документами по стандартизации субъектами в сфере обращения лекарственных средств, изделий медицинского назначения и медицинской техники, получившими лицензию на право производства лекарственных средств, изделий медицинского назначения и медицинской техники.
3. Правила производства и контроля качества, а также проведения испытаний стабильности и установления срока хранения и повторного контроля лекарственных средств, изделий медицинского назначения и медицинской техники утверждаются Правительством Республики Казахстан.
4. Запрещается производство лекарственных средств, изделий медицинского назначения и медицинской техники:
1) не прошедших государственную регистрацию в Республике Казахстан, за исключением лекарственных средств, изделий медицинского назначения и медицинской техники, предназначенных для проведения экспертизы при их государственной регистрации, при отладке и запуске оборудования и технологических процессов, а также лекарственных субстанций, произведенных в условиях Надлежащей производственной практики;
2) без лицензии на право производства лекарственных средств, изделий медицинского назначения и медицинской техники;
3) с нарушением Правил производства и контроля качества лекарственных средств, изделий медицинского назначения и медицинской техники.

5. Произведенные и ввозимые лекарственные средства:
1) не должны содержать в своем составе красители и вспомогательные вещества, перечень которых запрещен к применению в Республике Казахстан уполномоченным органом;
2) должны подлежать контролю в соответствии с нормативно-техническим документом по контролю за качеством и безопасностью лекарственных средств, разработанным согласно Правилам составления, согласования и экспертизы нормативно-технического документа по контролю за качеством и безопасностью лекарственных средств, утвержденным уполномоченным органом.
7. Производство изделий медицинского назначения и медицинской техники, предназначенных для проведения диагностики или лечения, должно обеспечивать их безопасность, предусматривать их использование в соответствии с функциональным назначением и исключать риск ошибок пользователя при интерпретации полученных результатов диагностики или лечения.

Лицензирование фармацевтической деятельности: процедура, порядок, документы
Большинство обычных людей даже не подозревают, что для открытия простой аптеки нужно получить особое разрешение. Просто так торговать лекарствами нельзя, даже если их будет продавать сотрудник с медицинским образованием. Помимо аптек есть и много других видов деятельности в области фармацевтики, требующих получения лицензии. Данная статья расскажет вам о таком понятии как подлежащие лицензированию виды фармацевтической деятельности.
Фармацевтическая деятельность и потребность в лицензировании
Кратко всю фармдеятельность можно уместить в нескольких словах. Такая деятельность подразумевает любые манипуляции с медикаментами. Чтобы производить, реализовывать, хранить и даже перевозить лекарственные препараты нужно получить лицензию.
Без получения соответствующего разрешения на работу с медицинскими средствами фармацевтическая деятельность незаконна. Наказание за это не только административная ответственность и большие штрафы.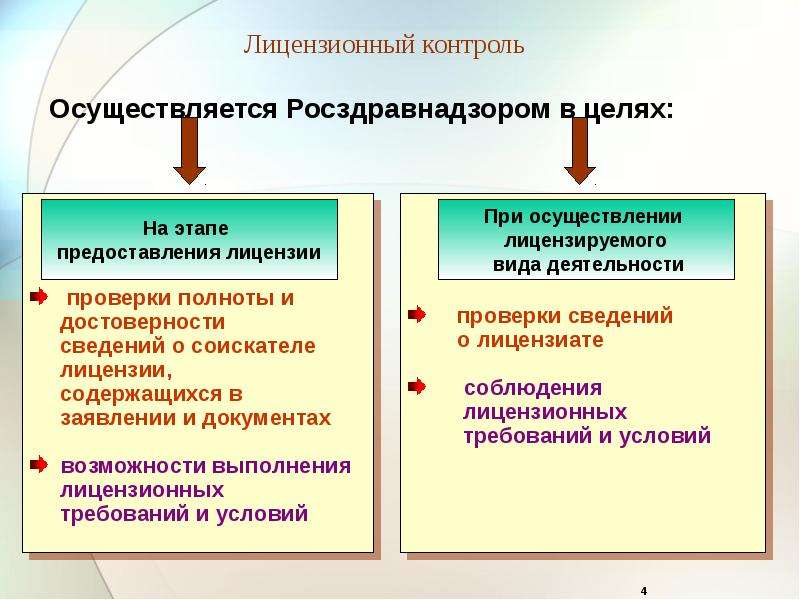
Отсутствие лицензии может грозить реальным тюремным сроком, поэтому все стремятся своевременно получать этот документ, несмотря на некие сложности процесса.
Лицензия на осуществление фармацевтической деятельности
Функции
Давайте для начала узнаем, для кого предусмотрено лицензирование фармацевтической деятельности, каковы правовые основы и его функции.
Сама по себе лицензия — это просто бумажка, указывающая на легальность работы с лекарственными средствами. В ней указаны все виды деятельности, запрашиваемые конкретной компанией, подтвердивший соответствие условий.
Если лицензия разрешает розничную торговлю медикаментами, то это совсем не обозначает, что организация вправе заниматься оптовыми поставками.
Получение лицензии выполняет несколько функций:
- Уменьшается объем фальсифицированных лекарственных препаратов
- Снижается риски нарушений перевозки и условий хранения медикаментов
- Государство способно знать точный список фармацевтический организаций для контроля.

Такие меры обязательны для предоставления медицинским учреждениям и конечным потребителям максимально возможного уровня качества лекарственных средств. Процедура получения лицензии подразумевает определение условий для ведения такой деятельности и регулируется определенными документами и законами.
Про законы, положения и иные нормативные документы для регулирования вопроса о лицензировании фармацевтической деятельности рассмотрены ниже.
Нормативное регулирование
Получение разрешение на фармдеятельность согласно ФЗ о лицензировании фармацевтической деятельности №61-ФЗ от 12.04.10 в ст.52 ч. 1 допустимо не только для юридических лиц, но и для индивидуальных предпринимателей. Также при получении лицензии необходимо руководствоваться постановлением Правительства (ПП 1181) РФ «О лицензировании фармацевтической деятельности».
Этот документ был утвержден 22.12.2011 и отредактирован 23.09.2016. Также на законодательном уровне определены списки документов, необходимых для разных видов деятельности. С ними можно ознакомиться в постановлениях Правительства РФ №882 от 04.09.12, №342 от 15.04.13, №956 от 23.09.16.
С ними можно ознакомиться в постановлениях Правительства РФ №882 от 04.09.12, №342 от 15.04.13, №956 от 23.09.16.
Про сроки и управление лицензированием медицинской и медико-фармацевтических видов деятельности поговорим ниже.
Особенности получения лицензии
Выдача разрешения на фармацевтическую деятельность возможна только при соблюдении всех необходимых условий.
- За получением лицензии следует обращаться в Федеральную службу по надзору в сфере здравоохранения.
- В редких случаях переоформления разрешения, выдачей лицензии занимаются органы исполнительной власти конкретного муниципального образования.
Сам процесс получения разрешения не очень сложный. Основные трудности вызывают обязательность соблюдения всех необходимых условий и правильный сбор требуемого пакета документов.
Про основные принципы и условия лицензирования фармацевтической деятельности читайте ниже.
Список необходимых условий
Для предоставления лицензии необходимо соблюсти ряд требований. Даже руководитель организации должен обладать фармацевтическим образованием. Это же касается и индивидуальных предпринимателей. Для ведения работы в ветеринарными средствами также необходимо соответствующие образование.
Даже руководитель организации должен обладать фармацевтическим образованием. Это же касается и индивидуальных предпринимателей. Для ведения работы в ветеринарными средствами также необходимо соответствующие образование.
Помимо этого необходимо соблюсти следующие условия:
- Иметь помещение в аренде или собственности
- При перевозках лекарств иметь собственных автопарк
- Заключить трудовые договора с сотрудниками, имеющими необходимое образование и стаж
- Помещения или транспортные средства должны быть оборудованы в соответствии с условиями хранения препаратов.
Если за лицензией на ведение фармацевтической деятельности обращается медучреждение или организация, то они уже должны иметь 1 разрешение. Речь идет о лицензии на медицинскую деятельность, сама по себе она не дает права транспортировать или реализовывать лекарственные препараты.
Лицензирование фармацевтической деятельности проводят при наличии определенных документов и сведений, о чем мы и поговорим ниже.
Форма заявления и требуемые документы
Для подачи заявления необходимо его правильная форма заполнения. Образец представлен в реестре лицензий на осуществление фармдеятельности. Неправильно заполненное заявление является поводом для возврата соискателю всего пакета документов.
К заявлению прикладываются такие данные:
- Квиток об оплате госпошлины.
- Заключение СЭС о пригодности помещения.
- Заверенные копии учредительных документов.
- Документы, подтверждающие квалификацию и стаж руководителя.
- Копии договоров аренды или свидетельств о собственности на помещение.
- Копии сертификатов, дипломов и свидетельств об образовании сотрудников.
- Трудовые договора с сотрудниками, имеющими соответствующее образование.
Если соискателем лицензии является медицинская организация, то к пакету документов добавляется копия их разрешения на работу. Все эти документы нужны как при первичном получении лицензии, так и при ее переоформлении.
Далее рассмотрен порядок лицензирования фармацевтической деятельности и субъект, который осуществляет его.
В этом видео дана инструкция по лицензированию фармацевтической деятельности:
Этапы оформления
Процесс выдачи лицензии довольно длительный, уже после подачи заявления требуется 45 дней на рассмотрение. До этого момента необходимо еще предварительно проверить соответствие условиям и собрать требуемые документы. Детально получение лицензии выглядит так:
- Изучение условий и их корректировка
- Обращение в СЭС за справкой
- Сбор пакета документов и оплата госпошлины
- Заполнение заявления и его подача.
После этого соответствующие органы проводят экспертную проверку документов. При их правильном сборе, заявление считается принятым в рассмотрение. Далее проводится анализ соответствия помещения или транспорта необходимым условиям и после этого выдается лицензия.
При наличии неправильных документов или частичном несоответствии какому-либо условию, госорганы отказывают в получении разрешения, но выдают список предписаний, подлежащих исправлению. После выполнения необходимых указаний соискатель вправе обратиться за получением лицензии повторно.
Полезная информация
Согласно законодательству, лицензия на ведение фармацевтической деятельности выдается бессрочно. В то же время существует ряд причин, требующий повторно получить разрешение. Среди них есть очень незначительные изменения, но именно они и вынуждают вновь обращаться за выдачей лицензии.
Причины переоформления:
Получение и своевременно переоформление лицензии на фармацевтическую деятельность крайне важно. Эта не самая простая процедура, но она обязательна. При получении разрешения необходимо правильно собрать документы и соблюсти все условия предоставления лицензии, опираясь на нормативно-правовую базу.
Данное видео рассказывает про новое в лицензировании фармацевтической деятельности:
Порядок лицензирования фармацевтической деятельности
Данный подраздел официального сайта содержит информацию о порядке предоставления лицензии и порядке переоформления лицензии на осуществление фармацевтической деятельности.
Уважаемые соискатели лицензий и лицензиаты!
Управление Россельхознадзора по Тверской области информирует, что в соответствии с Постановлением Правительства Российской Федерации от 22.112.2011 № 1081 «О лицензировании фармацевтической деятельности» утвержден перечень выполняемых работ, оказываемых услуг, составляющих фармацевтическую деятельность.
При подаче заявления о предоставлении лицензии на осуществление фармацевтической деятельности или заявления о переоформлении документа, подтверждающего наличие лицензии на осуществление фармацевтической деятельности в сфере обращения лекарственных средств для ветеринарного применения, соискатель лицензии (лицензиат) должен указывать «хранение лекарственных средств и препаратов для ветеринарного применения» помимо «Новые виды услуг и работ» кроме «розничной торговли лекарственными препаратами для ветеринарного применения». Другие работы и услуги необходимо указывать при намерении их осуществлять.
Другие работы и услуги необходимо указывать при намерении их осуществлять.
Для получения лицензии соискатель лицензии (юридическое лицо или индивидуальный предприниматель, обратившиеся в лицензирующий орган с заявлением о предоставлении лицензии) направляет или представляет в соответствующий лицензирующий орган:
* заявление о предоставлении лицензии по установленной форме, в котором указываются:
— полное и сокращенное наименование, в том числе фирменное наименование, и организационно-правовая форма юридического лица, адрес места нахождения, адреса мест осуществления лицензируемого вида деятельности, государственный регистрационный номер записи о создании юридического лица и данные документа, подтверждающего факт внесения сведений о юридическом лице в единый государственный реестр юридических лиц в ЕГРЮЛ, с указанием адреса место нахождения органа, осуществляющего государственную регистрацию, а также номера телефона и (в случае, если имеется) адреса электронной почты юридического лица;
— фамилия, имя, отчество индивидуального предпринимателя, адрес места его жительства, адреса мест осуществления лицензируемого вида деятельности, данные документа, удостоверяющего его личность, государственный регистрационный номер записи о государственной регистрации индивидуального предпринимателя, данные документа, подтверждающего факт внесения сведений об индивидуальном предпринимателе в ЕГРИП, с указанием адреса место нахождения органа, осуществляющего государственную регистрацию, а также номера телефона и (в случае, если имеется) адреса электронной почты индивидуального предпринимателя;
— идентификационный номер налогоплательщика и данные документа о постановке соискателя лицензии на учет в налоговом органе;
— лицензируемый вид деятельности, который соискатель лицензии намерен осуществлять.
* копии документов, подтверждающих наличие у соискателя лицензии на праве собственности или на ином законном основании использования помещений и оборудования, необходимых для осуществления лицензируемого вида деятельности;
* ДЛЯ РАБОТНИКОВ — копии документов о высшем или среднем фармацевтическом либо высшем или среднем ветеринарном образовании и сертификатов специалистов, трудовые договоры.
ДЛЯ РУКОВОДИТЕЛЕЙ ОРГАНИЗАЦИИ (деятельность которого непосредственно связана с розничной торговлей лекарственными препаратами, их отпуском, хранением, перевозкой) — копии документов о высшем или среднем фармацевтическом либо высшем или среднем ветеринарном образовании, документ, подтверждающий стаж работы по специальности не менее 3 лет, сертификат специалиста.
ДЛЯ ИНДИВИДУАЛЬНОГО ПРЕДПРИНИМАТЕЛЯ — копии документов о высшем или среднем фармацевтическом либо высшем или среднем ветеринарном образовании и сертификат специалиста.
* копия санитарно-эпидемиологического заключения о соответствии помещений требованиям санитарных правил.
Заявление о предоставлении лицензии и прилагаемые к нему документы принимаются по описи.
Образец заявления о предоставлении лицензии Образец описи документов
Лицензия подлежит переоформлению в случаях реорганизации юридического лица в форме преобразования, изменения его наименования, адреса места нахождения, а также в случаях изменения места жительства, имени, фамилии, отчества индивидуального предпринимателя, реквизитов документа, удостоверяющего его личность, адресов мест осуществления юридическим лицом или индивидуальным предпринимателем лицензируемого вида деятельности, перечня выполняемых работ, оказываемых услуг, составляющих лицензируемый вид деятельности.
Для переоформления лицензии лицензиат представляет в лицензирующий орган, предоставивший лицензию, заявление о переоформлении лицензии, оригинал действующей лицензии, документ, подтверждающий уплату государственной пошлины за переоформление лицензии, документ, подтверждающий факт внесения соответствующих изменений в ЕГРЮЛ или ЕГРИП.
Заявление о предоставлении лицензии и прилагаемые к нему документы принимаются по описи.
Образец заявления о переоформлении лицензии Образец описи документов для переоформления лицензии
Фармацевтическая деятельность
Статья 65. Система сферы обращения лекарственных средств, изделий медицинского назначения и медицинской техники
В единую систему в сфере обращения лекарственных средств, изделий медицинского назначения и медицинской техники входят:
1)государственный орган в сфере обращения лекарственных средств, изделий медицинского назначения и медицинской техники;
2)государственная экспертная организация в сфере обращения лекарственных средств, изделий медицинского назначения и медицинской техники и ее территориальные подразделения.
Статья 66. Виды фармацевтической деятельности
1. Фармацевтическая деятельность включает профессиональную деятельность физических лиц, получивших высшее или среднее профессиональное фармацевтическое образование, а также юридических лиц, осуществляющих деятельность в области здравоохранения.
2. Фармацевтическая деятельность включает следующие виды:
1)производство лекарственных средств;
2)производство изделий медицинского назначения;
3)производство медицинской техники;
4)изготовление лекарственных препаратов;
5)изготовление изделий медицинского назначения;
6)оптовая реализация лекарственных средств;
7)оптовая реализация изделий медицинского назначения;
8)оптовая реализация медицинской техники;
9)розничная реализация лекарственных средств;
10)розничная реализация изделий медицинского назначения;
11)розничная реализация медицинской техники.
Статья 67. Производство лекарственных средств, изделий медицинского назначения и медицинской техники
1. Производство лекарственных средств, изделий медицинского назначения и медицинской техники — фармацевтическая деятельность, включающая совокупность всех работ, необходимых для серийного выпуска лекарственных средств, изделий медицинского назначения и медицинской техники, связанных с приобретением сырья, материалов и полуфабрикатов, технологическим процессом, в том числе с осуществлением одной из его стадий, хранением, реализацией произведенной продукции, а также всеми видами сопровождающего их контроля.
2. Производство лекарственных средств, изделий медицинского назначения и медицинской техники осуществляется в соответствии с правилами производства и нормативными документами по стандартизации субъектами в сфере обращения лекарственных средств, изделий медицинского назначения и медицинской техники, получившими лицензию на право производства лекарственных средств, изделий медицинского назначения и медицинской техники.
3. Правила производства и контроля качества, а также проведения испытаний стабильности и установления срока хранения и повторного контроля лекарственных средств, изделий медицинского назначения и медицинской техники утверждаются уполномоченным органом.
4. Запрещается производство лекарственных средств, изделий медицинского назначения и медицинской техники:
1)не прошедших государственную регистрацию в Республике Казахстан, за исключением лекарственных средств, изделий медицинского назначения и медицинской техники, предназначенных для проведения экспертизы при их государственной регистрации, при отладке и запуске оборудования и технологических процессов, а также лекарственных субстанций, произведенных в условиях Надлежащей производственной практики;
2)без лицензии на право производства лекарственных средств, изделий медицинского назначения и медицинской техники;
3)с нарушением Правил производства и контроля качества лекарственных средств, изделий медицинского назначения и медицинской техники.
5. Произведенные и ввозимые лекарственные средства:
1)не должны содержать в своем составе красители и вспомогательные вещества, перечень которых запрещен к применению в Республике Казахстан уполномоченным органом;
2)должны подлежать контролю в соответствии с нормативно-техническим документом по контролю за качеством и безопасностью лекарственных средств, разработанным согласно Правилам составления, согласования и экспертизы нормативно-технического документа по контролю за качеством и безопасностью лекарственных средств, утвержденным уполномоченным органом.
6. Производство и реализация запатентованных лекарственных средств, изделий медицинского назначения и медицинской техники осуществляются в соответствии с законодательством Республики Казахстан в области интеллектуальной собственности.
7. Производство изделий медицинского назначения и медицинской техники, предназначенных для проведения диагностики или лечения, должно обеспечивать их безопасность, предусматривать их использование в соответствии с функциональным назначением и исключать риск ошибок пользователя при интерпретации полученных результатов диагностики или лечения.
Статья 68. Изготовление лекарственных препаратов и изделий медицинского назначения
Изготовление лекарственных препаратов и изделий медицинского назначения осуществляется субъектами в сфере обращения лекарственных средств, изделий медицинского назначения, имеющими соответствующую лицензию на изготовление лекарственных препаратов и изделий медицинского назначения в соответствии с правилами, утвержденными уполномоченным органом. Изготовленные лекарственные препараты подлежат внутриаптечному контролю в порядке, утвержденном уполномоченным органом.
Статья 69. Оптовая и розничная реализация лекарственных средств, изделий медицинского назначения и медицинской техники
1. Оптовая реализация лекарственных средств, изделий медицинского назначения и медицинской техники осуществляется субъектами в сфере обращения лекарственных средств, изделий медицинского назначения и медицинской техники, получившими соответствующую лицензию на оптовую реализацию в аптечных складах, складах изделий медицинского назначения и медицинской техники.
2. Розничная реализация лекарственных средств, изделий медицинского назначения и медицинской техники осуществляется субъектами в сфере обращения лекарственных средств, изделий медицинского назначения и медицинской техники, получившими соответствующую лицензию на розничную реализацию в аптеках, аптечных пунктах, передвижных аптечных пунктах, магазинах оптики, магазинах медицинской техники и изделий медицинского назначения.
3. Оптовая и розничная реализация лекарственных средств, изделий медицинского назначения и медицинской техники осуществляется в порядке, определяемом уполномоченным органом.
4. Запрещается оптовая и розничная реализация лекарственных средств, изделий медицинского назначения и медицинской техники:
1)не прошедших государственную регистрацию в Республике Казахстан, за исключением лекарственных субстанций, произведенных в условиях Надлежащей производственной практики;
2)качество которых не подтверждено сертификатом соответствия в порядке, установленном законодательством Республики Казахстан;
3)не соответствующих требованиям законодательства Республики Казахстан;
4)с истекшим сроком годности;
5)медицинскими работниками в медицинских организациях, за исключением случаев, предусмотренных в пункте 6 настоящей статьи;
6)через склады временного хранения лекарственных средств, изделий медицинского назначения и медицинской техники.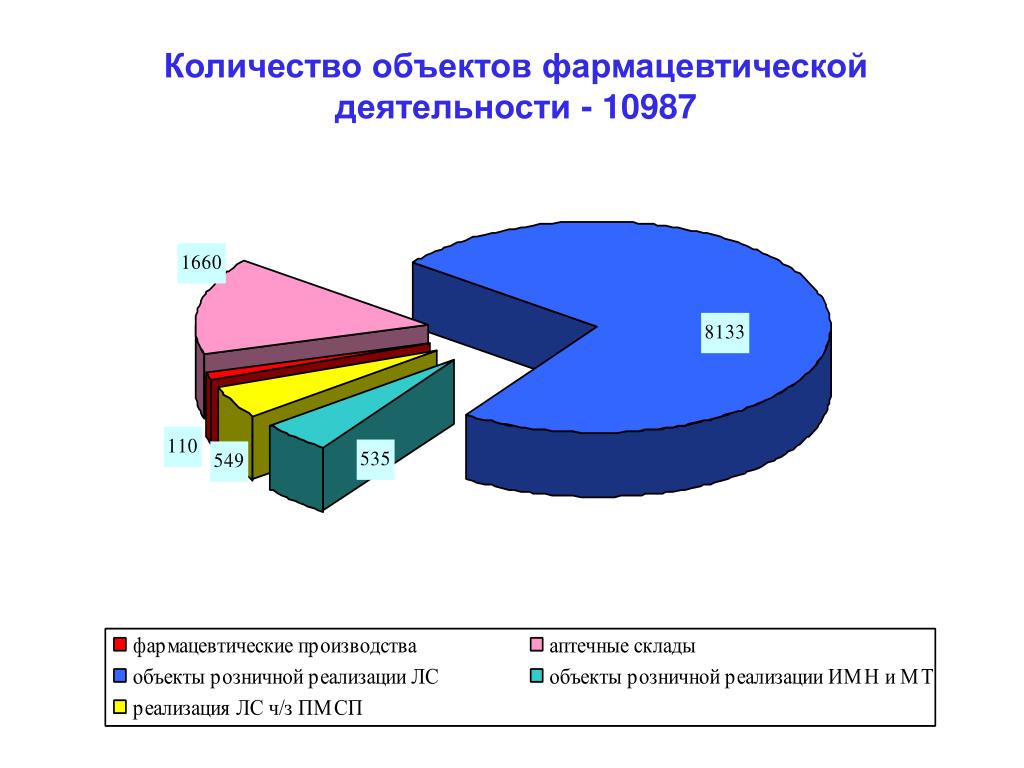
5. Запрещается безрецептурная реализация лекарственных средств, предназначенных для отпуска по рецепту врача.
Правила отнесения лекарственных средств к рецептурному или безрецептурному отпуску устанавливаются уполномоченным органом.
6. В отдаленных от районного центра населенных пунктах, где отсутствуют аптеки, реализацию лекарственных средств, изделий медицинского назначения могут осуществлять физические и юридические лица через аптечные пункты в организациях здравоохранения, оказывающих первичную медико-санитарную, консультативно-диагностическую помощь, и передвижные аптечные пункты.
При этом сохранность качества, безопасность и эффективность лекарственных средств, изделий медицинского назначения в случае отсутствия специалистов с фармацевтическим образованием обеспечивают специалисты с медицинским образованием, аттестованные в порядке, определенном уполномоченным органом.
7. Ввезенные и произведенные на территории Республики Казахстан до истечения срока регистрационного удостоверения лекарственные средства, изделия медицинского назначения и медицинская техника применяются, обращаются и эксплуатируются на территории Республики Казахстан без ограничений.
Ввезенные и произведенные на территории Республики Казахстан до истечения срока регистрационного удостоверения лекарственные средства, изделия медицинского назначения и медицинская техника применяются, обращаются и эксплуатируются на территории Республики Казахстан без ограничений.
Глава 14
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
Услуги, Лицензирование Фармацевтической деятельности, Лицензирование медицинской деятельности
Лицензирование Фармацевтической деятельности, Лицензирование медицинской деятельности
Лицензирование
Услуги лицензирования:
— на фармацевтическую деятельность и платные медицинские услуги;
— на реализацию, ремонт и импорт рентген-аппаратов;
— по оформлению разрешения на ввоз медицинской техники, изделий медицинского назначения и лекарственных средств;
Согласно Закону РК «О внесении изменений и дополнений в некоторые законодательные акты Республики Казахстан по вопросам здравоохранения», подписанного Президентом 16 июля 2009 года, были внесены изменения и дополнения в Закон РК «О лицензировании». По данному закону наименование вида деятельности «фармацевтическая деятельность: производство, изготовление, оптовая и розничная реализация лекарственных средств» изменилось на вид деятельности «фармацевтическая деятельность», и разделен на подвиды деятельности.
По данному закону наименование вида деятельности «фармацевтическая деятельность: производство, изготовление, оптовая и розничная реализация лекарственных средств» изменилось на вид деятельности «фармацевтическая деятельность», и разделен на подвиды деятельности.
Согласно ст. 26 Закона РК «О лицензировании», лицензированию подлежат следующие подвиды фармацевтической деятельности:
— оптовая реализация лекарственных средств;
— оптовая реализация изделий медицинского назначения;
— оптовая реализация медицинской техники;
— розничная реализация лекарственных средств;
— розничная реализация изделий медицинского назначения;
— розничная реализация медицинской техники.
Объекты фармацевтической деятельности – аптека, аптечный пункт, аптечный склад, склад временного хранения лекарственных средств, магазин оптики, магазин медицинской техники и изделий медицинского назначения, склад медицинской техники и изделий медицинского назначения, лаборатории по сертификации и испытанию лекарственных средств, организации по производству лекарственных средств.
Лицензиаром является Министерство здравоохранения Республики Казахстан. В соответствии с приказом МЗ РК от 22.04.2005г. №47 «О некоторых вопросах лицензирования» функция по лицензированию фармацевтической деятельности передана Управлениям (Департаментам) здравоохранения областей, г. Астаны, в г. Алматы Департаменту экономики и бюджетного планирования Акима г.Алматы.
Субъектами лицензирования являются физические или юридические лица в сфере обращения лекарственных средств, соответствующие квалификационным требованиям, предъявляемым при лицензировании фармацевтической деятельности. Одним из документов для получения лицензии на фармацевтическую деятельность является экспертное заключение органов ДКГЭСН МЗ РК и Противопожарной службы о соответствии заявителя квалификационным требованиям, предъявляемым при лицензировании вида фармацевтической деятельности
Лицензия на фармацевтическую деятельность является генеральной без ограничения срока действия.
Физические лица, желающие заниматься лицензируемыми видами фармацевтической деятельности, без образования юридического лица, должны иметь фармацевтическое образование.
Лицензирование фармацевтической деятельности регламентируется следующими нормативными правовыми актами Республики Казахстан:
- Постановление Правительства РК от 30 декабря 2009 года № 2301
- Законом Республики Казахстан от 13 января 2004 года № 522-II «О лекарственных средствах»
- Постановление Правительства РК от 29 декабря 1995 года №1894 «О реализации Закона РК «О лицензировании».
- Законом Республики Казахстан от 17 апреля 1995 года №2200 «О лицензировании»
- Постановлением Правительства Республики Казахстан от 05 июля 2005 года №692 «Об утверждении Правил лицензирования и квалификационных требований, предъявляемых при лицензировании фармацевтической деятельности»
- Санитарными правилами и нормами №3.01.078.02
- Приказ МЗ РК от 18 августа 2010 за №636 » Об утверждении санитарных правил, санитарно-эпидемиологические требования к объектам в сфере обращения лекарственных средств, изделий медицинского назначения и медицинской техники».

Regicom 2008, Авторские права. Услуги по регистрации.
+7 (701) 786 82 79, +7 (701) 789 90 00, +7 (727) 267 31 20
© Все права защищены.
Лицензирование фармацевтической деятельности и видов деятельности, связанных с оборотом наркотических средств, психотропных веществ и их прекурсоров
Авторы: Кононова С. В., Чеснокова Н. Н., Баранов Д. Е., Аношкина Е. В.Введение.
Фармацевтическая деятельность в большинстве стран относится к наиболее регулируемым государством видам деятельности. Государственные органы власти активно воздействуют на фармацевтический рынок через целевые закупки продукции, оплату работ и услуг из средств бюджетов различных уровней, установление ограничений списков лекарственных средств для определенных категорий населения, прямое или косвенное влияние цены, а также регулируют деятельность через механизм лицензирования. Система лицензирования дает единственно эффективную возможность воздействия на фармацевтическую организацию (ФО). Деятельность органов лицензирования оказывает не только стимулирующее и дисциплинирующее влияние на работу лицензиатов, но и нацеливает их на постоянное повышение уровня профессиональной деятельности как государственных, так и частных ФО.
Деятельность органов лицензирования оказывает не только стимулирующее и дисциплинирующее влияние на работу лицензиатов, но и нацеливает их на постоянное повышение уровня профессиональной деятельности как государственных, так и частных ФО.
Следует отметить, что в рыночных условиях фармацевтическая деятельность усложняется. Это связано с финансово-хозяйственной деятельностью как отдельных аптечных организаций, так и аптечных сетей, наличием различных форм собственности – государственной, муниципальной, частной. В связи с этим потребность государственного регулирования видов деятельности в сфере обращения лекарственных средств не только не снижается, но и значительно возрастает. Это обусловлено изменением всей правовой базы деятельности субъектов лекарственного бизнеса и гармонизацией ее с международными нормами регулирования деятельности на фармацевтическом рынке.
Практика деятельности лицензирующих органов показала, что функционирует достаточно стройная, жизнеспособная государственная система, которая обеспечивает в пределах своей компетенции выполнение конституционных прав граждан на получение качественной, безопасной лекарственной помощи в необходимом объеме.
Вопросы, затрагиваемые в пособии, направлены на приобретение знаний в области основ процесса лицензирования фармацевтической деятельности, а также деятельности по обороту наркотических средств и психотропных веществ. Изучение этих вопросов позволит решать задачи по оказанию квалифицированной современной качественной фармацевтической помощи, даст основу для успешного управления фармацевтической организацией.
1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПРОЦЕССА ЛИЦЕНЗИРОВАНИЯ
1.1. Нормативно-правовая база лицензирования фармацевтической деятельности
Основные нормативно-правовые документы, регламентирующие процедуры госконтроля и надзора.
1. ФЗ от 04.05.2011 г. № 99-ФЗ «О лицензировании отдельных видов деятельности»
2. ФЗ от 12.04.2010 г. № 61-ФЗ «Об обращении лекарственных средств»
3. ФЗ от 08.01.1998 г. № 3-ФЗ «О наркотических средствах и психотропных веществах»
4. ФЗ от 26.12.2008 г. № 294-ФЗ «О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля»
№ 294-ФЗ «О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля»
5. Постановление Правительства РФ от 21.11.2011 № 957 «Об организации лицензирования отдельных видов деятельности»
6. Постановление Правительства РФ от 30.03.1998 г. № 681 «Об утверждении перечня наркотических средств и их прекурсоров, подлежащих контролю в Российской Федерации»
7. Постановление Правительства РФ от 22.12.2011 г. № 1081 «О лицензировании фармацевтической деятельности»
8. Постановление Правительства РФ от 30.06.2004 г. № 323 «об утверждении Положения о Федеральной службе по надзору в сфере здравоохранения»
9. Постановление Правительства РФ от 22.12.2011 г. № 1085 «О лицензировании деятельности по обороту наркотических средств, психотропных веществ и их прекурсров, культивированию наркосодержащих растений»
10. Постановление Правительства РФ от 12.06.2008 г. № 449 «О порядке перевозки НС, ПВ и их прекурсоров на территории РФ, а также оформления необходимых для этого документов»
11. Постановление Правительства РФ от 16.04.2012 г. № 291 «О лицензировании медицинской деятельности (за исключением указанной деятельности, осуществляемой медицинскими организациями и другими организациями, входящими в частную систему здравоохранения, на территории инновационного центра «Сколково»)»
Постановление Правительства РФ от 16.04.2012 г. № 291 «О лицензировании медицинской деятельности (за исключением указанной деятельности, осуществляемой медицинскими организациями и другими организациями, входящими в частную систему здравоохранения, на территории инновационного центра «Сколково»)»
12. Постановление Правительства РФ от 09.06.2010 № 419 «О предоставлении сведений о деятельности, связанной с оборотом прекурсоров НС и ПВ, и регистрации операций, связанных с их оборотом»
13. Постановление Правительства РФ от 03.09.2010 г. № 674 «Об утверждении Правил уничтожения лекарственных средств, фальсифицированных лекарственных средств и контрафактных лекарственных средств»
14. Постановление Правительства РФ от 18.08.2010 г. № 640 «Об утверждении правил производства, переработки, хранения, реализации, приобретения, использования, перевозки и уничтожения прекурсоров НС и ПВ»
15. Постановление Правительства РФ от 06.08.1998 г. № 892 «Об утверждении Правил допуска лиц к работе с НС и ПВ, а также к деятельности, связанной с оборотом прекурсоров НС и ПВ»
16. Постановление Правительства РФ от 20.07.2011 г. № 599 «О мерах контроля в отношении препаратов, которые содержат малые количества НС, ПВ и их прекурсоров, включенных в перечень НС, ПВ и их прекурсоров, подлежащих контролю в РФ.
Постановление Правительства РФ от 20.07.2011 г. № 599 «О мерах контроля в отношении препаратов, которые содержат малые количества НС, ПВ и их прекурсоров, включенных в перечень НС, ПВ и их прекурсоров, подлежащих контролю в РФ.
17. Указ Губернатора Нижегородской области от 27.03.2012 № 19 «Об утверждении административных регламентов предоставления министерством здравоохранения Нижегородской области государственных услуг по лицензированию отдельных видов деятельности»
18. Приказ МЗ РФ от 13.12.2012 г. № 1040н «Об утверждении Положения о территориальном органе Федеральной службы по надзору в сфере здравоохранения»
19. Приказ МЗ РФ от 25.03.2014 г. № 130н «Об утверждении административного регламента Федеральной службы по надзору в сфере здравоохранения по представлению государственной услуги по лицензированию фармацевтической деятельности, осуществляемой организациями оптовой торговли лекарственными средствами для медицинского применения и аптечными организациями, подведомственными федеральным органам исполнительной власти, государственным академиям наук»
20. Приказ Министерства здравоохранения и социального развития России от 16.03.2010 г. № 157н «Об утверждении предельно допустимого количества НС, ПВ и их прекурсора, содержащегося в препаратах»
Приказ Министерства здравоохранения и социального развития России от 16.03.2010 г. № 157н «Об утверждении предельно допустимого количества НС, ПВ и их прекурсора, содержащегося в препаратах»
21. Приказ Росздравнадзора от 15.02.2012 г. № 547-Пр/12 «Об утверждении форм документов, используемых Федеральной службой по надзору в сфере здравоохранения в процессе лицензирования фармацевтической деятельности»
22. Приказ Росздравнадзора от 28.11.2006 г. № 2549-Пр/06 «Об утверждении форм документов, используемых Росздравнадзором в процессе лицензирования деятельности, связанной с оборотом наркотических средств и психотропных веществ, внесенных в Список II»
23. Приказ Министерства здравоохранения и социального развития и Федеральной службы по надзору в сфере здравоохранения и социального развития от 09.10.2006 г. № 2284-Пр/06 «Об утверждении форм документов, используемых Росздравнадзором в процессе лицензирования фармацевтической деятельности»
24. Письмо Росздравнадзора от 26 октября 2011 г. № 04И-1000/11 «О лицензировании»
№ 04И-1000/11 «О лицензировании»
25. Письмо Министерства здравоохранения и социального развития РФ от 3 февраля 2012 г. № 25-1/10/2-855
26. Письмо Министерства здравоохранения и социального развития РФ от 06.06.2012 г. № 975/25-1 «О порядке отпуска кодеинсодержащих лекарственных препаратов»
27. Письмо Министерства здравоохранения РФ от 13.0.2014 № 25-4/10/2-79
28. Письмо Министерства здравоохранения и социального развития РФ № 25-1/10/2-1208 от 8 февраля 2011 г. (разъяснение о хранении ЛС).
1.2. Основные понятия, принципы процесса лицензирования
Федеральный закон от 4 мая 2011 № 99-ФЗ «О лицензировании отдельных видов деятельности» устанавливает правовые основы государственной политики и регулирует отношения, возникающие между федеральными органами исполнительной власти, органами исполнительной власти субъектов Российской Федерации, юридическими лицами и индивидуальными предпринимателями в связи с осуществлением лицензирования отдельных видов деятельности.
Основные понятия
Статья 3 Федерального закона от 04.05.2014 № 99-ФЗ дает определение следующим понятиям:
лицензирование – деятельность лицензирующих органов по предоставлению, переоформлению лицензий, продлению срока действия лицензий в случае, если ограничение срока действия лицензий предусмотрено федеральными законами, осуществлению лицензионного контроля, приостановлению, возобновлению, прекращению действия и аннулированию лицензий, формированию и ведению реестра лицензий, формированию государственного информационного ресурса, а также по предоставлению в установленном порядке информации по вопросам лицензирования;
лицензия – специальное разрешение на право осуществления юридическим лицом или индивидуальным предпринимателем конкретного вида деятельности (выполнения работ, оказания услуг, составляющих лицензируемый вид деятельности), которое подтверждается документом, выданным лицензирующим органом на бумажном носителе или в форме электронного документа, подписанного электронной подписью, в случае, если в заявлении о предоставлении лицензии указывалось на необходимость выдачи такого документа в форме электронного документа;
лицензируемый вид деятельности – вид деятельности, на осуществление которого на территории Российской Федерации и на иных территориях, над которыми Российская Федерация осуществляет юрисдикцию в соответствии с законодательством Российской Федерации и нормами международного права, требуется получение лицензии;
лицензирующие органы – уполномоченные федеральные органы исполнительной власти и (или) их территориальные органы, а в случае передачи осуществления полномочий Российской Федерации в области лицензирования органам государственной власти субъектов Российской Федерации органы исполнительной власти субъектов Российской Федерации, осуществляющие лицензирование;
соискатель лицензии – юридическое лицо или индивидуальный предприниматель, обратившиеся в лицензирующий орган с заявлением о предоставлении лицензии;
лицензиат – юридическое лицо или индивидуальный предприниматель, имеющие лицензию;
лицензионные требования – совокупность требований, которые установлены положениями о лицензировании конкретных видов деятельности, основаны на соответствующих требованиях законодательства Российской Федерации и направлены на обеспечение достижения целей лицензирования;
место осуществления отдельного вида деятельности, подлежащего лицензированию (место осуществления лицензируемого вида деятельности), — объект (помещение, здание, сооружение, иной объект), который предназначен для осуществления лицензируемого вида деятельности и (или) используется при его осуществлении, соответствует лицензионным требованиям, принадлежит соискателю лицензии или лицензиату на праве собственности либо ином законном основании, имеет почтовый адрес или другие позволяющие идентифицировать объект данные. Место осуществления лицензируемого вида деятельности может совпадать с местом нахождения соискателя лицензии или лицензиата.
Место осуществления лицензируемого вида деятельности может совпадать с местом нахождения соискателя лицензии или лицензиата.
Основные принципы осуществления лицензирования
Согласно статье 4 Федерального закона от 04.05.2014 № 99-ФЗ основными принципами осуществления лицензирования являются:
1) обеспечение единства экономического пространства на территории Российской Федерации;
2) установление лицензируемых видов деятельности федеральным законом;
3) установление федеральными законами единого порядка лицензирования отдельных видов деятельности на территории Российской Федерации;
4) установление исчерпывающих перечней лицензионных требований в отношении лицензируемых видов деятельности положениями о лицензировании конкретных видов деятельности;
5) открытость и доступность информации о лицензировании, за исключением информации, распространение которой запрещено или ограничено в соответствии с законодательством Российской Федерации;
6) недопустимость взимания с соискателей лицензий и лицензиатов платы за осуществление лицензирования, за исключением уплаты государственной пошлины в размерах и в порядке, которые установлены законодательством Российской Федерации о налогах и сборах;
7) соблюдение законности при осуществлении лицензирования.
Чтобы читать дальше, купите книгу.
Стоимость:
Превращение идей в продукты — сдвиг фармацевтической парадигмы
Боб Даммс, эксперт по технологиям здравоохранения штата Пенсильвания
В условиях сокращения расходов на фармацевтические исследования и разработки и сокращения финансирования университетов, где мы найдем следующие лекарственные препараты-блокбастеры, особенно в то время, когда Великобритания полагается на экономику, основанную на знаниях. помочь поддержать будущий экономический рост?
Следующий большой прорывный препарат вряд ли станет «блокбастером», и дело не только в том, чтобы искать нужные места, быть более гибкими и добиться лучшего сотрудничества между британскими академиками и промышленностью для открытия следующего большого открытия.
Постгеномный сдвиг в сторону стратификации пациентов изменил традиционную фармацевтическую бизнес-модель с одной разработки недорогих лекарств с дополнительными преимуществами для больших групп пациентов до одного из эффективных и дорогостоящих лекарств для целевых, нишевых групп пациентов.
Это означает фундаментальное изменение подхода к открытию лекарств и, в конечном итоге, кардинальное изменение способа оплаты лекарств. Быстро приближается эпоха захвата ниш, а не блокбастеров.
Фармацевтические компании в конечном итоге будут продавать меньше лекарств более целевым группам населения, что может повлиять на глобальную прибыль, но этот более трансляционный подход имеет то преимущество, что сокращает процесс открытия лекарств.
Фармацевтические компании имеют возможность производить меньше лекарств, взимать больше и снижать себестоимость производства. Несмотря на важность более тесного взаимодействия между академическими кругами и промышленностью — особенно в обучении и развитии следующего поколения ученых и исследователей — оно может лишь частично решить проблемы, с которыми сталкивается Великобритания при воплощении своих идей в успешные продукты.
Для этого университеты и промышленность должны дать возможность нужным людям активно выявлять новые ИС в академических учреждениях. Эти люди должны быть встроены в поле или терапевтическую зону; уметь использовать новейшие бизнес-модели; и иметь регулярный и подробный доступ к отраслевой аналитической информации.
Эти люди должны быть встроены в поле или терапевтическую зону; уметь использовать новейшие бизнес-модели; и иметь регулярный и подробный доступ к отраслевой аналитической информации.
Еще одна проблема заключается в том, что промышленность часто рассматривается как источник финансирования, а не знаний и понимания, и, наоборот, императивы, которые движут соответствующими учреждениями, часто не совпадают.Вместо того, чтобы вовлекать отрасль на поздней стадии, взаимодействие с соответствующими отраслевыми экспертами на более раннем этапе открытия может внести существенное понимание в разработку продукта.
Правительство Великобритании сделало значительные инвестиции в переводческую инфраструктуру за последние 10-15 лет. Чтобы реализовать это, нам необходимо разработать усовершенствованные системы управления и организационные структуры, чтобы согласовать академические институты с промышленностью — трудная работа, но не требующая больших затрат.Последующий успех еще больше повысит репутацию британских биомедицинских исследований и откроет значительную коммерческую прибыль.
Чтобы обсудить эффективные стратегии превращения идей в продукты в новой среде здравоохранения, свяжитесь с нами сейчас.
Приоритет фармацевтической деятельности: упражнение на моделирование
Can J Hosp Pharm. 2012 март-апрель; 65 (2): 119–124.
Софи РенеСофи Рене — стажер и научный сотрудник отдела исследований фармацевтической практики, CHU Sainte-Justine, Монреаль, Квебек
Элиза РошэЭлиза Рошэ — стажер и научный сотрудник отдела исследований фармацевтической практики Подразделение, CHU Sainte-Justine, Montréal, Quebec
Cynthia TanguayCynthia Tanguay , бакалавр, магистр, научный сотрудник исследовательского отдела фармацевтической практики Uunit, CHU Sainte-Justine, Montréal, Quebec
Kevin W Hall Kevin W Холл , бакалавр наук, фармацевт, доцент кафедры социальной и административной фармации, факультет фармации и фармацевтических наук, Университет Альберты, Эдмонтон, Альберта. Он также является младшим редактором журнала CJHP
Он также является младшим редактором журнала CJHP
Jean-François Bussières , BPharm, MSc, является главой фармацевтического отдела и исследовательского отдела фармацевтической практики CHU Sainte-Justine и Clinical Профессор фармацевтического факультета Монреальского университета, Монреаль, Квебек
Адресная корреспонденция: Жан-Франсуа Бюссьер, фармацевтический отдел, Госпитальный университет Сент-Жюстин, 3175, chemin de la Côte Sainte-Catherine, Montréal QC h4T 1C5, e почта: [email protected] Авторские права 2012 Канадское общество больничных фармацевтов. Все материалы в Canadian Journal of Hospital Pharmacy защищены авторским правом Канадского общества больничных аптек. Отправляя свои рукописи, авторы передают, переуступают или иным образом передают все авторские права CSHP.ВВЕДЕНИЕ
Практика больничных аптек претерпела множество изменений за последние 3 десятилетия. 1 — 3 Новые технологии, такие как автоматическая переупаковка, роботизированные системы заполнения тележек единичными дозами и автоматические распределительные шкафы, повысили эффективность, результативность и качество систем распределения лекарств.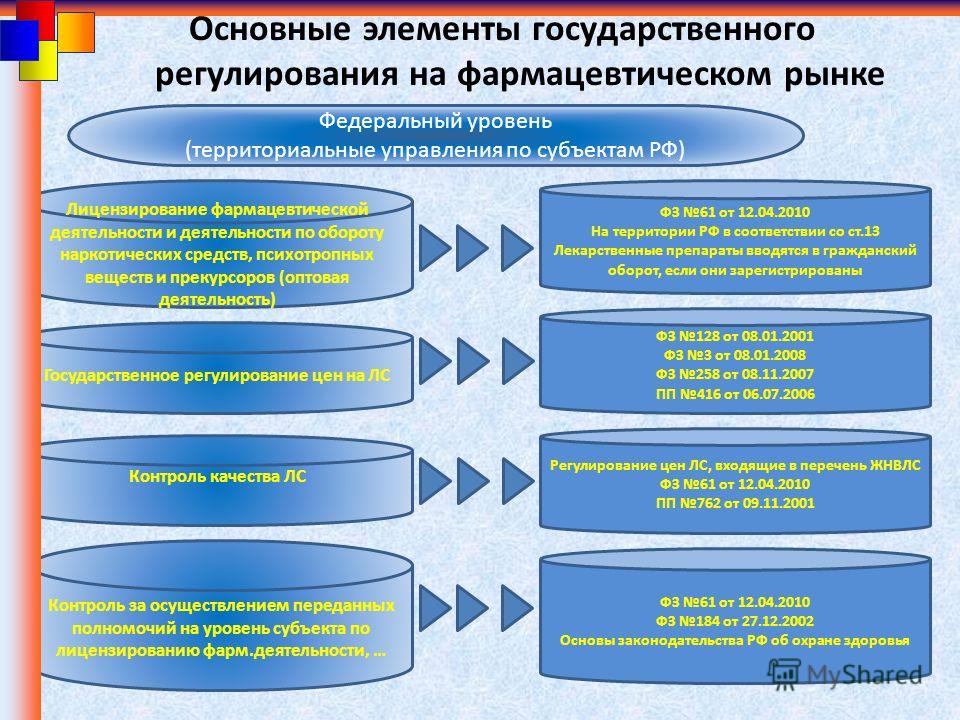 Кроме того, были введены новые модели фармацевтической практики, в которых фармацевты принимают на себя ответственность и подотчетность за управление лекарственной терапией (например, фармацевтическая помощь, управление лекарственной терапией). Существует множество доказательств того, что многие услуги аптек влияют на качество и эффективность здравоохранения, 4 — 8 , но использование многих услуг, основанных на фактических данных, было медленным и неполным. Таким образом, существует относительный недостаток литературы о процессах принятия решений, которые руководители и практикующие специалисты аптек используют для определения приоритетности предоставляемых ими аптечных услуг.Учитывая, что доступные человеческие и финансовые ресурсы ограничены, для руководителей аптек и других специалистов важно определить и понять основу для своих решений по определению приоритетов. В частности, они должны понимать, является ли портфель услуг, предоставляемых конкретным отделением аптеки, основанным на фактических данных, предпочтениях или результатом случайных возможностей, возникших в больнице.
Кроме того, были введены новые модели фармацевтической практики, в которых фармацевты принимают на себя ответственность и подотчетность за управление лекарственной терапией (например, фармацевтическая помощь, управление лекарственной терапией). Существует множество доказательств того, что многие услуги аптек влияют на качество и эффективность здравоохранения, 4 — 8 , но использование многих услуг, основанных на фактических данных, было медленным и неполным. Таким образом, существует относительный недостаток литературы о процессах принятия решений, которые руководители и практикующие специалисты аптек используют для определения приоритетности предоставляемых ими аптечных услуг.Учитывая, что доступные человеческие и финансовые ресурсы ограничены, для руководителей аптек и других специалистов важно определить и понять основу для своих решений по определению приоритетов. В частности, они должны понимать, является ли портфель услуг, предоставляемых конкретным отделением аптеки, основанным на фактических данных, предпочтениях или результатом случайных возможностей, возникших в больнице.
Имитационное упражнение было разработано для изучения того, как менеджеры больничных аптек принимают решения по приоритизации.Основная цель упражнения заключалась в изучении последовательности решений руководителей аптек по определению приоритетов в смоделированной среде с ограничениями на доступные ресурсы. Вторичной целью было ранжирование факторов, влияющих на решения по приоритизации, и сравнение рейтинга этих факторов отдельными лицами и командами.
МЕТОДЫ
Моделируемое упражнение по приоритизации было разработано и проведено во время симпозиума, на котором присутствовали 39 англоязычных и 10 франкоязычных менеджеров аптек из всех регионов Канады (Конференция по руководству аптек больниц Милкрофт, состоявшаяся в Альтоне, Онтарио, в июне 2011 года).Учения проводились на английском языке с дополнительными инструкциями на французском языке для тех, кто их просил. Фармацевтическая деятельность, использованная в упражнении, и их относительные потребности в ресурсах были определены исследовательской группой на основе данных 9 больничной аптеки в Канаде за 2009/2010 гг. И знаний команды о практике больничных аптек. Имитационное упражнение и инструменты, использованные в упражнении, были предварительно протестированы на группе из 6 фармацевтов-практикантов.
И знаний команды о практике больничных аптек. Имитационное упражнение и инструменты, использованные в упражнении, были предварительно протестированы на группе из 6 фармацевтов-практикантов.
Каждый руководитель аптеки был разделен на 1 из 8 групп, каждая из которых состояла из 6 или 7 человек. Считалось, что каждая группа представляет виртуальный аптечный отдел. Исследовательская группа произвольно определила по одному члену каждой группы, который будет руководить виртуальным отделом. Этот человек отвечал за то, чтобы упражнение было завершено в отведенное время.
Каждой команде были даны следующие письменные инструкции. «Вы действуете в качестве группы управления аптекой в новой учебной больнице на 300 коек, которая работает в рамках системы здравоохранения, которая сталкивается с финансовыми, человеческими и материальными ограничениями.Для целей этого моделирования фармацевтическая практика была разделена на 5 областей: распространение лекарств, клинические услуги, обучение, исследования и менеджмент. Вам предоставлен набор из 142 цветных этикеток, представляющих в общей сложности 32 фармацевтических вида деятельности и услуг (). Каждая метка представляет примерно одинаковое количество ресурсов, которые необходимо потратить на эту услугу или действие. Этикетки имеют цветовую кодировку в соответствии с 5 областями фармацевтической практики: зеленый для распределения лекарств, белый для клинических услуг, красный для обучения, синий для исследований и коричневый для менеджмента.У вас есть 30 минут, чтобы выбрать услуги аптеки, которые вам предоставит ваш отдел. Выберите и приклейте на плакат вашей группы 60 этикеток, представляющих приоритетные направления деятельности вашей больницы. 60 этикеток будут отражать все ваши финансовые средства на фармацевтическую деятельность и услуги. Вы можете решить реализовать услугу только частично (например, услугу только для 50% коек) или полностью реализовать услугу (т.е. 100% коек) ».
Вам предоставлен набор из 142 цветных этикеток, представляющих в общей сложности 32 фармацевтических вида деятельности и услуг (). Каждая метка представляет примерно одинаковое количество ресурсов, которые необходимо потратить на эту услугу или действие. Этикетки имеют цветовую кодировку в соответствии с 5 областями фармацевтической практики: зеленый для распределения лекарств, белый для клинических услуг, красный для обучения, синий для исследований и коричневый для менеджмента.У вас есть 30 минут, чтобы выбрать услуги аптеки, которые вам предоставит ваш отдел. Выберите и приклейте на плакат вашей группы 60 этикеток, представляющих приоритетные направления деятельности вашей больницы. 60 этикеток будут отражать все ваши финансовые средства на фармацевтическую деятельность и услуги. Вы можете решить реализовать услугу только частично (например, услугу только для 50% коек) или полностью реализовать услугу (т.е. 100% коек) ».
Таблица 1
Наклейки, доступные для определения приоритетов деятельности в больничной аптеке *
| Доменная и фармацевтическая деятельность или услуга | Покрытие, предоставляемое каждой этикеткой | No. Количество этикеток Количество этикеток | ||
|---|---|---|---|---|
| Распределение лекарств | ||||
| Система однократных доз (централизованная) | 10% коек | 10 | ||
| Служба парентеральной добавки | 10% коек | 10 | 10 | 10 |
| Цитотоксические добавки и опасные препараты | 20% коек | 5 | ||
| Централизованная упаковка и роботизация | 20% потребностей | 5 | ||
| Автоматизированные децентрализованные шкафы | 10% коек||||
| Подтверждение поступления заказа фармацевтом | 10% коек | 10 | ||
| Часы работы (часы работы аптеки) | 20% потребностей | 5 | ||
| Клинические услуги | ||||
| Децентрализованная фармацевтическая помощь | 901 00||||
| Стационарный | 10% коек | 10 | ||
| Амбулаторный | 10% амбулаторных посещений | 10 | ||
| Комитеты | ||||
| Фармакология | Фармакология и терапия 1||||
| Инфекционный контроль | 100% потребностей | 1 | ||
| Этика | 100% потребностей | 1 | ||
| Безопасность лекарств | 100% потребностей | 1 | 10100% потребностей | 1 |
| Другие клинические | ||||
| Процесс согласования лекарств | 10% коек | 10 | ||
| Центр информации о лекарствах | 20% вопросов | 5 | ||
| Оценка услуг клинической аптеки | 20% фармацевты | 5 | ||
| Зависимые или независимые назначения | 20% пациентов | 5 | ||
| Преподавание | ||||
| Повышение квалификации для поддержания квалификации | 50% потребностей | 2 | ||
| Для фармацевтов | 50% потребностей | 2 | ||
| Для других специалистов здравоохранения | 50% потребностей | 2 | ||
| Стажировка | ||||
| Студенты бакалавриата фармацевтики | 20% потребностей | 5 | ||
| Студенты последипломного образования фармации | 20% потребностей | 5 | ||
| Другое обучение | % потребностей | 2 | 90 093||
| Исследования | ||||
| Поддержка клинических испытаний | 50% потребностей | 2 | ||
| Первоначальное оценочное исследование | 20% потребностей | 5 | ||
| Лекарственные препараты | 50% потребностей | 2 | ||
| Управление | ||||
| Управление человеческими ресурсами | 50% потребностей | 2 | ||
| Управление материальными ресурсами | 50% потребностей2 | |||
| Управление финансовыми ресурсами | 50% потребностей | 2 | ||
| Управление проектами | 50% потребностей | 2 | ||
| Другие потребности управления | 50% потребностей | 2 | ||
| Итоговариантов, предоставленных каждой команде | 142 | |||
После того, как команды завершили упражнение по определению приоритетов, каждому участнику был предоставлен список из 16 факторов, которые могли повлиять на решения по приоритизации, и было предложено ранжировать относительная важность, от наивысшего к низшему (от 1 до 16, соответственно), каждого фактора в их решениях. После этого руководителей групп попросили провести групповое обсуждение рейтинга и прийти к консенсусу своих групп относительно относительной важности каждого фактора в решениях по расстановке приоритетов.Участникам было дано в общей сложности 15 минут на выполнение индивидуального и группового ранжирования факторов, влияющих на решения по расстановке приоритетов. На следующий день участникам был представлен синтез результатов, после чего последовала дискуссия о принятии решений в секторе здравоохранения.
После этого руководителей групп попросили провести групповое обсуждение рейтинга и прийти к консенсусу своих групп относительно относительной важности каждого фактора в решениях по расстановке приоритетов.Участникам было дано в общей сложности 15 минут на выполнение индивидуального и группового ранжирования факторов, влияющих на решения по расстановке приоритетов. На следующий день участникам был представлен синтез результатов, после чего последовала дискуссия о принятии решений в секторе здравоохранения.
Анализ данных
Основная цель — проверить последовательность решений по расстановке приоритетов, принятых в контексте ограниченных ресурсов, — измерялась тремя способами. Сначала была изучена фотография схемы расстановки приоритетов каждой группы и подсчитаны ярлыки из каждого домена.Это позволило рассчитать количество мероприятий, выполняемых каждой командой. Деятельность считалась «охваченной», если был нанесен хотя бы один ярлык. Во-вторых, относительный вес, присвоенный каждой области, был рассчитан путем деления общего количества баллов, присвоенных домену, на общее количество баллов, использованных командой. Один балл присваивался за каждый 1% услуги, охваченной выбранными ярлыками. В-третьих, для каждой команды рассчитывалась степень охвата по видам деятельности.
Один балл присваивался за каждый 1% услуги, охваченной выбранными ярлыками. В-третьих, для каждой команды рассчитывалась степень охвата по видам деятельности.
Вторичная цель была измерена путем усреднения индивидуальных ( n = 49) и групповых ( n = 8) рейтингов для каждого фактора, который мог повлиять на решения по приоритизации.Затем эти средние значения использовались для повторного ранжирования факторов с 1 до 16 как для отдельных лиц, так и для команд. Корреляция между средними рейтингами отдельных лиц и команд определялась с помощью коэффициента ранговой корреляции Спирмена. Значение p менее 0,05 считалось статистически значимым. Высокий коэффициент корреляции (значение, близкое к 1) указывает на строго положительную взаимосвязь между индивидуальным и командным рейтингом. Отрицательный коэффициент корреляции указывает на отрицательную взаимосвязь между индивидуальным и командным рейтингом.
Для всех числовых анализов данные вводились в электронную таблицу Microsoft Excel 2010 (Microsoft, Сиэтл, Вашингтон).
РЕЗУЛЬТАТЫ
В среднем команды охватили 24 ± 4 (среднее ± стандартное отклонение) из 32 мероприятий (). В то время как большинство команд (6 из 8) отдали приоритет более чем двум третям из 32 предложенных фармацевтических мероприятий, 2 команды отдали предпочтение меньшему количеству мероприятий (18/32 и 16/32 соответственно), чтобы обеспечить более полный охват тех услуг, которые они решили предоставить.
Пример расстановки приоритетов команды в отношении фармацевтической деятельности и услуг. Цветовая кодировка, используемая в упражнении по моделированию для 5 областей фармацевтической деятельности, представлена здесь графическими узорами. ADC = автоматизированный децентрализованный шкаф, PAS = служба парентеральных добавок.
В среднем по всем 8 командам относительные веса, присвоенные каждой области фармацевтической практики, составили 34% для клинических услуг, 24% для служб распределения лекарств, 21% для управленческой деятельности, 16% для обучающих услуг и 5% для исследовательской деятельности. ().Степень охвата отдельных видов деятельности и услуг сильно варьировалась от одной команды к другой. Например, для 19 из 32 мероприятий диапазон охвата составлял более 60 процентных пунктов, а для 9 мероприятий охват составлял от 0% до 100% ().
().Степень охвата отдельных видов деятельности и услуг сильно варьировалась от одной команды к другой. Например, для 19 из 32 мероприятий диапазон охвата составлял более 60 процентных пунктов, а для 9 мероприятий охват составлял от 0% до 100% ().
Таблица 2
Приоритезация 5 сфер больничной аптечной практики
| Команда; Относительный вес каждого домена (количество [%] баллов) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Домен | Команда A | Команда B | Команда C | Команда D | Команда E | Команда F | Команда G | Команда H | Всего |
| Распределение лекарств | 290 (21) | 380 (27) | 400 (37) | 350 (23) | 390 (26) | 340 (28) | 360 (25) | 210 (14) | 2720 (24) |
| Клинические услуги | 400 (29) | 340 (24) | 350 (32) | 500 (32) | 470 (32) | 600 (49) | 490 (34 ) | 630 (41) | 3780 (34) |
| Обучение | 330 (24) | 290 (20) | 40 (4) | 180 (12) | 330 (22) | 140 (11) | 140 (10) | 310 (20) | 1760 (16) |
| Исследования | 90 114100 (7)70 (5) | 0 (0) | 120 (8) | 50 (3) | 0 (0) | 170 (12) | 70 (5) | 580 (5) | |
| Менеджмент | 250 (18) | 350 (24) | 300 (28) | 400 (26) | 250 (17) | 150 (12) | 300 (21) | 300 (20) | 2300 (21) |
| Всего * | 1370 (100) | 1430 (100) | 1090 (100) | 1550 (100) | 1490 (100) | 1230 (100) | 1460 (100) | 1520 (100) | 11140 (100) |
Таблица 3
Приоритизация фармацевтической деятельности
| Команда; % Покрытия | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Доменная и фармацевтическая деятельность или услуги | A | B | C | D | E | F | G | H | Все (среднее ± стандартное отклонение) ) | ||||||||||
| Распределение лекарств | |||||||||||||||||||
| Система разовых доз (централизованная) | 50 | 50 | 10 | 80 | 0 | 50 | 60 | 2029 27 | |||||||||||
| Служба парентеральной добавки | 60 | 50 | 70 | 50 | 50 | 80 | 30 | 50 | 55 ± 15 | ||||||||||
| 100 | 100 | 100 | 100 | 100 | 40 | 20 | 73 ± 38 | ||||||||||||
| Централизованная упаковка и роботизация | 0 | 0 | 0 | 80 | 40 | 0 | 60 | 20 | 25 ± 32 | ||||||||||
| Автоматизированные децентрализованные шкафы 40107 9011 9011 | 9011 9011 9011 90110 | 60 | 50 | 40 | 60 | 39 ± 25 | |||||||||||||
| Проверка ввода заказа фармацевтом | 60 | 100 | 80 | 0 | 70 | 40 | 54 ± 37 | ||||||||||||
| Часы работы аптеки | 60 | 80 | 80 | 40 | 60 | 60 | 60 | 0 | 55 | ||||||||||
| Клинические услуги | |||||||||||||||||||
| Децентрализованная фармацевтическая помощь | |||||||||||||||||||
| In пациент | 50 | 60 | 40 | 50 | 60 | 90 | 70 | 50 | 59 ± 16 | ||||||||||
| Амбулаторно | 20 | 10 9010 | 60 | 20 | 30 | 34 ± 25 | |||||||||||||
| Комитеты | |||||||||||||||||||
| Фармакология и терапия | 100 | 100 | 100 | 100 | 100 | 100 ± 0 | |||||||||||||
| Инфекционный контроль | 0 | 0 | 0 | 0 | 0 | 0 | 100 | 100 | 25 ± 46 | 0 | 0 | 100 | 0 | 100 | 0 | 0 | 25 ± 46 | ||
| 100 | 100 | 0 | 100 | 100 | 100 | 100 | 100 | 88 ± 35 | |||||||||||
| Побочные реакции на лекарства | 0 | 0 | 0 | 0 | 100 | 100 | 0 | 100 | 38 ± 52 | ||||||||||
| Другой клинический | |||||||||||||||||||
| Процесс согласования лекарств | 70 | 30 | 30 20107 | 10 | 50 | 20 | 30 | 33 ± 19 | |||||||||||
| Центр информации о лекарствах | 20 | 0 | 0 | 40 | 40 | 0 | 20 | 80 251007 28 | |||||||||||
| Оценка услуг клинической аптеки | 20 | 20 | 40 | 40 | 20 | 0 | 901 14 2020 | 23 ± 13 | |||||||||||
| Зависимое или независимое назначение | 20 | 20 | 60 | 20 | 20 | 0 | 40 | 20 | 7 | ||||||||||
| Преподавание | |||||||||||||||||||
| Обучение без отрыва от производства для поддержания компетентности | |||||||||||||||||||
| Для технического персонала | 100 | 100 | 0 | 0 | 100 | 56 ± 50 | |||||||||||||
| Для фармацевтов | 100 | 100 | 0 | 50 | 100 | 0 | 50 | 100 | 63 ± 44 | ||||||||||
| 50 | 50 | 0 | 50 | 50 | 0 | 0 | 50 | 31 ± 26 | |||||||||||
| Стажировка | |||||||||||||||||||
| Студенты бакалавриата фармацевтики | 40 | 20 | 20 | 60 | 40 | 40 | 20 | ||||||||||||
| Аспирантура фармации | 40 | 20 | 20 | 20 | 40 | 100 | 20 | 20 | 35 ± 28 | ||||||||||
| 10 Внешнее обучение | 00 | 0 | 0 | 0 | 0 | 0 | 0 | 0 ± 0 | |||||||||||
| Исследования | |||||||||||||||||||
| 0 | 0 | 50 | 50 | 0 | 100 | 0 | 31 ± 37 | ||||||||||||
| Оригинальное оценочное исследование | 0 | 20 | 0 | 20 | 0 | 0 | 20 | 20 | 10 ± 11 | ||||||||||
| Обзоры использования лекарственных средств | 50 | 0 | 50 | 0 | 0 | 50 | 50 | 31 ± 26 | |||||||||||
| Управление | |||||||||||||||||||
| Управление персоналом | 100 | 100 | 100 | 100 | 100 | 100 | 100 ± 0 | ||||||||||||
| Управление материальными ресурсами | 0 | 100 | 50 | 100 | 50 | 50 | 50 ± 38 | ||||||||||||
| Управление финансовыми ресурсами | 100 | 100 | 100 | 100 | 50 | 50 | 50 | 50 | 75 ± 27 | ||||||||||
| Управление проектами | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 44 ± 18 | ||||||||||
| Другие потребности управления | 0 | 0 | 0 | 50 | 0 | 0 | 50 | 50 | 19 ± 262 | ||||||||||
| Ранжирование по отдельным лицам | Ранжирование по командам | |||
|---|---|---|---|---|
Факторизация Влияние Факторизация | Средний рейтинг ( n = 49) | Числовой рейтинг на основе средних значений † | Средний рейтинг ( n = 8) | Числовой рейтинг на основе средних значений † | |
Восприятие благоприятного влияние деятельности или услуги на безопасное оказание медицинской помощи (т. д., сокращение количества ошибок при приеме лекарств) д., сокращение количества ошибок при приеме лекарств) | 4,5 | 2 | 2,6 | 1 |
| Восприятие положительного влияния деятельности или услуги на результаты для здоровья (то есть улучшение или поддержание состояния здоровья пациента) | 3,4 | 1 | 3,4 | 2 |
| Неопровержимые доказательства, доступные для поддержки решений | 6,9 | 3 | 4,9 | 3 |
| Желание соответствовать законодательной или нормативной базе | 7. 6 6 | 4 | 6,0 | 4 |
| Требуется для проведения аудитов или инспекций | 9,6 | 12 | 6,1 | 5 |
| Руководство лица, назначенного директором отдела | 8,0 | 8,0 | 6 | |
Восприятие благоприятного воздействия деятельности или услуги на расходы на здравоохранение (т. е. оптимизация затрат) е. оптимизация затрат) | 8,7 | 9 | 8.0 | 7 |
| Наличие достаточного опыта для предложения деятельности или услуги | 9,0 | 10 | 9,0 | 8 |
| Доминирующее влияние члена команды, кроме директора отдела | 9,1 | 11 | 9,99 | |
| Простота реализации и поддержки деятельности или услуги | 9,9 | 15 | 10,0 | 10 |
| Популярность деятельности или услуги среди членов команды | 8. 6 6 | 8 | 10,1 | 11 |
| Профессиональные интересы членов команды | 8,4 | 7 | 10,8 | 12 |
| Управленческая поддержка (т.е. на финансовом и / или политическом уровне) или поддержка от других заинтересованных сторон внутри организации | 9,7 | 13 | 10,8 | 13 |
| Благоприятная ведомственная (например, командная) динамика | 7,7 | 5 | 11. 4 4 | 14 |
| Относительное количество одного предмета над другим (т. Е. Предметы с большим или меньшим приоритетом этикеток) | 9,9 | 14 | 12,1 | 15 |
| Внешнее давление со стороны СМИ, общественности, или политиками (например, возникновение неблагоприятного события, освещаемого в СМИ; давление со стороны социальных сетей и СМИ) | 13,6 | 16 | 13,0 | 16 |
ОБСУЖДЕНИЕ
Большинство из 8 команд менеджеров аптек, участвовавших в Имитационное упражнение было направлено на предоставление широкого спектра услуг, но с низким уровнем полноты. Большинство (6 из 8 команд) включили более двух третей из 32 возможных фармацевтических видов деятельности и услуг в свои решения по расстановке приоритетов. В сложном мире здравоохранения руководители аптек могут испытывать давление с целью предоставления широкого спектра услуг, ориентированных на отдельных наиболее нуждающихся пациентов. Например, фармацевты могут предоставлять услуги по согласованию приема лекарств, но только избранным пациентам из группы высокого риска. Две другие команды, похоже, приняли решение сосредоточиться на меньшем количестве видов деятельности и услуг и направить свои ресурсы на предоставление более комплексных услуг в этих областях.
Большинство (6 из 8 команд) включили более двух третей из 32 возможных фармацевтических видов деятельности и услуг в свои решения по расстановке приоритетов. В сложном мире здравоохранения руководители аптек могут испытывать давление с целью предоставления широкого спектра услуг, ориентированных на отдельных наиболее нуждающихся пациентов. Например, фармацевты могут предоставлять услуги по согласованию приема лекарств, но только избранным пациентам из группы высокого риска. Две другие команды, похоже, приняли решение сосредоточиться на меньшем количестве видов деятельности и услуг и направить свои ресурсы на предоставление более комплексных услуг в этих областях.
Относительный вес для видов деятельности и услуг варьировался от 5% для исследований до 34% для клинических услуг (). Интересно, что команды отдали приоритет большему количеству клинических мероприятий (диапазон от 24% до 49% от общего количества баллов), чем мероприятиям по распределению лекарств (диапазон от 14% до 37% от общего количества баллов).
Хотя относительные веса, приписываемые каждой области фармацевтической практики, можно считать согласованными, наблюдались большие различия в охвате отдельных видов деятельности или услуг каждой командой ().Среди других наблюдений было отмечено, что руководители аптек уделяют первоочередное внимание управлению человеческими ресурсами (все команды покрывают 100% потребностей в этой области) и финансовому менеджменту. Удивительно, но 3 команды решили покрыть 50% «других управленческих потребностей», даже несмотря на то, что многие потребности в аптечных услугах не были приоритетными для этих команд. Приоритизация потребностей руководства может просто отражать приоритет, который менеджеры придают своим собственным потребностям, или может отражать желание иметь ресурсы, доступные для решения непредсказуемых проблем, которые неизбежно возникают в большинстве отделов аптек.Другие виды деятельности, которым не уделялось должного внимания, включали оригинальные исследования, проведенные сотрудниками фармацевтического отдела, обучение внешних групп и оказание поддержки клиническим испытаниям. Вызывает беспокойство то, что руководители аптек уделяют мало внимания практическому обучению студентов бакалавриата.
Вызывает беспокойство то, что руководители аптек уделяют мало внимания практическому обучению студентов бакалавриата.
В отчете больничной аптеки в Канаде за 2009/2010 гг. Бюссьер отметил, что большинство клинических мероприятий, получивших высокий приоритет от респондентов, были теми, для которых мало доказательств, подтверждающих их экономическую или клиническую ценность. 9 Это экспериментальное исследование с моделированием выявило ряд факторов, которые повлияли на расстановку приоритетов отдельных лиц и команд. Интересно, что участники оценили «восприятие благоприятного воздействия деятельности или услуги» выше, чем «убедительные доказательства» в поддержку деятельности или услуги. Возможно, пора руководителям аптек изучить и подтвердить свое восприятие ценности различных видов деятельности и услуг, если они действительно хотят утверждать, что аптека — это профессия, основанная на доказательствах.3 наиболее важных фактора в этом упражнении по приоритизации были схожими для индивидуальных и групповых рейтингов: «восприятие благоприятного воздействия деятельности или услуги на безопасное оказание медицинской помощи», «восприятие благоприятного влияния деятельности или услуги на результаты в отношении здоровья» и « убедительные доказательства, доступные для поддержки решений ». Тем не менее, некоторые факторы, такие как «требуемые для проведения аудитов или инспекций», получили низкую оценку отдельными лицами (12-е место), но были оценены группами выше (5-е место). И наоборот, «благоприятная ведомственная динамика» высоко оценивалась отдельными лицами (5-е место), но низкой — командами (14-е место).
Корреляция между индивидуальным и командным рейтингом сильно различалась, при этом коэффициент корреляции варьировался от 0,909 ( p <0,001) для команды E до 0,215 ( p = 0,42) для команды D. Это, вероятно, отражает уровень влияния, которое назначенный лидер для каждой команды был в рейтинге. Отрицательная связь была обнаружена для команды F (коэффициент корреляции -0,521, p = 0,039), что указывает на сильного лидера с совершенно другим рейтингом, чем индивидуальные рейтинги членов его команды.
Это упражнение по моделированию имело несколько ограничений. Участникам был предоставлен ограниченный период времени (30 минут) для принятия решений, и моделирование проводилось вечером после ужина. Были даны ограниченные инструкции о характере моделируемой больницы, ее программах ухода и объемах ее работы. Участникам было предложено ранжировать все 16 указанных факторов, хотя некоторые респонденты устно указали, что, по их мнению, некоторые из факторов не повлияли на их решения по расстановке приоритетов.Выбор фармацевтической деятельности и разбивка покрытия основывались на знаниях исследовательской группы о практике больничных аптек, но этот выбор, тем не менее, был в некоторой степени произвольным и, несомненно, открытым для обсуждения. Степень покрытия внутри домена не рассчитывалась. Хотя результаты этого моделирования описывают приоритеты конкретной группы руководителей аптек в Канаде, демографические данные не были собраны для описания выборки руководителей аптек, которые участвовали; поэтому обобщение на всех лидеров канадских аптек невозможно.
ВЫВОДЫ
Это исследование продемонстрировало использование имитационного упражнения для изучения того, как менеджеры больничных аптек принимают решения о приоритезации. Результаты этого моделирования подтверждают наблюдение, что руководители аптек не согласны с основным набором фармацевтических видов деятельности, которые должны иметь приоритет. Большинство из 8 команд, участвовавших в моделировании, предпочли предоставить широкий спектр услуг, но с низким уровнем полноты.
Ссылки
1. Pearson GJ. Эволюция в фармацевтической практике — не революция! CMAJ.2007. 176 (9): 1295–1296. DOI: 10.1503 / cmaj.070041. [PubMed] [CrossRef] [Google Scholar] 2. Голландия RW, Nimmo CM. Переходы, часть 1: За пределами фармацевтической помощи. Am J Health Syst Pharm. 1999. 56 (17): 1758–1764. [PubMed] [Google Scholar] 3. Abramowitz PW. Эволюция и метаморфозы модели аптечной практики. Am J Health Syst Pharm. 2009. 66 (16): 1437–1446. DOI: 10.2146 / ajhp0. [PubMed] [CrossRef] [Google Scholar] 4. Bond CA, Raehl CL. Услуги клинических аптек, укомплектование аптек и показатели больничной смертности.Фармакотерапия. 2007. 27 (4): 481–493. DOI: 10.1592 / phco.27.4.481. [PubMed] [CrossRef] [Google Scholar] 5. Пикард А.С., Хунг С.Ю. Обновленные данные о влиянии услуг клинической аптеки на качество жизни, связанное со здоровьем. Энн Фармакотер. 2006. 40 (9): 1623–1634. DOI: 10.1345 / аф.1G653. [PubMed] [CrossRef] [Google Scholar] 6. Каболи П.Дж., Хот AB, МакКлимон Б.Дж., Шниппер Дж.Л. Клинические фармацевты и стационарное лечение: систематический обзор. Arch Intern Med. 2006. 166 (9): 955–964. DOI: 10.1001 / archinte.166.9.955. [PubMed] [CrossRef] [Google Scholar] 7. Чизхолм-Бернс М.А., Графф Зивин Дж. С., Ли Дж. К., Спайви К. А., Слэк М., Херриер Р. Н. и др. Экономическое влияние фармацевтов на состояние здоровья в США: систематический обзор. Am J Health Syst Pharm. 2010. 67 (19): 1624–1634. DOI: 10.2146 / ajhp100077. [PubMed] [CrossRef] [Google Scholar] 8. Эллитт Г.Р., Брайен Дж.А., Аслани П., Чен Т.Ф. Качественная помощь пациентам и роль фармацевтов в ее непрерывности — систематический обзор. Энн Фармакотер. 2009. 43 (4): 677–691. DOI: 10.1345 / аф.1L505. [PubMed] [CrossRef] [Google Scholar]на защите цепочек поставок фармацевтических препаратов в глобальной экономике — 30.10.2019
ВведениеГоспожа председатель, член рейтинга Берджесс и члены подкомитета, я доктор Джанет Вудкок, директор Центра оценки и исследований лекарственных средств (CDER) Управления по контролю за продуктами и лекарствами (FDA или Агентство), который является частью Департамент здравоохранения и социальных служб (HHS).
Соединенные Штаты, вкладывая средства в биомедицинские исследования, стали мировым лидером в области открытия и разработки лекарств, но уже не в авангарде производства лекарств. Исторически сложилось так, что производство лекарств для населения США осуществлялось внутри страны. Однако в последние десятилетия производство лекарств постепенно покинуло Соединенные Штаты. Это особенно верно для производителей активных фармацевтических ингредиентов (АФИ), настоящих лекарств, которые затем формулируются в виде таблеток, капсул, инъекций и т. Д.По состоянию на август 2019 года только 28 процентов производственных мощностей, производящих API-интерфейсы для поставок на рынок США, находились в нашей стране. Напротив, оставшиеся 72 процента производителей API, поставляющих на рынок США, были за границей, а 13 процентов — в Китае. (См. Рис. 1) Данные FDA показывают, что количество зарегистрированных предприятий, производящих API-интерфейсы в Китае, более чем удвоилось в период с 2010 по 2019 год.
Рисунок 1: Производственные площадки API для рынка США по странам или регионам,
Август 2019
Несмотря на то, что есть много причин для этого сдвига, основные факторы, которые часто упоминаются, включают тот факт, что для большинства традиционных процессов производства лекарств требуется крупная фабрика, часто возникает экологическая ответственность и может использоваться дешевая рабочая сила.В отчете Всемирного банка 2009 года «Исследовательское исследование производства активных фармацевтических ингредиентов для основных лекарственных средств» говорится, что если средняя заработная плата типичной западной компании, производящей АФС, составляет 100, то для китайской компании этот показатель составляет всего 8 и 10 для индийской компании. [1] В Китае более низкие затраты на электроэнергию, уголь и воду. Китайские фирмы также интегрированы в сеть поставщиков сырья и посредников, поэтому у них более низкие затраты на доставку и транзакционные издержки на сырье. Они также сталкиваются с меньшим количеством экологических норм в отношении покупки, обращения и утилизации токсичных химикатов, что приводит к снижению прямых затрат для этих фирм.В отчете FDA за 2011 год «Путь к глобальной безопасности и качеству продукции» отмечается, что и Китай, и Индия имеют преимущество в стоимости рабочей силы и что производство АФИ в Индии может снизить затраты для американских и европейских компаний примерно на 30-40 процентов [2]. ]
Используя традиционные фармацевтические производственные технологии, американская компания никогда не сможет компенсировать трудовые и другие преимущества Китая, просто добившись более высокой производительности. Однако FDA считает, что передовые производственные технологии могут позволить U.Фармацевтическое производство на базе С., чтобы восстановить свою конкурентоспособность с Китаем и другими зарубежными странами и потенциально обеспечить стабильные поставки лекарств, критически важных для здоровья пациентов в США. Передовое производство — это собирательный термин для новых технологий производства медицинских продуктов, которые могут улучшить качество лекарств, решить проблему нехватки лекарств и ускорить вывод на рынок. Каждое месторождение имеет свой набор производственных технологий, которые считаются передовыми. Примеры некоторых сквозных передовых производственных технологий включают непрерывное производство и 3D-печать.Передовые производственные технологии, которые FDA поддерживает в рамках своей программы Emerging Technology Program (ETP), имеют меньшую площадь основания, меньшее воздействие на окружающую среду и более эффективное использование человеческих ресурсов, чем традиционные технологии, как будет объяснено позже в этом свидетельстве.
Фармацевтический сектор в значительной степени полагается на иностранные источники критических компонентов, материалов и готовой продукции, как указано в отчете Управления оценки технологий Министерства торговли США за 2011 год «Использование иностранных источников в секторе здравоохранения и общественного здравоохранения (HPH): Фармацевтические препараты, медицинские приборы и хирургическое оборудование.[3] Однако использование материалов из иностранных источников создает уязвимость для поставок лекарств в США. Например, в августе 2018 года FDA выпустило предупреждение о том, что китайский производитель API, Sichuan Friendly Pharmaceutical Co. Limited, отозвал определенные партии свиного тироидного API из-за несовместимого качества API. [4] Этот тироидный API получают из свиной (свиньи) щитовидной железы и используют для изготовления лекарства для лечения гипотиреоза (недостаточной активности щитовидной железы). Лабораторные испытания FDA подтвердили, что Sichuan Friendly API имеет непоследовательные уровни активных ингредиентов и не должен использоваться для производства или составления лекарств для использования пациентами.Риски, связанные с чрезмерным или недостаточным лечением гипотиреоза, могут привести к необратимым или опасным для жизни неблагоприятным последствиям для здоровья.
В декабре 2015 года FDA предупредило производителей лекарственных средств, что некоторые партии баклофенового API, производимого китайским производителем Taizhou Xinyou Pharmaceutical & Chemical Co., Limited, могут быть подвержены риску загрязнения твердыми частицами и не должны использоваться для приготовления стерильных инъекционных препаратов. Taizhou производит API для переупаковщиков и дистрибьюторов, некоторые из которых продают эти продукты предприятиям по производству смесей в Соединенных Штатах.[5]
АгентствоFDA связывалось с Тайчжоу, и компания подтвердила, что из-за уровня контроля в производственном процессе производимый им баклофен API не подходит для использования в инъекционных препаратах. FDA рекомендовало не использовать API баклофена из Тайчжоу для производства или приготовления каких-либо инъекционных препаратов. Затронутый АФИ потенциально мог представлять серьезную угрозу безопасности для пациентов из США, которые использовали или получали инъекционные лекарственные препараты, смешанные с пораженным баклофеном, особенно при введении непосредственно в позвоночник (интратекально).Также существовал потенциальный риск того, что баклофен API мог быть загрязнен эндотоксином или микроорганизмами.
Сегодня я хотел бы поделиться информацией CDER о расположении производственных мощностей API в Китае, США и остальном мире; обсудить последствия для национальной безопасности; и объясните, как передовое производство может повысить безопасность и надежность поставок лекарств в США.
Объяснение данных CDER и их ограниченийС точки зрения национальной безопасности полезно посмотреть на расположение пунктов хранения трех наборов лекарств:
- Все наркотики на U.S. market, в том числе брендовые и генерические препараты, заявленные в соответствии с утвержденными заявками, лекарства, отпускаемые без рецепта (OTC), и комбинированные лекарства.
- Лекарства из Списка основных лекарственных средств Всемирной организации здравоохранения (ВОЗ), которые продаются в США.
- Наркотики, включенные в списки медицинских средств противодействия (MCM). К ним относятся лекарства, которые мы будем использовать для противодействия биологическим, химическим, ядерным или радиационным угрозам и гриппу.
CDER ведет каталог сайтов («Каталог») всех производственных предприятий, производящих лекарства для США.S. market, либо через одобренное приложение, либо зарегистрированные и зарегистрированные для поставки лекарств на рынок США. Сюда входят поставщики API, готовых лекарственных форм (FDF) или того и другого. АФИ, производимые на этих предприятиях, могут использоваться в рецептурных лекарствах (фирменных или непатентованных), безрецептурных лекарствах и комбинированных лекарствах.
Данные, доступные для CDER, имеют несколько ограничений, в том числе следующие:
- Объекты, перечисленные в Каталоге, могут производить или не производить API.Включение объекта в приложение или процесс регистрации и листинга не требует наличия средства для производства API. Производить API на предприятии или не производить его — это бизнес-решение, принимаемое компанией.
- Производители не обязаны сообщать FDA, действительно ли они производят API на предприятии, а если да, то объемы, которые они производят. API-интерфейсы
- , изготовленные на перечисленных предприятиях, могут использоваться в лекарствах как для США, так и для других рынков, а некоторые API-интерфейсы, распространяемые в Соединенных Штатах, впоследствии превращаются в FDF, которые затем экспортируются.
- В некоторых приложениях FDF указано несколько поставщиков API в приложении. FDA не знает, какого поставщика API использует производитель FDF в любой момент времени.
- CDER имеет ограниченную информацию о поставщиках API для продуктов, которые не нуждаются в утвержденной заявке от FDA для продажи, например, комбинированных и безрецептурных монографических препаратов. Поставщики API для таких продуктов не могут зарегистрировать свое предприятие в FDA, если они отправляют материал производителю лекарственного препарата за пределами Соединенных Штатов для изготовления FDF, который затем продается в Соединенных Штатах.
- Информация в каталоге постоянно обновляется. Представленный ниже анализ основан на листингах за август 2019 года и представляет собой моментальный снимок на определенный момент времени.
Эти ограничения означают, что, хотя CDER может описывать расположение производственных мощностей API, мы не можем определить с какой-либо точностью объем API, который фактически производит Китай, или объем API, производимых в Китае, который выходит на рынок США, либо прямо или косвенно путем включения в готовые дозировки, производимые в Китае или других частях мира.
Производственные мощности API для всех регулируемых лекарственных препаратов
АнализCDER показывает, что в целом Китай имеет лишь небольшой процент предприятий, способных производить API для рынка США. Что касается всех регулируемых лекарств, то у Китая есть 230 (13 процентов) производственных мощностей по производству API, в то время как в Соединенных Штатах — 510 (28 процентов), а в остальном мире — 1048 (59 процентов). «Все регулируемые препараты» включают рецептурные (фирменные и непатентованные), безрецептурные и комбинированные препараты. (См. Рис. 2) Однако процентное содержание API, производимых на этих предприятиях, может отличаться и, как упоминалось выше, не может быть определено на основе данных, доступных FDA.
Рисунок 2: Количество и процент производственных мощностей API для всех лекарственных средств по регионам, август 2019 г.
Производственные мощности по API для основных лекарственных средств ВОЗ на рынке США
Список основных лекарственных средств ВОЗ 2019 г. включает 461 лекарственный препарат, который был отобран Комитетом экспертов ВОЗ для удовлетворения наиболее важных потребностей системы здравоохранения.В этот список входят продукты для применения и без применения в широком спектре терапевтических категорий, таких как анестезирующие, антибактериальные, антидепрессанты, противовирусные, сердечно-сосудистые, антидиабетические и желудочно-кишечные агенты.
FDA сопоставило 370 лекарств из Списка основных лекарственных средств ВОЗ с продуктами, перечисленными для рынка США, и определило местоположение предприятий, используемых для производства их API. [6] Данные FDA показывают, что в мире насчитывается 1079 предприятий API, которые составляют 370 препаратов из списка ВОЗ, которые продаются в США.S. Из них 166 (15%) находятся в Китае, 221 (21%) — в США, а 687 (64%) — в остальном мире. (см. Рисунок 3)
Рисунок 3: Количество и процент предприятий API для 370 лекарственных препаратов, продаваемых в США, в Списке основных лекарственных средств ВОЗ 2019 года
FDA определило, что существует три основных лекарственных средства ВОЗ, производители API которых базируются только в Китае. Эти три лекарства: капреомицин и стрептомицин, оба показаны для лечения Mycobacterium tuberculosis; и сульфадиазин, используемый для лечения шанкроида и трахомы.
Распределение средств API по всему миру варьируется от лекарства к лекарству и может отличаться от структуры для всех лекарств или лекарств из Списка основных лекарственных средств ВОЗ.
Производственные мощности API для медицинских средств противодействия
FDA ведет список лекарств, которые используются в качестве медицинских контрмер (MCM) против угроз в четырех категориях: биологические угрозы, химические угрозы, грипп и радиационные угрозы. Многие из этих лекарств содержатся в стратегических запасах лекарств, в том числе в Национальном стратегическом национальном запасе, крупнейшем в стране запасе потенциально жизненно важных фармацевтических препаратов и предметов медицинского назначения для использования в чрезвычайных ситуациях в области общественного здравоохранения, которые настолько серьезны, что могут закончиться местные запасы.
Что касается API-интерфейсов для 14 лекарств, относящихся к категории биологической угрозы, в Китае имеется 37 предприятий, в США — 19, а в остальном мире — 117. В Китае есть только шесть предприятий, производящих API для 10 лекарств в категории химической опасности. по сравнению с 24 в США и 52 в остальном мире. (см. Таблицу 1)
| MCM Тип (# продукты) | Сайты API в США # (%) | Китайские сайты API # (%) | Другие зарубежные сайты API # (%) |
|---|---|---|---|
| Биологический (14) | 19 (11%) | 37 921% | 117 (68%) |
| Химическая промышленность (10) | 24 (29%) | 6 (7%) | 52 (64%) |
| Грипп (3) | 2 (11%) | 0 (0%) | 16 (89%) |
| Излучение (7) | 13 (46%) | 0 (0%) | 15 (54%) |
Таблица 1: Количество и процент производственных площадок API для лекарств MCM для использования против биологических, химических и радиационных угроз и гриппа, август 2019 г.
В Китае нет ни одного предприятия, производящего АФИ для лекарств для профилактики или лечения гриппа, по сравнению с двумя в США и 16 в остальном мире.В Китае также нет предприятий, производящих АФИ для радиационных угроз. В США 13 таких объектов по сравнению с 15 в остальном мире.
Ципрофлоксацин и доксициклин — два препарата, которые считаются критически важными в качестве MCM и используются для лечения сибирской язвы и чумы. Как показано в Таблице 2 ниже, в Соединенных Штатах есть одно предприятие по производству ципрофлоксацина по сравнению с тремя в Китае и 21 в других зарубежных странах. В Соединенных Штатах меньше предприятий по производству доксициклина, чем в Китае или других зарубежных странах. (см. Таблицу 2)
| MCM | # (%) Сайты API США | # (%) Китайские сайты API | # (%) Другие зарубежные сайты API |
|---|---|---|---|
| Ципрофлоксацин | 1 (4%) | 3 (12%) | 21 (84%) |
| Доксициклин | 2 (18%) | 3 (27%) | 6 (55%) |
Таблица 2: Количество и процент производственных площадок API для ципрофлоксацина и доксициклина по регионам, август 2019 г.
Последствия для национальной безопасности
Безопасность поставок лекарств в страну основывается на трех основных факторах: свободе от зависимости от иностранных источников API, устойчивости нашей отечественной производственной базы и надежности предприятий, которые производят продукцию для США.С. рынок.
Зависимость : Насколько мы зависим от Китая, Индии или других стран в отношении API-интерфейсов, используемых в лекарствах, производимых для пациентов в США? Как эта зависимость изменилась со временем?
Число китайских предприятий, производящих АФИ для рынка США, увеличилось за последнее десятилетие в рамках массового перемещения фармацевтического производства за рубеж. Это движение вызвано стремлением фармацевтической промышленности к экономии и менее строгим экологическим нормам.FDA считает, что при отсутствии какого-либо вмешательства эта тенденция, вероятно, сохранится.
Однако данные, доступные FDA, не позволяют нам рассчитать объем API-интерфейсов, используемых для продаваемых в США лекарств из Китая или Индии, и какой процент потребления лекарств в США это составляет. Как упоминалось выше, мы не знаем, действительно ли китайские предприятия производят API-интерфейсы, в каком объеме они производят или где производимые ими API-интерфейсы распространяются по всему миру, в том числе в Соединенных Штатах.
Устойчивость: Насколько устойчива производственная база США? Насколько быстро производители из США могут увеличить производство АФИ для удовлетворения внутреннего спроса, если Китай, Индия или другая страна прекратят поставки в Соединенные Штаты, особенно для лекарств, включенных в список основных лекарственных средств ВОЗ или подгруппу, широко используемую в США? численность населения?
Чтобы ответить на этот вопрос, FDA должно знать:
- сколько неиспользуемой емкости существует в U.S. производственная база для API;
- , сколько дополнительных API эта мощность может предоставить в течение заданного периода времени;
- насколько далеко зайдет эта мощность в заполнении разрыва между потребностями пациентов в США и доступной суммой, если Китай, Индия или другая страна сократят или прекратят поставки на рынок США; и
- сколько времени потребуется, чтобы увеличить производство до уровня, достаточного для удовлетворения потребностей пациентов, и будут ли финансовые вложения приемлемыми для фармацевтической промышленности.
Поскольку в настоящее время мы не знаем, действительно ли предприятия по производству АФИ производят это лекарство, в каком объеме или какая часть потребления наркотиков в США зависит от АФИ из Китая, Индии или другой страны, мы не можем провести надежный анализ пробелов. .
Даже если бы мы могли оценить потенциальный дефицит API и доступные производственные мощности, фармацевтические компании принимают бизнес-решения о том, производить ли лекарственный продукт, включая API, а FDA не имеет права указывать им, чтобы они производили лекарство.Это создает дополнительную неопределенность при оценке потенциальной реакции производственной базы США на кризис, вызванный уходом другой страны.
Надежность: Насколько надежна производственная база, производящая API-интерфейсы для рынка США?
FDA недавно проанализировало 163 препарата, дефицит которых возник в течение пятилетнего периода с 2013 по 2017 год, и обнаружил, что проблемы с качеством были причиной дефицита в 62 процентах случаев. [7] Эта нехватка может ухудшить состояние здоровья пациентов, вызывая задержки в лечении или изменения схем лечения, таких как замена менее эффективных или хорошо переносимых лекарств, когда лекарство выбора недоступно.
В поисках способов обеспечить доступ американцев к запасам безопасных и эффективных лекарств, мы должны учитывать все три аспекта проблемы.
Краткое изложение выводов национальной безопасности
ИнформацияFDA показывает, что в целом количество заводов API в Китае несколько меньше, чем в Соединенных Штатах, но сопоставимо по размеру и растет. Однако из-за ограниченности доступных данных мы не можем оценить степень зависимости США от Китая. Например, у нас нет информации об объемах API, производимых в Китае или даже в Соединенных Штатах, или о том, какая часть выходных данных API в Китае достигает U.Рынок С. через другие страны.
Точно так же у нас нет информации, которая позволила бы нам оценить устойчивость производственной базы США, если она будет проверена отказом Китая от поставок на рынок США. Мы действительно знаем, что поставки лекарств в США находятся под угрозой из-за нехватки лекарств, в большинстве случаев вызванной проблемами качества производства как у американских, так и у иностранных производителей.
Advanced Manufacturing предлагает многомерное решение
Передовое производство — это использование инновационных технологий для улучшения продуктов и процессов.Хотя современные технологии широко используются в некоторых других отраслях, таких как автомобилестроение, авиакосмическая промышленность и производство полупроводников, фармацевтические компании только начинают их использовать. Для производства API и / или FDF новые технологии включают «непрерывное производство» (CM), при котором готовый лекарственный продукт производится в виде непрерывного потока, в отличие от традиционного серийного производства, когда между различными этапами обработки существуют перерывы или остановки. В некоторых примерах передового фармацевтического производства производство может быть непрерывным, от химического синтеза активного ингредиента до производства таблеток или других лекарственных форм.
Передовое производство предлагает множество преимуществ по сравнению с традиционным фармацевтическим производством, и, если Соединенные Штаты инвестируют в эту технологию, его можно использовать для уменьшения зависимости страны от иностранных источников API, повышения устойчивости нашей отечественной производственной базы и уменьшения проблем с качеством, которые вызвать дефицит или отзыв лекарств. Например:
- Качество продукции можно точно контролировать с помощью современных систем автоматизации и управления, а во время производства можно тщательно контролировать с помощью аналитики с высоким разрешением.
- Высокотехнологичные производственные мощности с компьютерным управлением лучше способны быстро реагировать на изменения спроса, поскольку они, как правило, не имеют проблем с масштабированием оборудования, связанных с традиционными методами, и могут беспрепятственно производить различные дозировки и даже лекарственные формы .
- Усовершенствованные производственные платформы также занимают гораздо меньшую площадь, чем традиционные производственные платформы, а оборудование можно сделать портативным, чтобы его можно было перемещать ближе к рынкам, что снижает потребность в трансконтинентальных перевозках компонентов.
- Лекарства можно производить дешевле, чем традиционными методами.
- Значительно снижено воздействие производства на окружающую среду.
Поддерживая рост передового производства в Соединенных Штатах, мы можем уменьшить нашу зависимость от Китая и других зарубежных производителей API, а также повысить устойчивость и оперативность нашей производственной базы и сократить дефицит лекарств.
Инициатива передового производства FDA способствует этому росту несколькими способами.
Программа новых технологий (ETP)
ETP, запущенный в конце 2014 года, поощряет и поддерживает внедрение инновационных технологий для модернизации фармацевтических разработок и производства посредством тесного сотрудничества с промышленностью и другими соответствующими заинтересованными сторонами, начиная с ранней разработки технологий.
Чтобы уменьшить барьеры для выхода на рынок передового производства, группа по новым технологиям (ETT) предоставляет возможность для раннего (до подачи заявки) обсуждения инновационных технологий и подходов, даже до того, как будет определен лекарственный препарат-кандидат.ETT поддерживает ввод, оценку и управление жизненным циклом передового производства в CDER. Он предоставляет экспертов в предметной области и способствует координации внутри CDER и Управления нормативно-правового регулирования FDA (ORA) по вопросам создания прецедентов, касающихся качества и надлежащей производственной практики. ЕТТ служит центром определения регулирующих и исследовательских потребностей, связанных с конкретными приложениями, и обеспечивает стратегический вклад в поддержку передовых производственных инноваций. Основываясь на усилиях ETT по непрерывному производству, Управление фармацевтического качества CDER (OPQ) в начале 2019 года опубликовало проект руководства «Соображения по качеству при непрерывном производстве» твердых пероральных лекарственных форм.[8]
В рамках этой программы CDER одобрил пять приложений для лекарственных препаратов, использующих непрерывное производство для производства FDF, и первое приложение, использующее технологии трехмерной печати. В настоящее время эти препараты производятся в Соединенных Штатах, а один препарат производится как в Соединенных Штатах, так и в Великобритании.
Регулирующие и политические инициативы
Внедрение передовых производственных технологий может стать проблемой для действующей нормативной базы, поскольку большинство нормативных документов были разработаны на основе традиционных методов серийного производства в рамках единой фармацевтической системы качества.В результате FDA предприняло усилия по выявлению и внедрению необходимых изменений в нормативную структуру. Например, новые политические и нормативные темы, связанные с новыми технологиями, включают управление средами с большим количеством данных, развивающиеся концепции валидации процессов для передовых производственных систем и регулирующий надзор за изменениями таких систем после утверждения. Кроме того, CDER в сотрудничестве с Управлением передовых биомедицинских исследований и разработок (BARDA) работает над стратегией и новой нормативно-правовой базой для разработки и внедрения миниатюрных мобильных производственных платформ («Аптека по запросу») для производства основных лекарственных средств рядом или в момент ухода.
FDA активно взаимодействует с заинтересованными сторонами в промышленности, научных кругах и других регулирующих органах для выявления и устранения нормативных препятствий на пути внедрения передового производства. Например, CDER в партнерстве с Центром оценки и исследований биологических препаратов (CBER) FDA возглавляет усилия Международного совета по гармонизации технических требований к фармацевтическим препаратам для человека (ICH) по разработке руководства Q13 по непрерывному производству лекарственных субстанций и лекарственных препаратов. лекарственные препараты как для низкомолекулярных, так и для биологических продуктов, которые помогут достичь глобальной регуляционной гармонизации.
Очное и заочное обучение
Лабораториив OPQ CDER активно проводят передовые производственные исследования и инвестируют в оборудование, помещения и персонал, обладающий опытом для исследования этих тем. OPQ учредила Центр передового опыта в области производственных наук и инноваций для координации внутренних достижений в области производственных исследований как малых молекул, так и биопрепаратов. OPQ публикует и проводит исследования в области непрерывного производства, расширенной аналитики для управления процессами, а также моделирования и симуляции.OPQ также проводит обучение персонала, занимающегося оценкой и инспекцией.
Заочно OPQ предоставляет исследовательские гранты и контракты для передового производства и новых технологий. OPQ также участвует в консорциумах с академическими кругами и промышленностью, чтобы определить новые области для исследований в области передового производства. Участие в этих очных и заочных исследованиях происходит при тесном согласовании и координации между отделами оценки, политики и надзора. Это обеспечивает выделение ресурсов на проекты, которые обеспечивают практические подходы к регулированию инновационных технологий.
От имени FDA я хотел бы поблагодарить Конгресс за дальновидность и предоставление ресурсов для поддержки наших усилий по оказанию помощи фармацевтической промышленности в процессе перехода от традиционных методов производства к использованию передовых технологий. Эти новые инструменты и методы могут оживить нашу фармацевтическую производственную базу и репатриировать ее из-за границы. Это поможет обеспечить американцам безопасные и надежные поставки лекарств в будущем, а также внесет свой вклад в нашу экономику.
Содействие развитию отечественного производства
В 19 финансовом году Конгресс утвердил ассигнования на развитие отечественного производства с намерением, чтобы FDA продвигало современные технологии лекарств и биологических продуктов. План расходов на эти дополнительные ресурсы основан на стратегических целях CDER по улучшению общего понимания и опыта сотрудников в области передового производства за счет расширения поддержки этих инновационных технологий в оценке, политике, надзоре и исследованиях, а также путем внесения программных улучшений.Кроме того, это финансирование используется для усиления внешних контактов с заинтересованными сторонами посредством запланированных мероприятий по прогнозированию технологий с Национальными академиями наук, инженерии и медицины и другими форумами.
Заключение
Растущее число предприятий по производству API в Китае и других странах говорит о том, что зависимость США от китайских и других зарубежных источников API растет. FDA усердно работает в сотрудничестве с промышленностью и другими федеральными агентствами, чтобы гарантировать, что наша зависимость от иностранного производства не представляет угрозы для национальной безопасности.Хотя FDA не может сообщать промышленности, где они могут и не могут производить API, мы можем работать с промышленностью, чтобы использовать новые технологии и новые методы производства для дальнейшего стимулирования внутреннего производства лекарств и API. Эти новые способы производства лекарств при правильной стратегии могут оживить фармацевтическое производство в Соединенных Штатах.
Сноски
6. Некоторые из 461 лекарства из Списка основных лекарственных средств ВОЗ 2019 года были исключены из анализа, поскольку они не регулируются CDER.Список включает продукты, регулируемые Центром оценки и исследований биологических препаратов (CBER), такие как вакцина против холеры и иммуноглобулин против бешенства, а также продукты, регулируемые Центром устройств и радиологического здоровья (CDRH), такие как диафрагмы и презервативы.
7. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США, «Нехватка лекарств: основные причины и возможные решения», октябрь 2019 г.
Влияние вовлеченности фармацевтических компаний на решение о назначении: пилотный опрос врачей, назначающих лекарства для лечения редких заболеваний в Великобритании работать в области терапии ЛАГ в Великобритании.
Результаты этого опроса показывают, что рекламная деятельность по личному взаимодействию все еще может иметь место в составе фармацевтической промо-смеси, поскольку ее влияние на привычки назначения лекарств оценивается в среднем выше нуля. Однако, несмотря на то, что это их основная цель, рекламные мероприятия по личному взаимодействию оказали меньшее влияние на поведение лиц, назначающих лекарства, чем неличные и не связанные с рекламой личные действия (рис. 1).
В целом, лица, выписывающие рецепты, оценили личные действия, не связанные с рекламой, как имеющие гораздо большее влияние на их привычки назначать лекарства, чем личные мероприятия по продвижению; это согласуется с переходом населения к привычкам назначения рецептов, основанным на фактических данных.Вывод о том, что влияние этих действий на привычки выписывать рецепты было оценено выше влияния традиционных личных поощрений, действительно вызывает ряд интересных вопросов. Например, поскольку медицинский отдел и отдел продаж фармацевтических компаний обращаются к одной и той же группе людей, и медицинский отдел может участвовать в гораздо более широком обсуждении лекарств компании (и медицинского плана, составляющего RWE в целом), более сильное влияние их непродвиженческих обязательств ставит под сомнение современную полезность специализированных продавцов.Более того, при рассмотрении более широкого взгляда на фармацевтическую промышленность, одноранговые дискуссии о новых лекарствах, основанные на фактических данных, могут рассматриваться как более надежный источник информации, чем тот, который предоставляется торговым представителем; это особенно важно для отрасли, репутация которой в последнее время могла быть запятнана в глазах как медицинских работников, так и населения в целом. Также может быть полезным то, что врачи-фармацевты медицинского отдела компании, вероятно, участвовали в большей части жизненного цикла продукта, от начальных исследований и разработок, через клинические исследования до исследований по созданию RWE и исследований фазы IV; Надежные и постоянно развивающиеся научные знания этих врачей могут оказаться очень полезными на протяжении всего срока службы продукта.
Было замечено, что личное влияние, не связанное с рекламой, было выше для нового препарата в исследовании. Это может отражать реальность того факта, что на ранних этапах жизненного цикла продукта надежных и высококачественных внешних источников информации может быть недостаточно, что делает врачей компании ключевым контактным лицом для предоставления доказательной поддержки при принятии решений о назначении лекарств заранее. к развитию более широкого опыта работы с новым продуктом. Еще больше это применимо в контексте редких заболеваний, когда многие лекарства перепрофилируются и / или используются не по назначению; Глубокие научные знания врачей-фармацевтов о продуктах, в том числе в таких областях, как механизмы действия продукта, будут неоценимы в таких ситуациях [16].Тем не менее, преднамеренное использование не рекламных мероприятий с маркетинговыми целями действительно существует, что поднимает сложные этические вопросы о роли ключевых лидеров мнений и потенциальных конфликтах интересов на протяжении всего жизненного цикла препарата [6, 8].
Возможно, неудивительно, что деятельность неличного характера, по-видимому, оказала наибольшее влияние на поведение при назначении лекарств, что подчеркивает важность легкодоступных высококачественных внешних источников информации для лиц, назначающих лекарства. Хотя эта деятельность по своей природе воспринимается как внешняя по отношению к фармацевтической компании, результаты этого исследования подчеркивают необходимость того, чтобы фармацевтические компании знали о внешних факторах и обсуждениях, которые могут продолжаться вокруг их продуктов.Это особенно важно в эпоху мгновенного распространения информации и коммуникации, увеличения индивидуального участия в оказании помощи и социальных сетях, и все это может иметь существенное влияние на потребление и использование лекарственного препарата. Кроме того, разумное использование медицинского отдела вместе с группами привлеченных медицинских работников при разработке, внедрении и предоставлении медицинского плана RWE, кульминацией которого является создание портфеля ключевых публикаций, будет использовать наблюдаемое повышенное влияние рецензируемых статей на принятие решений. изготовление.Эта тактика использовала бы синергию между личным участием, не связанным с рекламой, и участием не личного характера.
Это исследование имеет ряд ограничений. Выборочная совокупность не была выбрана случайным образом и, как таковая, выборка не может быть репрезентативной для всей исследуемой совокупности; это подрывает возможность делать обобщения на основе собранных данных. Кроме того, поскольку участников было относительно мало, было нецелесообразно оценивать влияние каждого из видов деятельности на подгруппы клиентов (т.е. врач, медсестра, фармацевт), которые предоставили бы ценную информацию; Повторение опроса с более широкой целевой группой будет представлять значительный интерес. Однако преимущества заключаются в простоте реализации и низкой стоимости подхода к опросу, а это означает, что последующее исследование с участием большего числа участников может быть проведено быстро и легко.
Список действий, предоставленный для оценки, является исчерпывающим списком личных и неличных действий и, следовательно, удовлетворяет действительности содержания анкеты.Однако центральный вопрос касается абстрактной по своей сути субъективной оценки со стороны субъекта; это нелегко проверить. Тем не менее, влияние на принятие решений важно при рассмотрении привычек медицинских работников, выписывающих рецепты. Кроме того, личное влияние и поведение по рецепту — многофакторный феномен, а это означает, что его практически невозможно смоделировать исчерпывающе; отзывчивость к личному влиянию может варьироваться, например, в зависимости от человека, страны, отрасли и продукта.Однако понимание средних эффектов различных действий или видов деятельности будет неоценимым для повышения осведомленности лиц, назначающих лекарства, о влиянии различных действий на их собственное поведение по рецепту.
14 мероприятий по просвещению по вопросам наркотиков | Учеба: Нида
Получите факты о том, как наркотики влияют на мозг и тело, используя эту полную книгу со страницами, которые можно распечатать, включая упражнения, поддерживающие понимание прочитанного, навыки построения графиков, навыки построения последовательности и критическое мышление.
Щелкните по ссылкам ниже, чтобы загрузить и распечатать копии всей книги занятий и рабочих листов для печати.
14 занятий по наркологическому просвещению
Получите факты о том, как наркотики влияют на мозг и тело, используя эту полную книгу со страницами, которые можно распечатать, включая упражнения, которые поддерживают понимание прочитанного, навыки построения графиков, навыки построения последовательности и критическое мышление.
Обезболивающее по рецепту
Посмотрите на график, который показывает данные о злоупотреблении лекарствами, отпускаемыми по рецепту.Затем используйте график, чтобы пройти тест на правильность или ложь.
Шпаргалка по клубным наркотикам
Создайте свой собственный шпаргалку с фактами о влиянии клубных наркотиков МДМА (экстази), ЛСД и метамфетамина.
Часто задаваемые вопросы о кокаине
Получите ответы на часто задаваемые вопросы о кокаине и его влиянии на мозг.
Путаница о героине
Составьте абзац из четырех предложений с фактами о героине и серьезном риске, который он представляет для вашего здоровья.
Nicotine News
Посмотрите на график, который показывает процент подростков, употребляющих никотин. Затем используйте график, чтобы пройти тест.
Перехитрите таблицу
Используйте эту таблицу для обзора фактов об основных наркотиках, которыми злоупотребляют.
Восторженные реалии: правда о клубных наркотиках
Узнайте факты о клубных наркотиках МДМА (экстази), ЛСД и метамфетамине.
Стероиды: всеобщий ужас
Прочтите о том, как стероиды могут повредить ваш мозг и тело.Затем заполните диаграмму, чтобы показать, что вы узнали.
The Cocaine Course
Используйте этот рабочий лист, чтобы записать то, что вы знаете, что вы хотели бы знать и что вы узнали о кокаине.
Слово о марихуане
Получите факты о марихуане, а затем заполните поле задания, чтобы показать, что вы знаете.
10 самых важных вещей, которые нужно знать об ингалянтах
Узнайте больше об ингалянтах и о том, как они могут повлиять на ваш мозг и тело.
Верно или нет? (Ингалянты)
Покажите, что вы знаете об ингалянтах и о том, как они могут повлиять на ваш мозг и тело, выполнив это истинное или ложное действие.
В чем вопрос?
Проверьте свои знания о кокаине, героине, ингалянтах, ЛСД, марихуане, МДМА и стероидах с помощью этой викторины в стиле Jeopardy .
Краткая информация о вашем мозге
Узнайте о частях мозга и о том, как наркотики изменяют его работу.После прочтения составьте схему мозга.
Хронология избранных мероприятий FDA и значимых событий, касающихся злоупотребления и злоупотребления опиоидами
1995. Оксиконтин (оксикодон с контролируемым высвобождением) одобрен; первая форма оксикодона, позволяющая вводить дозу каждые 12 часов вместо каждых 4-6 часов.
1998. Actiq (фентанил) утвержден; первое лекарство от боли, одобренное для лечения прорывной боли при раке, но с дополнительными мерами безопасности.
Начало 2000-х. Количество сообщений о передозировке и смерти от рецептурных обезболивающих, особенно оксиконтина, резко возросло.
2001. Маркировка оксиконтина была изменена, чтобы добавить и усилить предупреждения о возможности злоупотребления и злоупотребления этим препаратом.
2003. FDA выпустило предупреждающее письмо (PDF — 149 КБ) производителю OxyContin за вводящую в заблуждение рекламу.
2007. Закон о поправках FDA предоставил FDA полномочия требовать для определенных лекарств определенные меры безопасности, известные как стратегии оценки и смягчения рисков (REMS).
2009. FDA провело несколько встреч с общественностью и заинтересованных сторон, включая общественную встречу 27-28 мая и встречу заинтересованных сторон 4 декабря, для обсуждения опиоидных рисков, злоупотребления и злоупотребления.
FDA в партнерстве с Управлением по борьбе с наркотиками и психическим здоровьем США (SAMHSA) запустило инициативу по обеспечению безопасного использования опиоидного метадона.
FDA запустило Safe Use Initiative для снижения предотвратимого вреда от лекарств, включая опиоиды.
FDA начало работать с Управлением по борьбе с наркотиками США (DEA) и другими организациями, чтобы помочь просвещать общественность по вопросам безопасной утилизации опиоидов.
2010. FDA одобрило новую формулировку оксиконтина.
FDA провело совместное совещание консультативного комитета для обсуждения своего предложения по общеклассовой REMS для опиоидов пролонгированного действия (ER) / длительного действия (LA), таких как OxyContin.
2011. FDA одобрило REMS для трансмукозных продуктов с немедленным высвобождением фентанила (TIRF), таких как Actiq.
2012. FDA реализовало программу REMS ER / LA по опиоидам, которая включает добровольное обучение для врачей, выписывающих рецепты.
2013. Январь: 9 января FDA выпустило проект руководства по оказанию помощи промышленности в разработке новых формулировок опиоидных препаратов со свойствами сдерживания злоупотребления: Руководство для промышленности: Опиоиды, сдерживающие злоупотребление — Оценка и маркировка (PDF — 463KB ).
FDA провело 24-25 января совещание своего Консультативного комитета по безопасности лекарственных средств и управлению рисками (PDF — 69 КБ), чтобы обсудить преимущества и риски для здоровья населения, включая возможность злоупотребления, лекарствами, содержащими гидрокодон в сочетании с другими анальгетиками или в качестве лекарственного средства. противокашлевое.
Февраль: FDA провело 7-8 февраля общественные слушания для получения информации по вопросам, касающимся использования опиоидных препаратов для лечения хронической боли. Влияние одобренной маркировки лекарств на хроническую опиоидную терапию: Часть 15 Слух.
В открытом письме лицам, назначающим препараты, 1 марта FDA и медицинские профессиональные организации просили всех лиц, назначающих опиоиды, убедиться, что они досконально знают одобренную FDA маркировку продуктов для прописываемых ими опиоидов, а также пройти соответствующее обучение по опиоидной терапии. .FDA также призвало всех лиц, назначающих лекарства, помочь обуздать эпидемию опиоидов в нашей стране.
Апрель: 16 апреля FDA предприняло несколько действий, связанных с Оксиконтином.
Май: 10 мая FDA ответило на петицию и решило, что оригинальный состав Opana ER (оксиморфон гидрохлорид) таблеток с расширенным высвобождением не был снят с продажи по причинам безопасности или эффективности. В результате генерики оригинальной рецептуры могут и дальше утверждаться и продаваться.
FDA провело программ клинических разработок для конверсии опиоидов; Общественная мастерская; Запрос комментариев от 29 июля. Научный семинар был проведен для решения проблем общественного здравоохранения, связанных с включением таблиц конверсии эквианальгетических опиоидов в маркировку опиоидных продуктов.
Сентябрь: 10 сентября FDA объявило о ряде значительных мер по повышению безопасного и надлежащего использования опиоидов пролонгированного действия и длительного действия (ER / LA), включая изменения в маркировке безопасности для всего класса и новые постмаркетинговые меры. требования ко всем опиоидным анальгетикам ER / LA.FDA также ответило на две петиции граждан относительно маркировки опиоидов.
Октябрь 24 октября FDA опубликовало Заявление Джанет Вудкок, доктора медицины, директора Центра оценки лекарственных средств и исследований, о предлагаемой реклассификации гидрокодона.
2014. Апрель: 3 апреля FDA одобрило Evzio (инъекция налоксона гидрохлорида) для экстренного лечения известной или предполагаемой передозировки опиоидов. Налоксон — это лекарство, которое быстро устраняет последствия передозировки опиоидов.Evzio — это первый автоматический инъектор, предназначенный для доставки дозы налоксона за пределы медицинских учреждений.
14 апреля FDA завершило предложенные изменения в маркировке безопасности для всех опиоидных анальгетиков пролонгированного действия и длительного действия (ER / LA) и ответило на две петиции граждан относительно маркировки неонатального синдрома отмены опиоидов (NOWS).
Июль: 23 июля FDA одобрило Targiniq ER, обезболивающее с пролонгированным действием, которое содержит комбинацию оксикодона и налоксона.Targiniq ER — это второй опиоидный анальгетик пролонгированного действия / длительного действия (ER / LA) с одобренной FDA маркировкой, описывающей свойства продукта, сдерживающие злоупотребление.
Август: 19 августа FDA одобрило поправки к REMS ER / LA для опиоидных анальгетиков, чтобы включить информацию из изменений в маркировке безопасности опиоидных анальгетиков ER / LA, объявленных 10 сентября 2013 г. и утвержденных 16 апреля 2014 г. Наиболее существенные изменения заключались в уточнении утвержденных показаний к применению и ограничениях использования, а также в пересмотре предупреждений, включая предупреждения в рамке.
Октябрь: 17 октября FDA одобрило новую маркировку для Embeda (сульфат морфина и гидрохлорид налтрексона), опиоидного анальгетика пролонгированного действия (ER) для лечения боли, достаточно сильной, чтобы требовать ежедневного, круглосуточного, долгосрочного лечение опиоидами и альтернативные методы лечения которых неадекватны. Embeda — третий опиоидный анальгетик ER, одобренный с маркировкой, описывающей сдерживающие от злоупотребления свойствами продукта в соответствии с проектом руководства FDA 2013 года «Опиоиды, сдерживающие злоупотребление — оценка и маркировка».Новая маркировка включает заявление, указывающее, что Embeda обладает свойствами, которые, как ожидается, уменьшат пероральное и интраназальное злоупотребление при измельчении продукта.
Ноябрь: 20 ноября FDA одобрило Hysingla ER (битартрат гидрокодона), опиоидный анальгетик с пролонгированным высвобождением (ER) для лечения достаточно сильной боли, требующей ежедневного, круглосуточного, длительного лечения опиоидами и для которой альтернативные варианты лечения неадекватны. Hysingla ER — это четвертый опиоидный анальгетик ER, который был одобрен с маркировкой, описывающей свойства продукта, сдерживающими злоупотребление, в соответствии с проектом руководства FDA для промышленности от 2013 г. «Опиоиды, сдерживающие злоупотребление, — оценка и маркировка».Hysingla ER обладает свойствами, которые, как ожидается, уменьшат, но не полностью предотвратят злоупотребление наркотиком, когда его разжевывают, а затем принимают перорально, или измельчают, вдыхают или вводят в виде инъекций.
2015. Январь: Январь: 30 января FDA одобрило модифицированный состав Zohydro ER (капсулы с пролонгированным высвобождением битартрата гидрокодона). FDA не одобрило заявление о маркировке Zohydro ER, предотвращающей злоупотребления.
Апрель: 1 апреля FDA выпустило окончательное руководство по оказанию помощи промышленности в разработке опиоидных лекарственных препаратов с потенциально сдерживающими свойствами.Руководство для промышленности: опиоиды, сдерживающие злоупотребление »(PDF — 227KB) объясняет текущее мнение FDA об исследованиях, которые должны быть проведены, чтобы продемонстрировать, что данный состав обладает свойствами сдерживания злоупотребления, дает рекомендации о том, как эти исследования должны проводиться и оцениваться. и обсуждает, какие требования к маркировке могут быть одобрены на основании результатов этих исследований.
Август: 13 августа FDA одобрило применение Оксиконтина для некоторых педиатрических пациентов при боли, достаточно сильной, чтобы требовать ежедневного, круглосуточного, длительного лечения опиоидами, и для которых альтернативные варианты лечения неадекватны.Это разрешение ограничено толерантными к опиоидам педиатрическими пациентами в возрасте 11 лет и старше, которые уже принимают и переносят минимальную суточную дозу оксикодона не менее 20 мг перорально или его эквивалент. Можно ожидать, что эти пациенты будут продолжать лечение опиоидами в течение нескольких недель или более.
Октябрь: 2 октября FDA одобрило MorphaBond (сульфат морфина), опиоидный анальгетик с пролонгированным высвобождением (ER) для лечения боли , достаточно сильный, чтобы требовать ежедневного, круглосуточного, длительного лечения опиоидами, для которого альтернативные варианты лечения неадекватны.MorphaBond — пятый опиоидный анальгетик ER, одобренный с маркировкой, описывающей сдерживающие от злоупотребления свойствами продукта в соответствии с рекомендациями FDA для промышленности от 2015 года «Опиоиды, сдерживающие злоупотребление — оценка и маркировка». MorphaBond обладает свойствами, которые, как ожидается, уменьшат, но не устранят злоупотребление наркотиком при раздавливании, вдыхании или инъекции.
Ноябрь 18 ноября FDA одобрило назальный спрей Narcan, первую одобренную FDA версию назального спрея налоксона гидрохлорида, жизненно необходимого лекарства, которое может временно остановить или обратить вспять эффекты передозировки опиоидов, включая передозировку героина.
2016. Февраль: 4 февраля руководители FDA в ответ на эпидемию злоупотребления опиоидами призвали к разработке далеко идущего плана действий по переоценке подхода агентства к опиоидным препаратам. План будет сосредоточен на политике, направленной на то, чтобы обратить эпидемию вспять, при этом обеспечивая пациентам, страдающим от боли, доступ к эффективному облегчению.
4 февраля FDA выпустило пять постмаркетинговых (PMR) требований, объявленных 13 сентября 2013 года, и заменило их 11 PMR (10 постмаркетинговых исследований и одно клиническое испытание), поскольку 10 постмаркетинговых наблюдательных исследований и одно клиническое испытание включают уточненные меры для оценки известные серьезные риски злоупотребления, злоупотребления, зависимости, передозировки и смерти.
19 февраля FDA объявило, что на заседании Педиатрического консультативного комитета (PAC) 12 апреля они представят структуру текущих планов двухдневного совместного заседания PAC, Консультативного комитета по обезболивающим и обезболивающим препаратам и Консультативные комитеты по безопасности лекарственных средств и управлению рисками. Это совместное заседание запланировано на 15 и 16 сентября 2016 г., и во время этого заседания FDA обратится к широкому кругу независимых экспертов с реальным опытом, чтобы дать рекомендации о том, как удовлетворить уникальные потребности детей, страдающих от боли.
Март: 1 марта FDA созвало Научный совет, чтобы услышать и обсудить ряд неотложных вопросов, связанных с текущей эпидемией опиоидов, включая: (1) роль опиоидов в лечении боли; (2) научные проблемы, с которыми сталкивается FDA при поддержке разработки обезболивающих (3) научные проблемы, стоящие перед FDA в стремлении понять реальное использование опиоидов для лечения боли (4) роль, которую FDA играет как часть более крупной федеральной , Государственные и местные меры реагирования на проблемы обеспечения надлежащего обезболивания при одновременном сокращении злоупотребления опиоидами; и (5) послепродажный надзор за опиоидами.
22 марта FDA объявило о необходимых изменениях в маркировке безопасности для всех опиоидных обезболивающих с немедленным высвобождением. Среди изменений, FDA требует нового предупреждения в рамке о серьезных рисках неправильного использования и злоупотребления, которые могут привести к зависимости, передозировке и смерти. FDA также требует внести несколько дополнительных изменений в маркировку безопасности для всех рецептурных опиоидных продуктов, чтобы включить дополнительную информацию о риске этих лекарств.
24 марта FDA выпустило проект руководства под названием «Общие принципы оценки сдерживания злоупотребления непатентованными твердыми пероральными опиоидными лекарственными средствами».Это руководство рекомендует исследования, которые должен провести заявитель-генерик, чтобы FDA могло оценить сдерживание злоупотребления определенными непатентованными опиоидными лекарственными препаратами и помочь гарантировать, что генерические версии одобренных опиоидов с составами, сдерживающими злоупотребление (ADF), не менее сдерживают злоупотребление, чем названный бренд. препарат, средство, медикамент.
Апрель: 26 апреля FDA одобрило Xtampza ER (оксикодон), опиоидный анальгетик с пролонгированным высвобождением (ER) для лечения достаточно сильной боли, требующей ежедневного круглосуточного долгосрочного лечения опиоидами, для которого требуется альтернативное лечение. варианты неадекватны.Xtampza ER — шестой по счету опиоидный анальгетик ER, одобренный с маркировкой, описывающей сдерживающие от злоупотребления свойствами продукта в соответствии с рекомендациями FDA для промышленности от 2015 года «Опиоиды, сдерживающие злоупотребление, — оценка и маркировка». Xtampza ER обладает свойствами, которые, как ожидается, уменьшат, но не устранят злоупотребление препаратом при раздавливании, вдыхании или инъекции.
Май: 3-4 мая FDA провело совместное заседание Консультативного комитета по безопасности лекарственных средств и управлению рисками и Консультативного комитета по обезболивающим и обезболивающим препаратам для обсуждения результатов оценок пролонгированного и длительного действия (ER / LA) Стратегии оценки риска и снижения риска опиоидных анальгетиков (REMS).Комитеты предоставили комментарии относительно того, обеспечивает ли REMS с элементами для обеспечения безопасного использования (ETASU) безопасное использование, не является ли чрезмерно обременительным для пациента доступ к лекарствам и, насколько это практически возможно, минимизирует нагрузку на систему оказания медицинских услуг.
26 мая FDA объявило о необходимых изменениях в маркировке безопасности продуктов метадона и бупренорфина, используемых беременными женщинами для медикаментозного лечения расстройства, связанного с употреблением опиоидов, чтобы предоставить поставщикам полную информацию о преимуществах и рисках этих продуктов.
26 мая FDA одобрило пробуфин, первый бупренорфиновый имплантат для поддерживающего лечения опиоидной зависимости. Пробуфин, имплантат, предназначенный для обеспечения постоянного низкого уровня бупренорфина в течение шести месяцев, следует использовать у пациентов, которые уже стабильны на низких или умеренных дозах других форм бупренорфина, и как часть полной программы лечения, которая включает консультирование. и психологическая поддержка.
Август: 19 августа FDA одобрило Troxyca ER (капсулы с пролонгированным высвобождением гидрохлорида оксикодона и гидрохлорида налтрексона), опиоидный анальгетик с пролонгированным высвобождением (ER) для лечения боли, достаточно сильной, чтобы требовать ежедневного, круглосуточного, длительного действия. краткосрочное лечение опиоидами, для которого альтернативные варианты лечения неадекватны.Troxyca ER является седьмым опиоидным анальгетиком ER, который был одобрен с маркировкой, описывающей свойства продукта, сдерживающими злоупотребление, в соответствии с рекомендациями FDA для промышленности от 2015 года «Сдерживающие от злоупотребления опиоиды — оценка и маркировка». Troxyca ER обладает свойствами, которые, как ожидается, уменьшат, но не устранят злоупотребление препаратом, когда его раздавливают, а затем принимают перорально, вдыхают или вводят путем инъекции.
31 августа FDA объявило о требуемых для всего класса изменениях в маркировке лекарств, чтобы помочь информировать медицинских работников и пациентов о серьезных рисках, связанных с комбинированным использованием определенных опиоидных препаратов и класса депрессантов центральной нервной системы, называемых бензодиазепинами.Среди изменений, FDA требует упакованных предупреждений и руководств по лекарствам для рецептурных опиоидных анальгетиков, опиоидсодержащих продуктов от кашля и бензодиазепинов с информацией о серьезных рисках, включая крайнюю сонливость, угнетение дыхания, кому и смерть, связанных с использованием этих лекарств в в то же время.
Сентябрь: 15-16 сентября FDA провело совместное заседание Консультативного комитета по обезболивающим и обезболивающим препаратам, Консультативного комитета по безопасности лекарственных средств и управлению рисками и Консультативного комитета по педиатрии для обсуждения соответствующих планов развития по созданию безопасность и эффективность отпускаемых по рецепту опиоидных анальгетиков для педиатрических пациентов, включая получение фармакокинетических данных и использование экстраполяции.
Октябрь: 5 октября FDA созвало совместное заседание Консультативного комитета по обезболивающим и обезболивающим препаратам и Управления безопасности лекарственных средств и управления рисками для обсуждения продуктов налоксона, предназначенных для использования в обществе, в частности, наиболее подходящей дозы или доз налоксон для устранения последствий опасной для жизни передозировки опиоидов в любом возрасте, а также роль наличия нескольких доз в этой ситуации. Комитеты также обсудили критерии, которые назначающие препараты будут использовать для выбора наиболее подходящей дозы до случая передозировки опиоидами, и маркировку для информирования об этом решении, если доступны несколько доз.
31 октября — 1 ноября FDA провело открытое собрание «Предмаркетная оценка удерживающих злоупотребление свойств опиоидных лекарственных препаратов», чтобы обсудить научные и технические вопросы, касающиеся разработки рецептур и предпродажной оценки опиоидных лекарственных препаратов, вызывающих злоупотребление. -удерживающие свойства. Встреча была предназначена для того, чтобы дать FDA возможность обсудить подход к тестированию, рекомендованный FDA в проекте руководства «Общие принципы оценки сдерживания злоупотребления универсальными твердыми пероральными опиоидными лекарственными препаратами», и получить от заинтересованных сторон мнение общественности.Встреча также предоставила возможность обсудить усилия FDA по разработке стандартизированных методологий тестирования in vitro для оценки сдерживания злоупотребления опиоидными лекарственными препаратами.
Декабрь: 16 декабря FDA одобрило несколько изменений в маркировке безопасности (SLC) о серьезных рисках рецептурных опиоидных анальгетиков и опиоидов, одобренных для медикаментозного лечения (MAT) опиоидной зависимости, включая SLC для всего класса для немедленного высвобождения ( IR) опиоидные обезболивающие, SLC для продуктов метадона и бупренорфина, а также SLC для всего класса о серьезных рисках, связанных с комбинированным использованием определенных опиоидных препаратов с бензодиазепинами или другими депрессантами центральной нервной системы (ЦНС).
2017. Январь: 9 января FDA одобрило Arymo ER (таблетки с пролонгированным высвобождением сульфата морфина), опиоидный анальгетик с пролонгированным высвобождением (ER) для лечения боли, достаточно сильной, чтобы требовать ежедневно, круглосуточно, длительное лечение опиоидами, при котором альтернативные варианты лечения неадекватны. Arymo ER — восьмой по счету опиоидный анальгетик ER, одобренный с маркировкой, описывающей сдерживающие от злоупотребления свойствами продукта, в соответствии с рекомендациями FDA для промышленности от 2015 г. «Опиоиды, сдерживающие злоупотребление — оценка и маркировка».Формула Arymo ER придает ему физико-химические свойства, которые, как ожидается, затруднят злоупотребление путем инъекции.
17 января FDA одобрило Vantrela ER (таблетки с пролонгированным высвобождением битартрата гидрокодона), опиоидный анальгетик с пролонгированным высвобождением (ER) для лечения достаточно сильной боли, требующей ежедневного круглосуточного долгосрочного лечения опиоидами, альтернатива которой варианты лечения неадекватны. Vantrela ER — это девятый опиоидный анальгетик ER, одобренный с маркировкой, описывающей свойства продукта, предотвращающие злоупотребление, в соответствии с рекомендациями FDA для промышленности от 2015 года «Опиоиды, сдерживающие злоупотребление — оценка и маркировка».Ожидается, что физические и химические свойства Vantrela ER затруднят внутривенное (инъекционное) злоупотребление и, как ожидается, уменьшат, но не устранят злоупотребление назальным и оральным путями. Однако злоупотребление Vantrela ER этими маршрутами все еще возможно.
Апрель: 20 апреля FDA объявило об ограничении использования кодеина и трамадола у детей, поскольку эти лекарства несут серьезный риск, включая замедленное или затрудненное дыхание и смерть, которые, по-видимому, представляют больший риск для детей младше 12 лет. , и не следует использовать у этих детей.Эти лекарства также следует ограничивать некоторым детям старшего возраста. FDA также рекомендовало не использовать кодеин и трамадол кормящим матерям из-за возможного вреда для их младенцев.
20 апреля FDA одобрило RoxyBond (оксикодона гидрохлорид), опиоидный анальгетик, показанный для снятия боли, достаточно сильной, чтобы требовать опиоидного анальгетика, и для которой альтернативные методы лечения неадекватны. RoxyBond — это первый опиоидный анальгетик с немедленным высвобождением, одобренный с маркировкой, описывающей его свойства сдерживания злоупотребления в соответствии с Руководством FDA для промышленности от 2015 года: Опиоиды, сдерживающие злоупотребление, — оценка и маркировка.На основании лабораторных исследований таблетки RoxyBond устойчивы к определенным формам манипуляций, таким как дробление, измельчение или иное извлечение оксикодона из таблетки, которые обычно используются для облегчения злоупотребления опиоидами через нос и внутривенно.
27 апреля FDA провело экспертный круглый стол для медицинских работников, чтобы обсудить их опыт использования средств от кашля у детей (<18 лет), в частности, опиоидсодержащих противокашлевых средств, а также имеющихся данных в поддержку рекомендаций, сделанных различные профессиональные общества по лечению кашля у детей.
Май: 9-10 мая FDA провело общественное собрание «Обучение медицинских работников обезболиванию и безопасному использованию опиоидных анальгетиков — изучение пути вперед», чтобы получить информацию по вопросам и проблемам, связанным с усилиями федерального правительства по поддержке обучения. по обезболиванию и безопасному назначению, отпуску и использованию опиоидов пациентами (безопасное использование опиоидов) для медицинских работников.
10 мая FDA выпустило «Образовательный план FDA для поставщиков медицинских услуг, участвующих в лечении или поддержке пациентов с болью» (проект изменений в Плане), который расширяет текущий План и включает информацию об управлении болью, включая принципы лечения острой и хронической боли; немедикаментозные методы лечения боли; и фармакологические методы лечения боли (как неопиоидные анальгетики, так и опиоидные анальгетики).
Июнь: 8 июня FDA потребовало, чтобы Endo Pharmaceuticals удалила с рынка свое опиоидное обезболивающее, переработанный Opana ER (оксиморфон гидрохлорид), исходя из опасений, что преимущества препарата больше не могут перевешивать его риски.
Июль: 6 июля была опубликована статья доктора Скотта Готтлиба и доктора Джанет Вудкок в JAMA Viewpoint, озаглавленная «Маршалинг экспертизы рисков и выгод FDA для решения текущей эпидемии злоупотребления опиоидами».
6 июля, по запросу FDA, Endo объявила, что добровольно удалит с рынка переработанный Opana ER.
10-11 июля FDA провело открытое собрание «Данные и методы оценки воздействия опиоидных составов со свойствами, предназначенными для сдерживания злоупотребления в постмаркетинговых условиях: научное обсуждение настоящих и будущих возможностей», чтобы обсудить способы улучшения анализа. и интерпретация существующих данных, а также для обсуждения возможностей и проблем для сбора и / или связывания дополнительных данных для улучшения национального надзора и исследовательских возможностей в этой области.
13 июля Национальные академии наук, инженерии и медицины выпустили консенсусный отчет по заказу FDA, в котором излагается состояние науки в отношении злоупотребления и неправильного употребления опиоидов по рецепту, а также развивающаяся роль, которую опиоиды играют в боли. управление.
Сентябрь: 11 сентября FDA провело совещание педиатрического консультативного комитета для обсуждения использования рецептурных опиоидных продуктов, содержащих гидрокодон или кодеин, для лечения кашля у педиатрических пациентов.Обсуждение включало текущую практику лечения кашля у детей и соображения пользы и риска в отношении использования рецептурных опиоидных препаратов у педиатрических пациентов.
20 сентября FDA сообщило, что не следует отказывать в приеме лекарств от опиоидной зависимости бупренорфин и метадон пациентам, принимающим бензодиазепины или другие препараты, угнетающие центральную нервную систему (ЦНС). Совместное применение этих препаратов увеличивает риск серьезных побочных эффектов; однако вред, причиняемый нелеченой опиоидной зависимостью, может перевесить эти риски.Тщательный прием лекарств со стороны медицинских работников может снизить эти риски.
28 сентября, после определения необходимости REMS для опиоидных анальгетиков IR, чтобы гарантировать, что польза от этих препаратов и далее перевешивает риски, FDA отправило письма производителям опиоидных анальгетиков IR, информируя их о том, что их продукты, предназначенные для использования в амбулаторные учреждения будут подчиняться тем же требованиям REMS, что и опиоидные анальгетики ER / LA.
Ноябрь: 21 ноября FDA выпустило окончательное руководство под названием «Общие принципы оценки сдерживания злоупотребления универсальными твердыми пероральными опиоидными лекарственными средствами».Это руководство рекомендует исследования, в том числе сравнительные исследования in vitro и фармакокинетические исследования, которые потенциальный заявитель на сокращенную заявку на новое лекарство (ANDA) должен провести и представить в FDA в ANDA, чтобы продемонстрировать, что непатентованный твердый пероральный опиоидный лекарственный препарат является не менее сдерживающим фактором. чем препарат, указанный в его справочнике, в отношении всех потенциальных путей злоупотребления.
30 ноября FDA одобрило Sublocade, первый инъекционный продукт бупренорфина для разового применения в месяц для лечения умеренного и тяжелого расстройства, связанного с употреблением опиоидов, у взрослых пациентов, которые начали лечение трансмукозальным (всасывающимся через слизистую оболочку) продуктом, содержащим бупренорфин.Он показан пациентам, которые получали стабильную дозу бупренорфина не менее семи дней.
Декабрь: 11-12 декабря FDA провело открытый семинар, посвященный роли вариантов упаковки, хранения и утилизации в более широком контексте деятельности, направленной на решение проблемы злоупотребления, неправильного использования или несоответствующего доступа к рецептурным опиоидным лекарственным препаратам; руководящие принципы и соображения при разработке вариантов упаковки, хранения и утилизации опиоидов; интеграция вариантов упаковки, хранения и утилизации в существующие системы здравоохранения и аптек, включая как открытые, так и закрытые системы здравоохранения; потребности в данных и способы решения проблем при оценке влияния вариантов упаковки, хранения и утилизации как на премаркете, так и на постмаркетинговом этапе; и способы, с помощью которых FDA могло бы стимулировать разработку и оценку вариантов упаковки, хранения и утилизации опиоидов, которые могут повысить безопасность опиоидов.
2018 . Январь: 11 января комиссар FDA Скотт Готлиб, доктор медицины, объявил Дорожную карту стратегической политики на 2018 год, в которой представлен обзор некоторых из ключевых приоритетов, которые агентство будет преследовать в продвижении миссии FDA в области общественного здравоохранения. Частью Дорожной карты является сокращение злоупотребления опиоидными препаратами и злоупотребления ими.
11 января FDA объявило, что оно требует изменений в маркировке безопасности отпускаемых по рецепту лекарств от кашля и простуды, содержащих кодеин или гидрокодон, чтобы ограничить использование этих продуктов взрослыми от 18 лет и старше, поскольку риски этих лекарств перевешивают их преимущества для детей младше 18.Агентство также требует добавления информации по безопасности о рисках неправильного использования, злоупотребления, зависимости, передозировки, смерти, а также замедленного или затрудненного дыхания в штучную упаковку с предупреждением на этикетках лекарств для рецептурных лекарств от кашля и простуды, содержащих кодеин или гидрокодон.
24 января FDA и Федеральная торговая комиссия разослали совместные предупреждающие письма маркетологам и дистрибьюторам 12 продуктов для прекращения употребления опиоидов за незаконный маркетинг неутвержденных продуктов с заявлениями об их способности помочь в лечении опиоидной зависимости и синдрома отмены.
30 января FDA провело общественные слушания «Руководящий комитет по опиоидной политике: предписания вмешательства — изучение стратегии внедрения», чтобы получить информацию от заинтересованных сторон о том, как FDA может под руководством REMS улучшить безопасное использование опиоидных анальгетиков путем ограничения чрезмерное назначение для уменьшения возникновения новых зависимостей и ограничения злоупотребления опиоидными анальгетиками.
30 января FDA объявило об ограничениях на упаковку лекарства от диареи лоперамида (имодиума), чтобы способствовать безопасному использованию.
30 января FDA опубликовало пересмотренный проект «План обучения опиоидных анальгетиков REMS для медицинских работников, участвующих в лечении и мониторинге пациентов с болью», который расширяет существующий план и включает информацию об управлении болью, включая принципы лечения острой боли. и лечение хронической боли; немедикаментозные методы лечения боли; и фармакологические методы лечения боли. (Важно отметить, что пересмотренный План не будет считаться окончательным до тех пор, пока не будет утверждена Стратегия оценки и снижения риска опиоидных анальгетиков.)
14 февраля FDA провело совместное заседание Консультативного комитета по обезболивающим и обезболивающим препаратам и Консультативного комитета по безопасности лекарственных средств и управлению рисками, чтобы обсудить новую заявку на лекарство для Гайдексора (предлагаемое торговое название), комбинированной пероральной таблетки с фиксированной дозой, представленной на рассмотрение. от Charleston Laboratories, Inc., который содержит гидрокодон, ацетаминофен и прометазин, для краткосрочного лечения острой боли, достаточно сильной, чтобы потребовался опиоидный анальгетик, при одновременном предотвращении и уменьшении вызванной опиоидами тошноты и рвоты.Комитеты также обсудили возможность злоупотребления этим продуктом, не сдерживающим злоупотребления, и вопрос о том, следует ли его одобрить.
Февраль: 15 февраля, в рамках соглашения о сотрудничестве с FDA, Центр Герцога-Марголиса провел открытый семинар «Стратегии содействия безопасному использованию и надлежащему назначению опиоидов по рецепту», чтобы изучить ландшафт системы здравоохранения и вмешательства плательщиков для содействия безопасному и надлежащему назначению опиоидов; обсудить, как системы здравоохранения и плательщики используют данные и ИТ-инструменты здравоохранения для поддержки вмешательств; обсудить, как были реализованы подходы системы здравоохранения, препятствия на пути их принятия и возможные непредвиденные последствия принятия; и обсудить, как создать доказательную базу для поддержки существующей системы здравоохранения и вмешательств плательщиков, а также как можно определить и измерить успех.
марта : 27 марта FDA провело совещание Консультативного комитета по психофармакологическим препаратам, чтобы обсудить новую заявку на лекарство лофексидина гидрохлорида, поданную US WorldMeds, LLC, для смягчения симптомов, связанных с отменой опиоидов и облегчения завершения приема опиоидов. прекращение лечения.
Апрель : 17 апреля FDA в сотрудничестве с Национальным институтом злоупотребления наркотиками (NIDA) проводит общественное собрание по разработке лекарственных препаратов для лечения расстройств, связанных с употреблением опиоидов (OUD), ориентированных на пациентов.Помимо NIDA, FDA также тесно сотрудничает с защитой интересов пациентов и общественными организациями, чтобы поощрять участие людей с OUD. Эта встреча согласуется с текущей работой FDA, направленной на снижение воздействия злоупотребления опиоидами и зависимости.
20 апреля FDA выпустило проект руководства «Опиоидная зависимость: разработка продуктов депо бупренорфина для лечения», который отражает текущие взгляды агентства в отношении разработки лекарств и вопросов дизайна испытаний, имеющих отношение к изучению продуктов депо бупренорфина (т.е. продукты с модифицированным высвобождением для инъекций или имплантации).
Май : 16 мая FDA одобрило Lucemyra (лофексидина гидрохлорид), первое неопиоидное лечение для смягчения симптомов отмены, связанных с резким прекращением приема опиоидов.
22 мая FDA провело совместное заседание Консультативного комитета по обезболивающим и обезболивающим препаратам и Консультативного комитета по безопасности лекарственных средств и управлению рисками для обсуждения заявки на новый препарат для сублингвального спрея бупренорфина, представленного INSYS Development Company, Inc.для лечения острой боли от умеренной до сильной, когда уместно использование опиоидных анальгетиков. Комитеты также попросят обсудить, следует ли одобрить этот продукт.
Май: 30 мая FDA запустило инновационный вызов, чтобы стимулировать разработку медицинских устройств, в том числе цифровых устройств здравоохранения и диагностики, направленных на устранение боли, зависимости и отвлечения внимания.
июнь : 1 июня FDA разослало фармацевтическим компаниям письма с уведомлением об изменении маркировки безопасности с одобренными опиоидными анальгетиками, предназначенными для использования в амбулаторных условиях, которые требуют от компаний включения новой информации о безопасности опиоидных анальгетиков REMS в предупреждение в штучной упаковке. и разделы «Предупреждения и меры предосторожности» в информации о назначении из-за общей недостаточной осведомленности о REMS среди всех лиц, назначающих опиоидные анальгетики.
, июнь: 5 июня FDA приняло меры против 53 веб-сайтов, рекламирующих несанкционированные опиоиды в рамках комплексных усилий по борьбе с нелегальными онлайн-продажами.
Июнь: 14 июня FDA одобрило первые генерические версии сублингвальной пленки Suboxone.
июнь: 26 июня FDA созвало совместное заседание Консультативного комитета по обезболивающим и обезболивающим препаратам и Консультативного комитета по безопасности лекарственных средств и управлению рисками, чтобы обсудить новую заявку на лекарство для капсул с пролонгированным высвобождением оксикодона, представленную Pain Therapeutics, с предложенные показания к лечению боли, достаточно сильной, чтобы требовать ежедневного, круглосуточного, длительного лечения опиоидами и для которых альтернативные варианты лечения неадекватны.Продукт предназначен для защиты от злоупотреблений на основе его физико-химических свойств. Комитеты попросят обсудить, достаточны ли данные, представленные заявителем, для поддержки маркировки продукта с характеристиками, которые, как ожидается, предотвратят злоупотребления.
, июнь: 27 июня FDA созвало интернет-заинтересованные стороны, правительственные учреждения, академических исследователей и группы поддержки на однодневный онлайн-саммит по опиоидам, чтобы обсудить способы совместного принятия более решительных мер в борьбе с опиоидным кризисом за счет сокращения доступности незаконных опиоидов в Интернете. .
июля : 9 июля FDA провело общественное собрание по разработке лекарств для лечения хронической боли, ориентированное на пациентов, чтобы выслушать мнения пациентов о хронической боли, взгляды на подходы к лечению, а также проблемы или препятствия на пути к лечению хронической боли.
августа : 3 августа FDA провело совместное заседание Консультативного комитета по обезболивающим и обезболивающим препаратам и Консультативного комитета по безопасности лекарственных средств и управлению рисками, чтобы обсудить результаты оценок риска трансмукозальных препаратов фентанила с немедленным высвобождением (TIRF). Стратегия оценки и смягчения последствий (REMS), утвержденная в декабре 2011 г.TIRF REMS требует, чтобы поставщики медицинских услуг, выписывающие лекарства TIRF для амбулаторного использования, были специально сертифицированы, чтобы аптеки, отпускающие лекарства TIRF для стационарного и амбулаторного применения, были специально сертифицированы, и чтобы форма соглашения между пациентом и врачом заполнялась до выдачи лекарств TIRF для амбулаторное использование. Агентство запросит у комитетов оценку того, обеспечивает ли этот REMS с элементами для обеспечения безопасного использования (ETASU) безопасное использование, не является ли чрезмерно обременительным для доступа пациентов к лекарствам и, насколько это практически возможно, минимизирует нагрузку на оказание медицинской помощи. система.Агентство также будет запрашивать у комитетов информацию о любых возможных изменениях целей и требований TIRF REMS, а также информацию об адекватности оценок, проведенных в рамках оценок REMS, чтобы определить, достигаются ли цели TIRF REMS.
6 августа FDA выпустило проект руководства для промышленности «Расстройство, связанное с употреблением опиоидов: конечные точки для демонстрации эффективности лекарственных средств для лечения с помощью лекарств», которое предназначено для оказания помощи спонсорам в разработке лекарств для лечения расстройства, связанного с употреблением опиоидов ( OUD) и обращается к клиническим конечным точкам, приемлемым для демонстрации эффективности таких препаратов.
22 августа FDA заключило контракт с Национальными академиями наук, инженерии и медицины (NASEM) на содействие разработке научно обоснованных рекомендаций по назначению соответствующих опиоидных анальгетиков при острой боли, вызванной определенными условиями или процедурами.
28 августа FDA приняло меры против 21 веб-сайта, на котором продаются несанкционированные опиоиды, в рамках усилий агентства по борьбе с незаконными онлайн-продажами.
Сентябрь : 7 сентября FDA одобрило новую дозировку сублингвальной пленки бупренорфина и налоксона в качестве поддерживающего лечения опиоидной зависимости.
18 сентября FDA одобрило опиоидный анальгетик REMS.
20 сентября в соответствии с соглашением о сотрудничестве с FDA Центр политики здравоохранения им. Герцога Марголиса провел открытый семинар «Расширение доступа к эффективному лечению расстройства, связанного с употреблением опиоидов: перспективы поставщиков услуг по снижению барьеров для оказания помощи, основанной на фактах».
27-28 сентября Управление женского здоровья FDA в сотрудничестве с CDER и CTP организовало двухдневную открытую встречу на тему «Употребление, зависимость и выздоровление от опиоидов и никотина: влияние пола и пола.
11 октября FDA созвало совещание Консультативного комитета по обезболивающим и обезболивающим препаратам для обсуждения новой заявки на лекарство 210730 для инъекций олицеридина 1 миллиграмм / миллилитр, представленной Trevena, Inc., для лечения умеренных и умеренных заболеваний. сильная острая боль у взрослых пациентов, которым необходимо внутривенное введение опиоидов. Комитет также обсудил данные об эффективности и безопасности и соображения пользы и риска.
12 октября FDA созвало совещание Консультативного комитета по анестетикам и анальгетикам для обсуждения заявки на новый препарат 209128, сублингвальные таблетки суфентанила, представленного AcelRx Pharmaceuticals, Inc.для лечения умеренной и сильной острой боли, достаточно сильной, чтобы потребовать опиоидного анальгетика и для которой альтернативные методы лечения неадекватны, у взрослых пациентов под медицинским наблюдением. Комитет также обсудил соотношение риска и пользы и вопрос о том, следует ли одобрить этот продукт.
1 ноября FDA провело совместное заседание Консультативного комитета по психофармакологическим препаратам и Консультативного комитета по безопасности лекарственных средств и управлению рисками для обсуждения профиля эффективности, безопасности и соотношения риска и пользы нового лекарственного препарата 210417 для сублингвальных таблеток бупренорфина и самидорфана, представленного Alkermes, Inc., для дополнительного лечения большого депрессивного расстройства.
2 ноября FDA одобрило первое пероральное обезболивающее суфентанил для использования в условиях медицинского наблюдения.
14 ноября FDA созвало совместное заседание Консультативного комитета по обезболивающим и обезболивающим препаратам и Консультативного комитета по безопасности лекарственных средств и управлению рисками, чтобы обсудить новую заявку на лекарство 209774 для перорального препарата оксикодона с немедленным высвобождением, который предназначен для для противодействия распространенным методам физических или химических манипуляций и для предотвращения внутривенного и интраназального злоупотребления, представленный SpecGx Inc.для купирования достаточно сильной боли, требующей опиоидного анальгетика, и для которой альтернативные методы лечения неадекватны. Комитеты также определили, продемонстрировал ли заявитель адекватно, что свойства предлагаемого продукта, предотвращающие злоупотребления, достаточны для включения этой информации на этикетке продукта, и должен ли продукт быть одобрен.
15 ноября FDA созвало совещание Консультативного комитета по обезболивающим и обезболивающим препаратам, чтобы обсудить оценку результатов, связанных с сохранением опиоидных анальгетиков в клинических испытаниях острой боли.Комитет также прокомментировал дизайн испытаний и конечные точки этих исследований, а также способы определения клинической значимости результатов.
2019.
Январь : 17 января FDA объявило о результатах беспрецедентной работы по разработке, тестированию и проверке основных требований к маркировке, необходимых для утверждения версии налоксона, отпускаемой без рецепта (OTC), включая размещение двух образцовых этикеток с фактами о лекарствах. (DFL) и подтверждающий обзор FDA. В целом, исследование показало, что модель DFL хорошо известна потребителям и приемлема для использования производителями в поддержку их программ разработки безрецептурного налоксона.
Февраль : 6 февраля FDA выпустило окончательное руководство «Расстройство, связанное с употреблением опиоидов: разработка депо-бупренорфиновых продуктов для лечения», в котором отражены текущие взгляды агентства в отношении разработки лекарств и вопросов дизайна испытаний, имеющих отношение к изучению депо-бупренорфиновых продуктов ( т.е. продукты с модифицированным высвобождением для инъекций или имплантации).
12 февраля FDA объявило о продолжающихся усилиях по остановке распространения запрещенных опиоидов и обеспечению безопасности США.цепочки поставок наркотиков и решительно противостоять эпидемии опиоидов.
Март: 19 марта FDA приняло меры против продавцов неутвержденных продуктов, утверждающих, что они предназначены для лечения зависимости, хронической боли и других серьезных заболеваний.
27 марта FDA объявило о новых шагах по усилению требований безопасности агентства, направленных на снижение рисков, связанных с продуктами фентанила с немедленным высвобождением через слизистую оболочку.
Апрель: 2 апреля FDA приняло новые принудительные меры в рамках продолжающихся усилий агентства по борьбе с незаконной продажей опиоидов через Интернет.
2 апреля FDA провело вторую встречу на высшем уровне по опиоидным опиоидам в Интернете с участием заинтересованных сторон, лидеров мнений, государственных структур, научных исследователей и групп по защите интересов.
9 апреля FDA объявило о вреде, полученном в результате внезапного прекращения приема опиоидных обезболивающих, и потребовало изменить этикетку, чтобы назначать медикам рекомендации по постепенному индивидуальному уменьшению дозы.
19 апреля FDA одобрило первый общий назальный спрей налоксона для лечения передозировки опиоидов.
25 апреля Управление по санитарному надзору за качеством пищевых продуктов и медикаментов начало кампанию по просвещению населения с целью поощрения безопасного удаления неиспользованных опиоидных обезболивающих из домов.
Май: 30 мая FDA открыло публичную регистрацию, чтобы запросить информацию о требованиях к блистерной упаковке фиксированного количества для некоторых опиоидных обезболивающих, чтобы уменьшить ненужное воздействие опиоидов.
июнь: 11-12 июня FDA провело совместное заседание Консультативного комитета по безопасности лекарственных средств и управлению рисками и Консультативного комитета по обезболивающим и обезболивающим лекарственным средствам, чтобы получить информацию о клинической полезности и проблемах безопасности, связанных с более высоким диапазоном опиоидов. дозирование анальгетиков (как более сильнодействующих, так и более высоких суточных доз) в амбулаторных условиях.FDA заинтересовано в лучшем понимании текущего клинического использования; ситуации, которые могут потребовать применения более высоких доз опиоидных анальгетиков; и величина и частота вреда, связанного с более высокими дозами опиоидных анальгетиков по сравнению с более низкими дозами, а также оптимальные стратегии управления этими рисками при обеспечении доступа к надлежащему обезболиванию для пациентов. 20 июня FDA выпустило проект руководства «Опиоидные анальгетические препараты: соображения для системы оценки пользы и риска», в котором описывается применение системы оценки пользы и риска, которую агентство использует при оценке заявок на опиоидные анальгетики, и обобщается информация, которая могут предоставляться заявителями на опиоидные анальгетики, чтобы помочь агентству в оценке пользы и риска, включая рассмотрение более широкого воздействия этих продуктов на здоровье населения в контексте этого кризиса. , июль : 2 июля FDA предупредило переупаковщиков, распространяющих фармацевтические ингредиенты, включая опиоиды, за то, что они подвергают потребителей риску из-за серьезных нарушений стандартов качества производства. 20 сентября FDA опубликовало заявление о продолжающихся усилиях агентства по увеличению доступности всех форм налоксона для снижения смертности от передозировки опиоидами. 20 сентября FDA объявило об одобрении новой упаковки для лоперамида, отпускаемого без рецепта, с целью предотвращения злоупотреблений и злоупотреблений. 26 сентября FDA провело совместное заседание Консультативных комитетов по безопасности педиатрии и лекарственных препаратов и управлению рисками, чтобы обсудить ориентированный на педиатрию обзор безопасности таблеток с расширенным высвобождением оксикодона (оксикодона гидрохлорида) в соответствии с требованиями Управления по контролю за продуктами и лекарствами. Act (Pub. L. 112-144), а также обсудить соображения педиатрических данных для маркировки опиоидных анальгетиков и исследования Закона о равноправии педиатрических исследований для опиоидов в целом, используя Opana IR в качестве примера. 30 сентября 2019 г. FDA и DEA предупредили операторов веб-сайтов о незаконной продаже опиоидов
Октябрь: 24 октября FDA обрисовало в общих чертах достижения агентства за первый год внедрения полномочий Закона о ПОДДЕРЖКЕ для решения проблемы опиоидного кризиса
Ноябрь: 26 ноября , FDA выпускает предупреждающее письмо для продуктов, незаконно продаваемых для лечения состояний здоровья, включая симптомы отмены опиоидов
Декабрь: 11 декабря FDA выпустило предупреждающее письмо о том, что самые серьезные риски не включаются в рекламу лекарственного средства для лечения
19 декабря Национальные академии наук, инженерии и медицины выпустили согласованный отчет по заказу FDA о разработке рекомендаций по назначению опиоидов при острой боли.
2020
Январь: 14 января FDA созвало совместное заседание Консультативного комитета по обезболивающим и обезболивающим лекарственным препаратам и Консультативного комитета по безопасности лекарственных средств и управлению рисками для обсуждения заявки на новый лекарственный препарат (NDA) оксикодегола, нового молекулярного объекта. Агонист -опиоидных рецепторов, представленный Nektar Therapeutics, для лечения хронической боли в пояснице у взрослых пациентов с болью, достаточно сильной, чтобы требовать ежедневного, круглосуточного, длительного лечения опиоидами, и для которых альтернативные варианты лечения неадекватны.Комитеты попросили обсудить данные по безопасности и эффективности, а также общий профиль риска и пользы продукта.
15 января FDA провело совместное заседание Консультативного комитета по обезболивающим и обезболивающим препаратам и Консультативного комитета по безопасности лекарственных средств и управлению рисками. Во время утреннего заседания комитеты обсудили NDA для трамадола 44 миллиграмма (мг) и таблетки целекоксиба 56 мг, которые содержат комбинацию фиксированных доз опиоида и нестероидного противовоспалительного препарата, представленные Esteve Pharmaceuticals, S.A. для купирования острой боли у взрослых, которая достаточно сильна, чтобы потребовать опиоидного анальгетика, и для которой альтернативные методы лечения неадекватны. Комитеты попросили обсудить данные по безопасности и эффективности, а также общий профиль риска и пользы продукта.
Во время дневного заседания комитеты обсудили NDA для пероральной таблетированной формы оксикодона с пролонгированным высвобождением, представленной Intellipharmaceutics Corp., для лечения умеренной и сильной боли при непрерывном круглосуточном приеме опиоидных анальгетиков. необходимо в течение длительного периода времени.Продукт был разработан со свойствами, предназначенными для предотвращения злоупотреблений, и заявитель представил данные, подтверждающие эти сдерживающие свойства для этого продукта. Комитеты попросили обсудить, продемонстрировал ли заявитель сдерживающие от злоупотреблений свойства своего продукта, которые поддерживают маркировку, а также общий профиль риска и пользы продукта.
Июнь: 8 июня FDA и Национальное управление по телекоммуникациям и информации (NTIA) запускают 120-дневный пилотный проект, чтобы помочь сократить доступность несанкционированных опиоидов, незаконно выставленных на продажу в Интернете.
июля : 23 июля FDA выпустило сообщение о безопасности лекарств, в котором объявлялось, что агентство требует от производителей лекарств для всех опиоидных болеутоляющих и лекарств для лечения OUD, чтобы они добавили новые рекомендации по налоксону в информацию о назначении, чтобы помочь обеспечить здоровье. Специалисты по уходу обсуждают доступность налоксона и оценивают потребность каждого пациента в рецепте налоксона, когда назначаются или возобновляются опиоидные обезболивающие или лекарства для лечения OUD.Кроме того, агентство рекомендовало медицинским работникам рассмотреть возможность назначения налоксона пациентам с повышенным риском передозировки опиоидами, независимо от того, получают ли они рецепт на опиоидное болеутоляющее или лекарство для лечения OUD. Сюда могут входить люди с текущим или прошлым диагнозом OUD или которые ранее перенесли передозировку опиоидов.
августа : 7 августа FDA одобрило Олинвик (олицеридин), опиоидный агонист для лечения умеренной и сильной острой боли у взрослых, когда боль достаточно сильна, чтобы требовать внутривенного введения опиоидов, и для которых существуют альтернативные методы лечения. неадекватный.
Август: 6 августа FDA одобрило предварительное одобрение заявки на новое лекарственное средство, которое предусматривает продление срока хранения назального спрея Наркан (налоксона гидрохлорид) с текущего 2-летнего срока хранения до 3-х лет и обновления маркировка.
Сентябрь: 10-11 сентября FDA провело совместное заседание Консультативного комитета по безопасности лекарственных средств и управлению рисками и Консультативного комитета по обезболивающим и обезболивающим препаратам для обсуждения результатов необходимых постмаркетинговых исследований (Постмаркетинговые требования 3051-1, стр. 3051-2, 3051-3 и 3051-4), в которых оценивали эффект изменения состава оксиконтина (таблетки с пролонгированным высвобождением гидрохлорида оксикодона, производимые Purdue Pharma L.P., NDA 022272) о злоупотреблении, неправильном использовании, а также передозировке с летальным и несмертельным исходом, связанной с оксиконтином. Комитеты обсудили, продемонстрировали ли эти исследования вместе с другой информацией из опубликованной литературы, что переработанный продукт Оксиконтин привел к значительному снижению этих результатов. Комитеты также обсудили более широкое влияние изменения рецептуры Оксиконтина на общественное здоровье.
Октябрь: 2 октября FDA опубликовало окончательное руководство для промышленности «Расстройство, связанное с употреблением опиоидов: конечные точки для демонстрации эффективности лекарственных средств для лечения», которое предназначено для помощи спонсорам в разработке лекарств для лечения расстройства, связанного с употреблением опиоидов (OUD).В этом руководстве рассматриваются клинические конечные точки, приемлемые для демонстрации эффективности таких препаратов.
Ноябрь: 2 ноября FDA созвало совместное заседание Консультативного комитета по обезболивающим и обезболивающим лекарственным средствам и Консультативного комитета по безопасности лекарственных средств и управлению рисками для обсуждения нового лекарственного препарата Гайдексора, комбинированной пероральной таблетки с фиксированной дозой. представленный Õlas Pharma, Inc., содержащий гидрокодон, ацетаминофен и прометазин, для краткосрочного (не более 3 дней) купирования острой послеоперационной боли, достаточно сильной, чтобы потребовать опиоидного анальгетика и предотвращения индуцированной опиоидами тошнота и рвота у пациентов, которые подвержены риску или имеют в анамнезе тошноту и рвоту.
Декабрь: 23 декабря FDA завершило модификацию стратегии оценки и смягчения риска трансмукозального фентанила с немедленным высвобождением (TIRF) (REMS), чтобы устранить постоянство практики назначения лекарств и улучшить способность агентства отслеживать нежелательные явления и последствия. обеспечить безопасное использование этих лекарств.
2021
Февраль: 1 февраля FDA предоставило обновленную информацию о пилотной программе с Национальным управлением по телекоммуникациям и информации (NTIA) и тремя реестрами доменных имен, чтобы помочь уменьшить доступность несанкционированных опиоидов, незаконно выставленных на продажу в Интернете.
Февраль: 16 февраля FDA направило AcelRx Pharmaceuticals, Inc. письмо с предупреждением о ложной и вводящей в заблуждение рекламе Dsuvia (сублингвальная таблетка суфентанила), сильнодействующего опиоидного анальгетика.
Март: 1 марта FDA одобрило битартрат гидрокодона (препарат из справочного списка: Hysingla ER), первый одобренный FDA непатентованный опиоид с составом, сдерживающим злоупотребление (ADF), что означает, что продукт обладает свойствами, которые, как ожидается, уменьшат Злоупотребление препаратом, когда его разжевывают, а затем принимают внутрь, измельчают и вдыхают, или вводят в виде инъекций, хотя и не полностью предотвращают его полное предотвращение.
Март: 24 марта FDA выпустило официальный документ «Введение в модель опиоидных систем FDA», в котором представлены усилия FDA по моделированию опиоидных систем, обсуждаются потенциальные применения модели, дается обзор масштабов и структуры модели, подчеркивается предварительная информация. области для потенциального анализа политики и краткое описание текущей работы.
Апрель: 15 апреля FDA провело открытый семинар «Эквиваленты морфина в миллиграммах: текущие приложения и пробелы в знаниях, возможности исследований и будущие направления», чтобы собрать вместе заинтересованные стороны для обсуждения научной основы эквивалентов морфина в миллиграммах (MME) с цели обеспечения понимания науки и данных, лежащих в основе существующих расчетов MME для опиоидных анальгетиков, обсуждения пробелов в этих данных и обсуждения будущих направлений для уточнения и улучшения научной основы приложений MME.
Апрель: 29 апреля FDA одобрило инъекцию сульфата морфина, опиоидного анальгетика для снятия сильной боли, для которой альтернативные методы лечения неадекватны.
Апрель : 30 апреля FDA одобрило назальный спрей налоксона гидрохлорид с более высокой дозой для лечения передозировки опиоидов.
Июнь: 2 июня FDA одобрило пероральный раствор сульфата морфина и таблетки сульфата морфина, опиоидные анальгетики для лечения сильной боли у взрослых и детей, для которых другие варианты обезболивания неадекватны.
финансовых штрафов, наложенных на крупные фармацевтические компании за незаконную деятельность | Право и медицина | JAMA
Некоторые фармацевтические компании подвергались критике за участие в незаконной деятельности, такой как предоставление откатов и взяток, сознательная доставка фальсифицированных или зараженных лекарств в аптеки и сбыт лекарств для несанкционированного использования. В этом исследовании изучались финансовые санкции за незаконную деятельность среди крупных фармацевтических фирм по отношению к годовой выручке.
Мы собрали данные о финансовых штрафах для фармацевтических фирм, включенных в списки Global 500 или Fortune 1000, используя процедуры, аналогичные Almashat et al. 1 В соответствии с предыдущим исследованием 2 мы проанализировали все фирмы, которые соответствовали критериям включения и появлялись в списке в течение 7 или более лет. Все случаи финансовых штрафов в соответствии с расчетами штатов и федеральными властями в период с января 2003 года по декабрь 2016 года были получены от Министерства юстиции США, Комиссии США по ценным бумагам и биржам, Агентства по охране окружающей среды США и генеральных прокуроров штатов.В каждом урегулировании указывалась сумма штрафа и описывались масштабы, тип и продолжительность связанной с этим незаконной деятельности. Мы получили недостающие данные с помощью запросов Закона о свободе информации. Финансовые штрафы были отнесены к расчетному году.
Для корректировки на инфляцию мы рассчитали совокупную долларовую стоимость финансовых штрафов каждой фирмы за каждый год и применили дефлятор валового внутреннего продукта Бюро экономического анализа, чтобы преобразовать совокупную сумму в доллары 2016 года.Когда в течение исследуемого периода фирмы сливались с другими фирмами или были приобретены ими, мы относили все выплаты по штрафам, как до, так и после приобретения, к фирме, которая занималась незаконной деятельностью. Мы рассчитали средний размер штрафа, разделив общую долларовую стоимость финансовых штрафов каждой компании на общее количество штрафов, наложенных в течение периода исследования. Мы рассчитали общую долларовую стоимость финансовых штрафов каждой компании как процент от их общих доходов за период исследования, используя данные Compustat, Mergent Online, Edgar Direct и годовые отчеты, поданные в Комиссию по ценным бумагам и биржам.Мы предоставили среднюю продолжительность незаконной деятельности для штрафов, установленных за исследуемый период. Мы использовали контент-анализ, чтобы классифицировать каждое поселение на один или несколько видов незаконной деятельности и суммировать частоту по фирмам и типам незаконной деятельности.
Из 26 фирм в нашей выборке у 22 (85%) были финансовые санкции за незаконную деятельность. Суммарная долларовая стоимость финансовых штрафов за период с 2003 по 2016 год составила 33 миллиарда долларов. На одиннадцать фирм с финансовыми штрафами, превышающими 1 миллиард долларов с поправкой на инфляцию, пришлось 28 долларов.8 миллиардов (88%) от общей суммы штрафов (Таблица 1). Фирмы с самыми высокими штрафами в процентах от выручки (т. Е.> 1%): Schering-Plough, GlaxoSmithKline, Allergan и Wyeth; количество штрафов для этих фирм варьировалось от 1 (Allergan) до 27 (GlaxoSmithKline). Четыре фирмы имели финансовые штрафы на общую сумму менее 80 миллионов долларов и не более двух штрафных санкций (Actavis [Watson], Roche Group, Genzyme и Perrigo). Все фирмы, кроме 1 (Perrigo), занимались незаконной деятельностью, связанной с штрафными санкциями, в течение 4 и более лет.Еще 4 фирмы не понесли финансовых штрафов за незаконную деятельность в течение этого периода. Самыми распространенными видами незаконной деятельности, влекущей за собой штрафные санкции (таблица 2), были нарушения ценообразования, внебиржевой маркетинг и откаты. Фирмы с наибольшим разнообразием видов незаконной деятельности, предусматривающей наказание, были GlaxoSmithKline, Bristol Myers Squibb и Merck. У трех фирм (Actavis, Allergan и Perrigo) штрафы ограничивались одним типом нарушения.
Среди крупных фармацевтических компаний, включенных в это исследование, 85% имели доказательства финансовых штрафов за незаконную деятельность.Учитывая масштабы и характер незаконной деятельности, предусматривающей финансовые санкции, врачи и регулирующие органы должны проявлять бдительность в отношении деятельности крупных фармацевтических фирм. У четырех фирм не было обнаружено наказаний за незаконную деятельность в течение периода выборки. Это может указывать на возможность необнаружения незаконной деятельности, хотя вместо этого у этих фирм могут быть эффективные программы соблюдения этических норм и соблюдения нормативных требований. 3 , 4
Ограничения исследования включают сосредоточение внимания на крупнейших фирмах, исключение коллективных расчетов и штрафов со стороны неамериканских правительств, а также возможность того, что некоторые расчеты были пропущены.Кроме того, исследовались только поселения за ограниченный период времени; Отражают ли эти данные текущую деятельность фармацевтических компаний или увеличиваются или уменьшаются финансовые санкции за незаконную деятельность в последнее время, не может быть определено. Другие отрасли также занимаются незаконной деятельностью, но сравнительный анализ выходит за рамки настоящего исследования.
Автор для переписки: Денис Г. Арнольд, доктор философии, Белк-колледж бизнеса, Университет Северной Каролины в Шарлотте, 9201 University City Blvd, Charlotte, NC 28223 (denisarnold @ uncc.эду).
Принято к публикации: 4 сентября 2020 г.
Вклад авторов: Доктора Стюарт и Бек имели полный доступ ко всем данным в исследовании и несли ответственность за целостность и точность данных. анализ.
Концепция и дизайн: Все авторы.
Сбор, анализ или интерпретация данных: Все авторы.
Составление рукописи: Все авторы.
Критический пересмотр рукописи для важного интеллектуального содержания: Арнольд, Стюарт.
Статистический анализ: Стюарт, Бек.
Получено финансирование: Арнольд.
Административная, техническая или материальная поддержка: Арнольд.
Куратор: Арнольд.
Раскрытие информации о конфликте интересов: Не сообщалось.
Финансирование / поддержка: Финансируется Фондом Суртмана и Белк-колледжем бизнеса Университета Северной Каролины в Шарлотте.
Роль спонсоров / спонсора: Спонсоры не играли никакой роли в разработке и проведении исследования; сбор, управление, анализ и интерпретация данных; подготовка, рецензирование или утверждение рукописи; и решение представить рукопись для публикации.
Заявление об ограничении ответственности: Мнения, выраженные в этой статье, принадлежат авторам, а не официальной позицией спонсоров или их аффилированных организаций.
Дополнительные взносы: Платную помощь в проведении исследований оказали Джейн Томас, доктор философии, Северо-Западный университет Пердью, и Куртис Чарлинг, магистр делового администрирования, и Стефани Дуэннерман, степень магистра делового администрирования, Университет Небраски, Линкольн.
1.Алмашат С, Престон C, Уотерман Т, Вульф S. Быстрое повышение уголовных и гражданских денежных наказаний в отношении фармацевтической промышленности: с 1991 по 2010 год . Общественная группа исследований здоровья граждан; 2010.
2. Каннелла. AA, Парк JH, Ли HU. Разнообразие функционального фона команды топ-менеджмента и производительность фирмы: изучение ролей размещения членов команды и экологической неопределенности. Академический менеджмент J . 2008; 51 (4): 768-784. DOI: 10.2307 / 20159538Google Scholar3.Weaver GR, Тревино LK, Кокран PL. Интегрированная и несвязанная корпоративная социальная деятельность: обязательства руководства, внешнее давление и практика корпоративной этики. Академический менеджмент J . 1999; 42 (5): 539-552. DOI: 10.
 Коэффициенты ранговой корреляции Спирмена между средним индивидуальным рейтингом и средним командным рейтингом для каждого фактора были следующими (перечислены в порядке убывания): 0,909 для команды E ( p <0,001), 0,826 для команды B ( p <0,001). ), 0,735 для команды C ( p = 0,001), 0,688 для команды H ( p = 0,003), 0,538 для команды G ( p = 0,031), 0,418 для команды A ( p = 0,11), 0,215 для команды D ( p = 0,42), -0,521 для команды F ( p = 0.039).
Коэффициенты ранговой корреляции Спирмена между средним индивидуальным рейтингом и средним командным рейтингом для каждого фактора были следующими (перечислены в порядке убывания): 0,909 для команды E ( p <0,001), 0,826 для команды B ( p <0,001). ), 0,735 для команды C ( p = 0,001), 0,688 для команды H ( p = 0,003), 0,538 для команды G ( p = 0,031), 0,418 для команды A ( p = 0,11), 0,215 для команды D ( p = 0,42), -0,521 для команды F ( p = 0.039).